1b. 辽宁工程技术大学 材料科学与工程学院, 辽宁 阜新 123000;
1c. 辽宁工程技术大学 矿业学院, 辽宁 阜新 123000;
2. 大同煤矿集团有限责任公司, 山西 大同 037003
1b. College of Materials Science and Engineering, Liaoning Technical University, Fuxin 123000;
1c. College of Mining Engineering, Liaoning Technical University, Liaoning Technical University, Fuxin 123000, P. R. China;
2. Datong Coal Mine Group Co. Ltd., Datong 037003, P. R. China
煤炭氧化自燃不仅会引发矿井火灾,破坏井下绿色开采环境,甚至还将导致瓦斯爆炸,严重威胁工作人员的生命健康,造成煤炭资源的浪费。而高硫煤氧化自燃将产生SOx,更加污染大气环境。煤炭自燃机理及其预防技术的研究已经有数百年的历史,取得了大量的研究成果,形成了矿井火灾防治技术体系,并成功应用于生产实践中,取得了显著的灾害防控效果。近些年,随着相关基础理论与实验技术手段的发展,学者对于煤炭自燃机理的研究也越来越深入。国内外很多学者采用热重及红外光谱实验等方法检测煤低温氧化生成的气体来研究煤的自燃特性[1-3]。中国矿业大学安全实验室专门研制了一套模拟煤氧化的实验系统,通过拟合气体浓度与温度的变化曲线来研究煤的氧化规律[4]。王德明等[5]通过研究煤结构吸附氧气的红外特征来研究煤的吸附机理。王继仁等[6-8]对煤中多种活性基团吸附氧分子的机理进行了量子化学研究。Bhoi[9]应用分子动力学方法分析不同条件对褐煤热解与燃烧反应的影响。邓存宝等[10-11]研究了煤中苯硫酚、噻吩结构的反应机理。目前,未有学者研究煤吸附氧气和氧化反应的能量补给关系。宏观上,现未有能够精确测得这一关系的实验仪器。因此,笔者从微观角度,运用量子化学原理,对煤中脂肪族硫醚结构(C6H5CH2SCH3)与O2的吸附和氧化全过程进行研究,从而阐述煤吸附O2分子和氧化反应的能量补给关系,为预防煤的自燃提供理论基础。
1 计算方法应用Gaussian 03[12]程序,采用密度泛函理论(density functional theory,DFT),对煤中脂肪族硫醚结构(C6H5CH2SCH3)与O2分子间形成的复合物进行几何构型全优化,并进行了频率计算,所得构型均没有虚频,证明是基态稳定构型。全部计算均在B3LYP/6-31G (d, p)水平下进行,这是目前关于反应机理研究比较常用的方法基组。采用完全均衡校正方法CP(Counterpoise Procedure)[13]对体系的几何构型进行校正,修正由于基函数迭加误差(BSSE)产生的几何构型偏差,从而得到煤中脂肪族硫醚结构(C6H5CH2SCH3)与O2分子间形成复合物的几何构型及其分子间相互作用能。在相同水平上,计算煤中脂肪族硫醚结构(C6H5CH2SCH3)与O2分子形成的复合物的核外电子分布情况,并利用软件Multiwfn 3.3[14]进行电子密度数据处理,绘制复合物的电子密度差Δρ图。然后,在相同水平下对煤中脂肪族硫醚结构(C6H5CH2SCH3)与O2分子及其反应过程相关的产物、中间体和过渡态进行几何优化,并对反应过程中每一个驻点进行振动频率检验[15-16],反应过程中稳定构型的全部频率均为正值,过渡态构型有一个频率为负值,其他频率均为正值。同时,需要对过渡态进行内禀反应坐标校验,从而证明反应过程中各驻点之间的相关性,确定过渡态的正确连接[17-18]。在以下的讨论中,将反应物(C6H5CH2SCH3+O2)的总能量设为能量零点。
2 结果与讨论 2.1 煤中脂肪族硫醚物理吸附O2应用Gaussian程序对煤中C6H5CH2SCH3中硫醚结构与O2分子相互作用模型进行优化计算,得到O2分子与C6H5CH2SCH3结构相互作用的稳定构型ComplexⅠ(见图 1)。相互作用距离dS-O为2.582 Å,经CP校正确定复合物Ⅰ在热力学上是稳定的。经过计算可知,此吸附过程释放物理吸附热为20.60 kJ/mol。
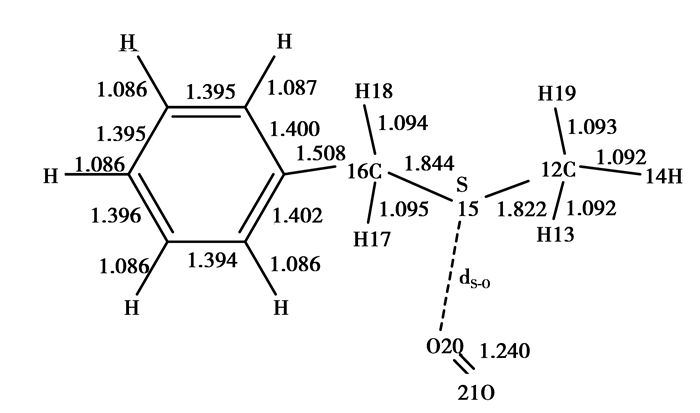
|
图 1 ComplexⅠ的几何构型(键长单位:Å) Figure 1 Geometry of ComplexⅠ(Bond lengths: Å) |
在B3LYP/6-31G(d, p)水平下,作ComplexⅠ形成过程的逐点势能扫描曲线(图 2)。由图 2可以看出,扫描曲线是一条平滑的曲线,当15S与20O原子间距离dS-O大于5.450 Å时,复合物的势能基本不发生变化;从dS-O等于5.450 Å开始,势能随着dS-O的缩短而逐渐减小,在2.582 Å处,能量达到局部低谷,这一点的构型即为ComplexⅠ。因此,ComplexⅠ为O2分子与C6H5CH2SCH3结构相互作用的稳定构型,且其吸附O2分子是一个无势垒的过程。
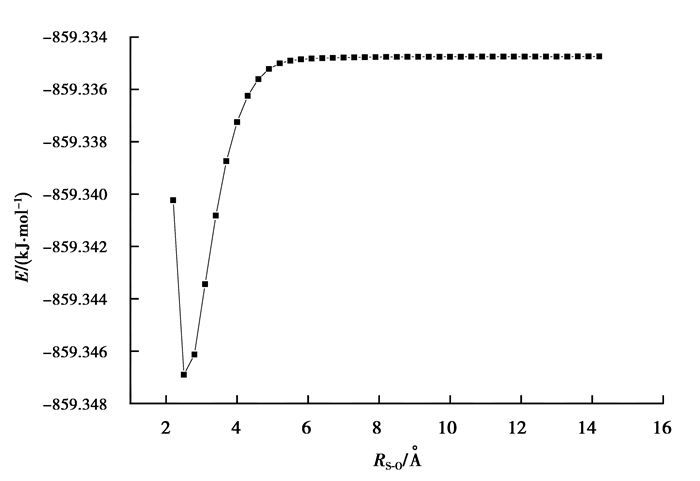
|
图 2 ComplexⅠ形成过程的逐点势能扫描曲线 Figure 2 Scanning curve of energy point by point for the formation process of ComplexⅠ |
作ComplexⅠ与组成它的各片段电子密度差,分析相互作用能类型。首先在Gaussview中观察一下ComplexⅠ电子密度差等值面图(图 3(a)),等值面值取±5e-5。为了看见内部,图形选择了半透明表示。紫色为正,是电子密度增加区域,增加区域的电荷量记为0.898 8;青色为负,是电子密度减少区域,减少区域的电荷量记为-0.898 7。电子密度差等值面图有些笼统,特别是可能出现密度差正负等值面相互包裹、遮盖。为了清楚观察到C6H5CH2SCH3与O2分子的相互作用,选取15S、17H和20O 3点确定的平面,进一步作了ComplexⅠ的截面等值线图(图 3(b)),等值线起始值取±5e-5。紫红色实线为正,是电子密度增加区域;青色虚线为负,是电子密度减少区域。由图 3(b)可以看出,根据Pauil原理,O2分子向S原子靠近,受双方电子斥力的影响,20O与15S之间的电子被挤走。电子排斥退让,向周边转移,致使两核前锋进一步裸露,进而形成一个低能垒势阱,周围余下的电子会收缩,灵动的电子反而会向其流动,核间共享电子增加,产生了电子与两核间的引力,受到引力作用形成了图 3(a)所示情况,外侧电子向内侧转移,从而达到平衡态。以上分析可确定,O2分子与S原子间并未形成共价作用。因此,ComplexⅠ分子间的相互作用为范德华相互作用,属于物理吸附。
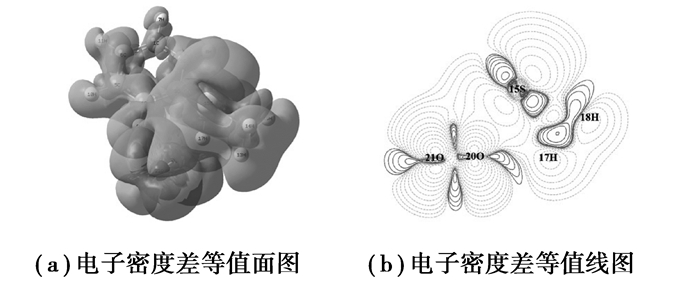
|
图 3 ComplexⅠ与各片段的电子密度差图 Figure 3 Electron density difference map of ComplexⅠwith each fragment |
煤中C6H5CH2SCH3结构物理吸附O2形成ComplexⅠ后,当吸收足够的能量时,将发生化学吸附,并进一步发生化学反应。对于煤中脂肪族硫醚结构(C6H5CH2SCH3)与O2的反应,计算所得的各条反应路径如下所示:
Path1: R→ComplexⅠ→TS1→IM1→TS2→IM2→TS3→IM3→TS4→IM4→TS5→P1(C6H5CH2OCH3+SO),
Path2: R→ ComplexⅠ→TS1→IM1→TS2→IM2→TS3→IM3→TS6→IM5→TS7→IM6→TS8→IM7→TS9 →P2(C6H5CHSO+CH3OH),
Path3: R→ComplexⅠ→TS10→IM8→TS11→IM9→TS12→IM10→TS13→IM11→TS14→P2(C6H5CHSO+CH3OH),
Path4: R→ ComplexⅠ→TS10→IM8→TS11→IM9→TS12→IM10→TS13→IM11→TS15→IM12→TS16→ IM13→TS17→P3(C6H5CH2SOH+CH2O),
Path5: R→ ComplexⅠ→TS10→IM8→TS11→IM9→TS12→IM10→TS13→IM11→TS15→IM12→TS16→ IM13→TS18→IM14→TS19→IM15→TS20→IM16→TS21→P4(C6H5CHSCHOH+H2O)。
其中,反应路径中各个驻点的表示符号分别为:反应物R,反应中间体IM,过渡态TS,产物P。经过量子化学分析,得到各驻点的相对能量,按照反应进程绘制C6H5CH2SCH3与O2的反应势能面剖面图如图 4所示。表 1列出了反应物、产物、中间体和过渡态的总能量、零点振动能及相对能量。其中,相对能量RE为相对反应物的总能量减去相对反应物的零点振动能。
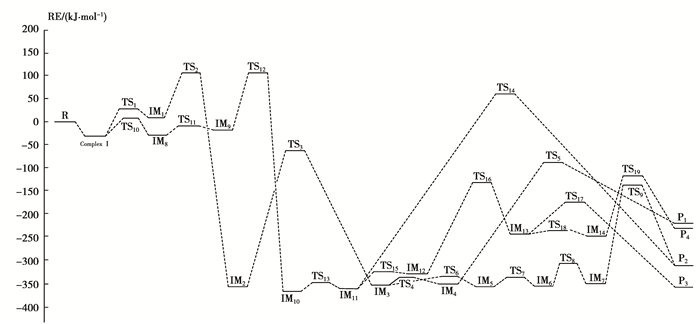
|
图 4 在B3LYP/6-31G(d, p)水平下C6H5CH2SCH3与O2反应的反应势能面剖面图 Figure 4 Schematic profile of the potential energy surface for C6H5CH2SCH3 and O2 at the B3LYP/6-31G(d, p) level |
| 表 1 C6H5CH2SCH3与O2反应的反应物、产物、中间体和过渡态的总能量(TE)、零点振动能(ZPVE)以及相对能量(RE) Table 1 Total energies (TE), zero-point vibration energies (ZPVE), and relative energies (RE) of reactants, products, intermediate, and transition states on the reaction for C6H5CH2SCH3 and O2 |
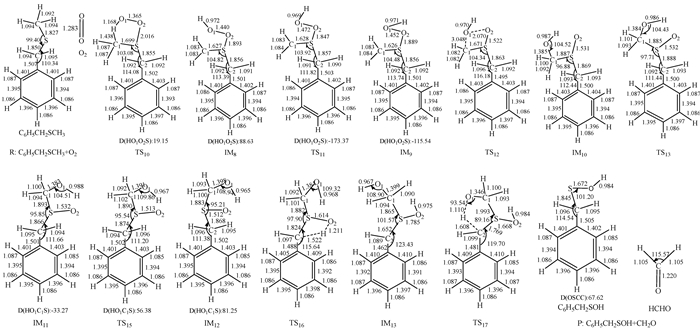
煤中脂肪族硫醚结构(C6H5CH2SCH3)和O2的反应过程是复杂的多步反应。根据Gaussian 03程序计算结果可知,C6H5CH2SCH3与O2的初始结合方式主要有两种,第一种:反应物R形成ComplexⅠ后,O2分子不断向S原子靠近,经过过渡态TS1异构化为中间体IM1,此过程需要克服的化学势垒为31.61 kJ/mol,形成IM1的过程需要吸收8.96 kJ/mol,在热力学上这是不利的过程;第二种:反应物R形成ComplexⅠ后,如图 5所示,O2分子一侧与S原子连接,另一侧与甲基上的H原子相连,经过过渡态TS10异构化为中间体IM8,此过程需要克服的势垒为12.36 kJ/mol,形成中间体IM8能够释放26.81 kJ/mol的热量,热力学稳定性高,因此,预测此种结合是此反应的主要反应入口。C6H5CH2SCH3物理吸附一个O2分子释放的能量足够供给反应物R克服势垒形成中间体IM8,充分说明煤中C6H5CH2SCH3结构的氧化反应很容易发生。
|
图 5 Path 4反应历程的各驻点的几何构型(键长单位:10-1 nm,角度的单位:度) Figure 5 Geometries of all stagnation point on Path 4 (Bond lengths: 10-1 nanometer, bond angles: degrees) |
从反应过程的势能面剖面图图 4可以看出,影响Path1反应进程的2个速控步骤分别为过渡态TS3和TS5,第一速控步骤TS3的化学势垒为293.60 kJ/mol,第二速控步骤TS5的化学势垒为258.54 kJ/mol。影响Path 2反应进程的2个速控步骤分别为TS3和TS9,第一速控步骤与Path1相同,第二速控步骤过渡态TS9的化学势垒为211.79 kJ/mol。Path2的第二速控步骤反应能垒比Path1的第二速控步骤反应能垒低46.75 kJ/mol。因此,Path2优于路径Path1。Path 3的速控步骤反应能垒比Path 2和Path 1的速控步骤反应能垒高127.38 kJ/mol。因此,Path 3在路径的竞争中处于劣势。Path 4的2个速控步骤分别为TS16和TS12,第一速控步骤TS16的化学势垒为198.23 kJ/mol,第二速控步骤TS12的势垒为125.79 kJ/mol。Path 4的第一速控步骤需要克服的势垒比Path 2的第一速控步骤需要克服的势垒低95.37 kJ/mol。因此,Path 4优于Path 2。Path 5的第一速控步骤与Path 4相同,同为过渡态TS16(势垒为198.23 kJ/mol),Path 5的第二速控步骤为过渡态TS21(势垒为131.65 kJ/mol)。Path 5的第二速控步骤需要克服的势垒比Path 4的第二速控步骤需要克服的势垒高5.86 kJ/mol。因此,Path 4优于Path 5。则Path 4是反应的主反应路径,其产物P3(C6H5CH2SOH+CH2O)是反应的主产物。
图 5列出了Path4反应过程中各个驻点的几何构型。在受热条件下,O2分子与煤中硫醚结构经过足够能量的碰撞形成高势能的过渡态TS10,过渡态不稳定迅速异构化为中间体IM8,此过程需要克服的势垒为12.36 kJ/mol。中间体IM8是一个过氧化物结构,非常不稳定,极易裂解。接下来,甲基中与O1原子相连接的H原子以O1—O2键为轴顺时针旋转异构化为中间体IM9,此过程的过渡态TS11需要克服的化学势垒为15.46 kJ/mol,构型的二面角D(HO1O2S)发生了很大的变化,中间体IM8的二面角D(HO1O2S)为88.63°,经过异构化后二面角D(HO1O2S)变为-115.54°。然后,过氧化物IM9上的H—O1基经过渡态TS12从O2原子一侧向C1原子逐步迁移,异构化为中间体IM10,由IM9→IM10的过程需要克服的势垒为125.79 kJ/mol。从结构上看,中间体IM10相对来说已经很稳定了,但与S连接的O2原子的电子并未达到饱和。因此,在受热条件下中间体IM10会继续异构化,其上S原子以S—C2键为轴顺时针旋转,经过过渡态TS13克服16.57 kJ/mo l的化学势垒异构化为中间体IM11。中间体IM11上的O1—H基经过渡态TS15以C1—O1键为轴逆时针旋转,克服38.25 kJ/mol的化学势垒异构化为中间体IM12,其二面角D(HO1C1S)由原来的-33.27°变为81.25°。中间体IM12上的一个C2—H键拉长,同时此H原子与O2原子作用力加强,经过过渡态TS16,H原子迁移形成中间体IM13,这一过程需克服的势垒为198.23 kJ/mol。此时,中间体IM13上的C2原子为不饱和碳,对O1原子上的H原子产生了作用力,同时C1—S键拉长,经过过渡态TS17,分解为产物P3,中间体IM13的C1—S键的键长为1.865 Å,而过渡态TS17的C1—S键的键长为1.993 Å,IM13→P3的过程需要克服的势垒为72.21 kJ/mol。
主反应路径要通过速控步骤来判定,但路径发生难易跟每个驻点都息息相关。由以上分析确定Path 4是5条反应路径中最优的一条,但其能否实现,需要深入分析。由图 4可知,Path 4中除TS10和TS12以外每一驻点的势能都低于反应物R,且产物P3的势能要比反应物R低357.22 kJ/mol,这表明:整个反应过程是放热反应,但包括吸收外部热量克服反应势垒部分,吸热部分正是整个过程的重大障碍。反应物越过过渡态TS10需要12.36 kJ/mol的能量,比物理吸附1个O2分子释放的能量还低。但是,中间体IM9越过过渡态TS12需要克服的势垒为125.79 kJ/mol,形成中间体IM9释放了17.94 kJ/mol的能量,还需外界给予107.86 kJ/mol,相当于物理吸附5个O2分子释放的能量。因此,煤中C6H5CH2SCH3结构易发生初步氧化,但若要深度氧化将Path 4进行下去,总共需要从外界吸收相当于物理吸附6个O2分子释放的能量,才能跃过TS12这一驻点,继续进行后面的放热氧化步骤。
3 结论1) 煤中C6H5CH2SCH3结构物理吸附O2分子形成ComplexⅠ,其相互作用距离dS-O为2.582 Å,经CP校正后的相互作用能为-20.60 kJ/mol,在热力学上是稳定的,相互作用为范德华力。
2) 煤中C6H5CH2SCH3结构氧化共有5条反应路径,Path 4是反应的主反应路径,其产物P3(C6H5CH2SOH+CH2O)是反应的主产物。
3) 煤中C6H5CH2SCH3结构易发生初步氧化,仅需12.36 kJ/mol的能量,物理吸附1个O2分子释放的能量足以提供,但若要深度氧化将Path 4进行下去,需要再从外界吸收相当于物理吸附5个O2分子释放的能量。
| [1] | Baris K, Kizgut S, Didari V. Low-temperature oxidation of some Turkish coals[J]. Fuel, 2012, 93(1): 423–432. |
| [2] | Fujitsuka H, Ashida R, Kawase M, et al. Examination of low-temperature oxidation of low-rank coals, aiming at understanding their self-ignition tendency[J]. Energy and Fuels, 2014, 4(28): 2402–2407. |
| [3] |
秦汝祥, 庞文华, 陶远, 等.
TG实验条件对煤氧化燃烧特性的影响分析[J]. 中国安全生产科学技术, 2014, 10(5): 154–158.
QIN Ruxiang, PANG Wenhua, TAO Yuan, et al. Effect of TG wxperimental conditions on the oxidative combustion characteristics of coal[J]. Journal of Safety Science and Technology, 2014, 10(5): 154–158. (in Chinese) |
| [4] |
仲晓星, 王德明, 尹晓丹.
基于程序升温的煤自燃临界温度测试方法[J]. 煤炭学报, 2010, 35(Sup1): 128–131.
ZHONG Xiaoxing, WANG Deming, YIN Xiaodan. Test method of critical temperature of coal spontaneous combustion based on the temperature programmed experiment[J]. Journal of China Coal Society, 2010, 35(Sup1): 128–131. (in Chinese) |
| [5] | Xin H H, Wang D M, Dou G L, et al. The infrared characterization and mechanism of oxygen adsorption in coal[J]. Spectroscopy Letters, 2014, 47(9): 664–675. DOI:10.1080/00387010.2013.833940 |
| [6] |
王继仁, 邓存宝, 邓汉忠, 等.
煤表面对氧分子物理吸附的微观机理[J]. 煤炭转化, 2007, 30(4): 18–21.
WANG Jiren, DENG Cunbao, DENG Hanzhong, et al. Coal surface physical adsorption to oxygen molecules mechanism[J]. Coal Conversion, 2007, 30(4): 18–21. (in Chinese) |
| [7] |
邓存宝, 王雪峰, 王继仁, 等.
煤表面含S侧链基团对氧分子的物理吸附机理[J]. 煤炭学报, 2008, 33(5): 556–560.
DENG Cunbao, WANG Xuefeng, WANG Jiren, et al. Physical adsorption mechanism of coal surface containing sulfur group adsorption to more oxygen molecule[J]. Jounal of China Coal Society, 2008, 33(5): 556–560. (in Chinese) |
| [8] |
刘仲田. 煤对氧分子的吸附机理研究. 阜新: 辽宁工程技术大学, 2007. LIU Zhongtian. Coal adsorption to oxygen molecules mechanism research. Fuxin:Liaoning Technical University, 2007. (in Chinese) http://cdmd.cnki.com.cn/article/cdmd-10147-2008051164.htm |
| [9] | Bhoi S, Banerjee T, Mohanty K. Molecular dynamic simulation of spontaneous combustion and pyrolysis of brown coal using ReaxFF[J]. Fuel, 2014, 136(6): 326–333. |
| [10] |
戴凤威. 煤中含S活性基团与O2的反应机理. 阜新: 辽宁工程技术大学, 2013. DAI Fengwei. Reaction mechanism on S-active groups in coal and O2. Fuxin:Liaoning Technical University, 2013. (in Chinese) http://cdmd.cnki.com.cn/Article/CDMD-10147-1014181546.htm |
| [11] | Frisch M J, Trucks G W, Schlegel H B, et al. Gaussian 03, revision C.02[J]. Journal of Computational Chemistry, 2004, 24(14): 1748–1757. |
| [12] | Boys S F, Bernardi F. The calculation of small molecular interactions by the differences of separate total energies. Some procedures with reduced errors[J]. Molecular Physics, 1970, 100(4): 65–73. |
| [13] | Lu T, Chen F W. Multiwfn:a multifunctional wavefunction analyzer[J]. Journal of Computational Chemistry, 2012, 33(5): 580–592. DOI:10.1002/jcc.v33.5 |
| [14] | Govind N, Petersen M, Fitzgerald G, et al. A generalized synchronous transit method for transition state location[J]. Computational Materials Science, 2003, 28(2): 250–258. DOI:10.1016/S0927-0256(03)00111-3 |
| [15] | Malick D K, Petersson G A, Jr J A M. Transition states for chemical reactions Ⅰ. Geometry and classical barrier height[J]. The Journal of Chemical Physics, 1998, 108(14): 5704–5713. DOI:10.1063/1.476317 |
| [16] | Bakken V, Helgaker T. The efficient optimization of molecular geometries using redundant internal coordinates[J]. Journal of Chemical Physics, 2002, 117(20): 9160–9174. DOI:10.1063/1.1515483 |
| [17] | Ayala P Y, Schlegel H B. A combined method for determining reaction paths, minima, and transition state geometries[J]. Journal of Chemical Physics, 1997, 107(2): 375–384. DOI:10.1063/1.474398 |
 2017, Vol. 40
2017, Vol. 40


