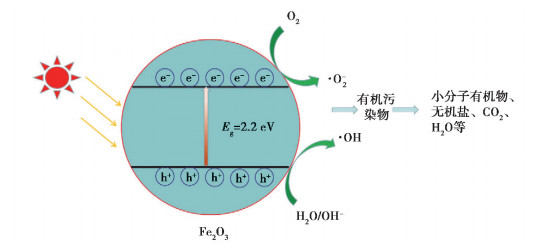
光催化是指在紫外光、可见光或红外光照射下,光催化材料吸收光以后,电子从价带跃迁至导带形成光生电子,价带上形成光生空穴。生成的光生电子和光生空穴分别发生相应的氧化还原反应生成·OH和O2·-等活性氧物质降解水中的有机污染物。光催化技术在水处理领域中的研究和应用历史不算早,相对于其他水处理技术较为新颖,发展也更为迅猛。1977年,Frank等[1]首次将TiO2光催化应用在有机物去除并实现良好的降解效果。自此,光催化氧化技术在去除有机物方面的研究工作取得了很大进展。TiO2拥有的禁带宽度(锐钛矿3.18 eV、金红石3.03 eV)宽,仅能吸收紫外光,在应用中需要使用人工光源而耗费大量能源。太阳光中可见光占据46%而UV仅占据5%的能量,因此开发能够高效利用太阳光的催化剂是非常有必要的。α-Fe2O3具有窄禁带宽度(Eg=2.2 eV),对可见光和紫外光均表现出较好的光化学响应。α-Fe2O3可见光催化机制如图 1所示,在可见光辐照下(λ < 600 nm),光生电子和光生空穴在电场作用下分别迁移至粒子表面。光生电子被水中的溶解氧捕获生成超氧自由基(·O2-),而吸附在催化剂表面的OH-和H2O则与光生空穴反应生成·OH等氧化活性物种。光催化生成的氧化活性物种将水中的有机物矿化为H2O、CO2、SO4-2、PO4-3、NO3-、卤素离子等无机或分子量更小的有机物[2-4]。α-Fe2O3光催化氧化水处理技术已被证明可有效去除水中的染料[5]、酚类污染物[6]、农药[7]、药物[8]等难降解有机污染物,是一种效能优异的光催化剂[9]。α-Fe2O3对太阳光等可见光利用率高,不依赖人工光源即可进行光催化降解有机污染物,因而在水处理领域具有很好的应用前景。然而纯的α-Fe2O3光催化活性仍然无法满足应用要求,通过制备方法优化和掺杂改性对其结构进行修饰是提高其光催化性能的有效方法。笔者综述了纳米α-Fe2O3的制备方法研究现状,并按掺杂剂分类重点综述了掺杂改性α-Fe2O3对光催化活性的调控和影响机制,总结了可见光催化降解有机污染物的研究进展及发展趋势。
|
图 1 α-Fe2O3光催化剂激发原理 Fig. 1 Photocatalyst excitation mechanism of α-Fe2O3 |
α-Fe2O3是禁带宽度为2.0~2.2 eV的n型半导体,吸收阈值为600 nm,对太阳光的利用率高[3]。α-Fe2O3具有典型的刚玉型结构,它是具有a=5.035 6 nm,c=13.748 nm晶格参数特征的三方晶系[10],也由于α-Fe2O3晶体结构的特性而具有良好的化学稳定性和热稳定性,是水处理领域光催化剂的最佳选择之一。纳米α-Fe2O3的制备方法与其结构、形貌和尺寸等紧密关联,进而影响其光催化活性。许多研究者都在努力探索简单可行且光催化活性可控的制备方法。纳米α-Fe2O3制备方法分为物理法和化学法。其中物理法是指对微米级别的α-Fe2O3粒子进行长期研磨,然后在油基介质中分散而得。由于物理制备法耗时且尺寸可控性差,已很少使用。化学法是指通过不同的化学反应过程得到α-Fe2O3的方法。由于化学法操作简单、实验过程可控而受到关注,主要包括化学沉淀法、溶胶凝胶法、水热法以及其他方法。
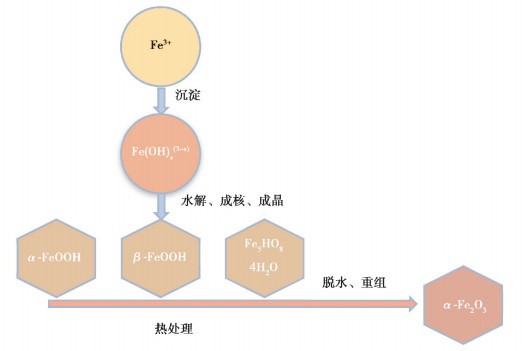
1.1 化学沉淀法典型的化学沉淀法制备纳米α-Fe2O3过程如图 2所示,在一定浓度Fe3+前躯体溶液中加入适当的助沉剂(例如:NaOH、NH3·H2O、尿素,等)形成前驱体沉淀物,沉淀物经过干燥和锻烧后形成粉末状α-Fe2O3。研究表明,不同种类的Fe源以及煅烧温度下制备所得材料其涉及的生长路径有所不同。同时,沉淀过程中前躯体的浓度对纳米α-Fe2O3的结晶度、团聚情况以及形貌生长均产生重要影响。
|
图 2 化学沉淀法中α-Fe2O3形成和转化途径的示意图 Fig. 2 Formation and transformation of α-Fe2O3 |
Imran等[11]以FeSO4·7H2O和FeCl3·6H2O混合水溶液作为Fe源采用共沉淀法制备得到α-Fe2O3纳米颗粒。研究发现,Fe源对应的氢氧化物首先生成Fe3O4,在超过200 ℃煅烧条件下转变成γ-Fe2O3,然后在500 ℃及以上温度下煅烧发生相变,最终形成α-Fe2O3。该过程与典型的仅以单一Fe3+为Fe源时制备的α-Fe2O3的制备路径有所不同。Lassoued等[12]探讨了不同浓度前驱体溶液中Fe3+对α-Fe2O3纳米颗粒形貌的影响。结果表明,随着前躯体浓度的提高,纳米颗粒的粒径增大,结晶度和团聚也随之增加。类似现象在Fouad等[13]的研究中得到了进一步证实。前躯体溶液中Fe3+浓度可影响铁素体前体物的成核和聚集,实现对α-Fe2O3颗粒尺寸的调控[14]。此外,纳米α-Fe2O3颗的形貌也可通过控制前躯体溶液中Fe3+浓度进行调控。Supattarasakda等[15]通过调节前躯体溶液中Fe3+浓度调控化学沉淀法分别制备出椭球形、立方体、球形三种形貌的纳米α-Fe2O3。
虽然化学沉淀法合成的α-Fe2O3存在团聚结块、形状不规则的缺点,但是操作简易、成本低且易制备出纳米级α-Fe2O3的优势使其仍然被广泛应用。
1.2 溶胶凝胶法溶胶凝胶法是以高化学活性组分的化合物为前驱体,进行水解、缩合化学反应后陈化形成凝胶状,经过干燥、烧结形成纳米材料的方法。Liang等[16]以CNC作为模板采用溶胶凝胶法制备出多孔α-Fe2O3纳米颗粒,相较于非多孔结构,MB(亚甲基蓝)可见光催化氧化降解率从20%提高到35%。多孔结构的α-Fe2O3具有更大比表面积即可以提供更多的反应位点,有利于催化剂表面吸附有机污染物和氧化反应的进行。Shao等[17]以乙酰丙酮铁为原料,以SiO2为模板采用溶胶凝胶法制备出{110}晶面暴露的α-Fe2O3纳米片,其可见光催化降解双酚A的速率常数达0.016 min-1,是商业TiO2的1.9倍。Zhou等[18]采用溶胶凝胶法制备出纳米立方体和纳米片两种形貌的α-Fe2O3,发现纳米立方体可见光催化氧化降解Rh B(罗丹明B)的效率明显优于纳米片结构。不同形貌的α-Fe2O3暴露出的晶面不同,而不同晶面所显示出的可见光催化活性也不同,可见光催化活性由大到小的晶面为:{110}>{012}>{001}。这也为溶胶凝胶法调控α-Fe2O3可见光催化活性提供了重要的理论依据。
由此可见,溶胶凝胶法是一种能够实现对纳米α-Fe2O3粒度和形貌精确调控的制备方法。尤其是通过调控暴露晶面进而得到可见光催化活性更高的纳米α-Fe2O3,溶胶凝胶法是一种有效的途径。
1.3 水热法水热法是一种通常在反应釜中进行的、在一定温度和压力条件下反应的湿化学方法。对水热法的研究主要集中在反应釜反应温度及反应时间对α-Fe2O3材料特性的影响。Wang等[19]发现随着反应时间的延长,α-Fe2O3晶化度有所提高,粒径也从34 nm增大至102 nm。而反应温度的升高则促进了α-Fe2O3从絮状前体向纳米颗粒生长。除了常规水热法所得椭球体α-Fe2O3纳米颗粒外,特殊形貌结构α-Fe2O3的制备与优化亦受到关注。根据Wulff生长定律,晶体的生长和形状演化取决于表面自由能[20]。为了优化制备方法实现颗粒生长的精准调控,通过添加金属离子、无机阴离子及表面活性剂来改变晶核表面自由能的协助水热法也逐渐衍生。
Kusior等[21]在水热法制备过程中分别添加Zn2+和Al3+成功制备出立方体和圆盘状的α-Fe2O3纳米催化剂。在外加金属离子的作用下,α-Fe2O3晶体经过成核和聚集后合成了小立方体,反应釜中稳定的压力和温度促使小立方体溶解并再沉淀在大颗粒表面,最终形成准立方体结构α-Fe2O3。事实上,除了Zn2+、Al3+、Ni2+[22]、Mg2+[23]诸如此类的金属阳离子外,许多阴离子也能够改变晶体生长过程中的表面能,促进特殊形状材料的生成。Liu等[24]研究发现水热前驱体溶液的pH值以及SiO32-的加入能够抑制晶核c轴方向的生长,诱导a轴方向的生长,制备得到高度暴露{110}晶面的α-Fe2O3纳米薄片。进一步地,该团队从机理方面解释了SO42-和H2PO4-对材料表面活性的影响[25]。SO42-对晶核起到了破坏作用,使其沿着垂直c轴方向溶解,由原来的椭球形生长成中空的环形结构。而H2PO4-更易吸附在{110}晶面上,沿着c轴方向生成磷酸铁前体物,故沿此生长成纺锤形结构。Liu等[26]则通过在前驱体溶液中分别加入Cl-、SO42-、NO3-、CH3COO-,制备得到α-Fe2O3六面体、椭球体、六边形纳米片及圆角六边形纳米片。
水热法具有操作简单、可精准调控α-Fe2O3形貌结构的优势,但对设备要求高、回收率低的缺点限制了该方法应用于大规模生产。但随着对α-Fe2O3纳米颗粒的大小、形貌调控要求的提高,水热法被逐渐受到重视。
1.4 其他制备方法其他制备方法还包括直接燃烧法和静电纺丝法等。直接燃烧法是将铁前躯体、燃烧剂和其他添加剂以一定比例在淀粉等黏合剂下形成水乳状,然后在反应炉中高温燃烧得到纳米材料的方法[27]。静电纺丝是一种利用聚合物溶液或熔体在高压静电作用下,使带电聚合物被拉伸形成连续纤维状材料的工艺[28]。Sundaramurthy等[2]通过电纺丝法制备出一维的多孔α-Fe2O3纳米线,这种纳米结构为可见光催化氧化反应提供了更多反应活性位点,提高了染料CR(刚果红)的去除率。
α-Fe2O3光催化剂对应的制备方法和优化条件以及在水处理方面的应用如表 1所示。可见,常规方法所制备出的α-Fe2O3以纳米颗粒状为主,核壳结构、多孔结构、层状等立体结构的特殊外貌还需要高分子表面活性剂等添加剂的协助[29-30]。这是由于纳米α-Fe2O3表面能较高,在制备和应用的过程中易发生团聚,通过添加十六烷基三甲基溴化铵(CTAB)[5]、聚乙烯吡咯烷酮(PVP)[31]、纤维素纳米晶(CNC)[16]等模板剂能够有效改善团聚、构筑立体空间结构。
| 表 1 α-Fe2O3制备方法及其对应的影响因素 Table 1 Preparation and its influencing factors of α-Fe2O3 |
α-Fe2O3作为可见光催化剂时,其光催化活性的限制条件主要是以下3点:1)价带位置高使其光生空穴的氧化能力低于产生羟基自由基的电位要求;2)光生空穴的扩散能力差,仅为2~4 nm;3)导电率低,仅为10-6 Ω-1cm-1[3]。以上限制使得其光催化氧化能力无法达到理论计算值,迄今文献报道中α-Fe2O3最高光电转换效率也未超过3%[38],与其理论值16.8%[39]还有较大差距。α-Fe2O3掺杂主要通过引入掺杂剂改变电子轨道构型、能级位置以及形貌来提高可见光催化活性。依据掺杂剂的不同,α-Fe2O3的掺杂改性可分为金属离子掺杂、非金属离子掺杂、贵金属掺杂及多元共掺杂。
2.1 金属元素掺杂由于许多金属元素与Fe3+具有相似的电子结构和尺寸,如Sn[40]、Al[41]、Zr[41]、Co[42]、Cu[43]、Ni[44]、Zn[44]、Ga[45]、Ta[46]、Ir[47]、Er[48]等都被用于掺杂α-Fe2O3,来提高其可见光催化性能。在α-Fe2O3中掺杂金属离子可引入新能级、窄化禁带宽度从而拓宽其光响应范围。禁带宽度越窄,则价带上被束缚的电子更容易受到激发跃迁至导带上,产生更多的光生电子空穴,从而提高光催化氧化降解有机污染物的效能。Mansour等[40]采用共沉淀法制备了不同Sn掺杂比的纳米α-Fe2O3。随着Sn掺杂量的增加,其禁带宽度由2.2 eV逐渐减小为1.9 eV,且MB光催化降解速率也随之提高。适当的掺杂Sn能够在导带下方引入一条新能级,从而减小禁带宽度,拓宽光响应范围。此外,掺杂改性也能有效抑制光生电子空穴的复合[49]。Xiao等[45]采用回流共沉淀法制备了Ga掺杂α-Fe2O3可见光催化剂,并证实适当的Ga掺杂能通过形成合适宽度的空间电荷区来促进电子空穴的分离,从而提高α-Fe2O3的可见光催化活性。Bark等[50]发现当金属离子掺杂浓度较低时,α-Fe2O3的耗尽层增厚,内建电场E和势垒电压V增大,进而降低了电子空穴的复合率;当金属离子掺杂浓度过高时,在α-Fe2O3导电性提升的同时也会增加电子空穴的复合率。类似结论在Xiao等[51]采用Bi掺杂α-Fe2O3光催化氧化降解水中MO(甲基橙)的研究中得到验证。因此,掺杂要求合适的浓度,过量金属离子掺杂反而会成为载流子的复合中心而加速复合过程,使光催化氧化能力下降[52]。
此外,金属离子掺杂还能通过改变材料尺寸影响其性能。在适当的金属掺杂剂浓度范围内,金属离子能抑制α-Fe2O3颗粒的生长,粒径均随着掺杂浓度的增大而减小[40, 52-53]。陈思顺等[54]采用柠檬酸溶胶凝胶法制备Y掺杂的α-Fe2O3纳米粉,发现随着掺杂量的增加晶粒的生长受到抑制进而粉体粒径减小。张兆志等[44]发现Zn2+、Ni2+掺杂同样能使α-Fe2O3粒径减小。据报道,Sn+、Ga+、Sb3+的半径分别为0.069,0.062,0.069 nm,均与Fe3+的半径0.064 nm相近,说明离子本身的尺寸不是造成掺杂后α-Fe2O3粒径减小的原因。但在适量掺杂浓度范围内,掺杂后的颗粒均随着掺杂浓度的增大而减小,进一步验证金属离子掺杂能抑制颗粒的生长[40, 52-53]。Reveendran等[55]揭示了随着Cu掺杂量的增大α-Fe2O3纳米颗粒尺寸变小是基于纳米颗粒的“自清洁”效应,它导致掺杂剂更多的分布在晶界而非晶核周围。随着半导体纳米颗粒粒径的减小,光生载流子更易从内部迁移到表面,使其在与光生空穴复合前与表面的有机污染物反应。同时α-Fe2O3纳米颗粒的粒径减小,增大比表面积提供了更多反应位点,促进催化剂光吸收过程与表面的吸附作用[56]。进一步地,Guo等[57]的研究发现Ga对α-Fe2O3的掺杂能引入氧空位缺陷。已有研究证明缺陷位点能有效提高催化活性,一方面它能提高载流子分离效率,有效地限制光激发电子的转移,从而防止它们与光生空穴重新结合[58];另一方面它可以作为O2吸附位点,促进活性氧物种的生成[59]。
综上所述,金属元素掺杂α-Fe2O3可拓宽光响应范围、减小催化剂的尺寸、提高导电性、引入氧空位。采用金属离子为掺杂剂来制备α-Fe2O3可以显著提高其光催化活性。
2.2 非金属元素掺杂非金属元素掺杂广泛的应用于半导体材料的改性中,它具有提高半导体材料的光电化学性能的特性。N、S、C、Si以及卤族元素I等非金属元素已被用于掺杂α-Fe2O3增大导电率提高其光催化性能。光催化反应的发生一共经历4个步骤,即:1)光的吸收,2)光生电子空穴的分离,3)光生载流子传导至催化剂表面,4)与吸附在表面的反应物发生氧化还原反应[60]。而非金属离子掺杂剂可以通过引入新能级、修饰电子结构、改变材料形貌尺寸等途径来优化α-Fe2O3光催化反应关键步骤,从而促进可见光催化剂的催化反应。
Demirci[61]采用溶胶凝胶法制备的I-α-Fe2O3在UV-Vis光下光催化氧化降解MB的效果明显提高。I3+的掺杂形成了氧空位并作为载流子的捕捉位点,有效抑制光生电子空穴复合。I掺杂量为1%时α-Fe2O3的粒径最小,并具有最小的电化学阻抗和最高的光生载流子的传导效率。Bemana等[62]研究发现S4+在晶格中取代Fe3+的位置,并在Fe3+还原成Fe2+的过程中产生了氧空位,其中极化子的跳跃导电机制增强了材料的导电性能,加快了载流子的移动[63]。而S2-通过取代O2-的位置,引起的带隙、带边和光学吸收的显著变化[64]。Guo等[65]以硫酸铁和Na2S2O3为原料水热法制备出S-α-Fe2O3,发现S元素是以S2-的形式掺杂到α-Fe2O3中形成FeS或者FeS2。S2-与Fe3+的杂化比O2-与Fe3+的杂化更能促进催化剂表面电子的传递,且S掺杂引入的缺陷态通过抑制光生载流子的复合提高了酸性橙7和苯酚的光催化降解效率。
Si是近些年来用于半导体材料掺杂最广泛的掺杂剂之一。Rahman等[66]在Si掺杂α-Fe2O3的研究中发现,Si以Si4+取代晶格中Fe3+的位置,相比未掺杂的α-Fe2O3,掺杂Si后具有更小的尺寸和更粗糙的表面,这种改变有利于α-Fe2O3光电性能的提升。类似地,Yan等[67]制备的Si-Fe2O3中Si4+也是以占据Fe3+位点形成了α-Fe2O3和Si-Fe双氧化物组成的复合材料。在该催化剂催化去除水中硝基苯的研究中发现,掺杂形成的Si-Fe双氧化物对体系中氧化剂的传质起到了加速的作用,催化活性得到提升。同族元素C也常作为掺杂半导体材料用以提高材料的导电性能。Huang等[68]考察了C掺杂α-Fe2O3的光电化学特性,光照下其光电流密度最高能够达到1.18 mA/cm2。
但总的来说,目前对非金属离子掺杂α-Fe2O3应用于提升可见光催化降解水中有机物的相关认识不足,尤其是针对同一条件制备所得不同种元素掺杂时,缺乏材料光催化活性的影响机制研究。
2.3 贵金属掺杂贵金属掺杂α-Fe2O3能够有效克服电子空穴对复合率高和导电性差的限制。贵金属负载在催化剂表面通过局部表面等离子共振(LSPR)使得金属纳米颗粒对光子能量产生很强的吸收作用。通常来说,主要是有3种能量传输机制决定了这种光催化反应,即电荷射入轨道、附近电场的增强和散射机制。Lin等[69]采用聚乙烯醇还原法成功地将Au和Pd分别地负载在α-Fe2O3表面,改性的α-Fe2O3光催化降解丙酮的效能有了明显提升。分析表明0.76Au/α-Fe2O3与0.65Pd/α-Fe2O3催化剂表面的吸附氧Oads要比纯α-Fe2O3高出很多,而Oads对·O2-的生成起着关键作用。改性后的禁带宽度依α-Fe2O3(2.12 eV)>0.76Au/α-Fe2O3 (2.09 eV)>0.65Pd/α-Fe2O3 (2.05 eV)减小,表明贵金属与半导体的复合改性拓宽了光响应范围。Li等[70]在研究Au负载α-Fe2O3可见光催化氧化难降解有机物中发现,贵金属与半导体间形成的肖特基势垒有效促进了光生电子空穴的分离,光电流得到了显著增强。但当负载量过多时有机物的降解率也随负载量的增加而降低。过量负载的Au颗粒成为了光生电子空穴的复合中心,α-Fe2O3产生的光电流受到抑制、量子产率下降。早期Zhang等[71]研究了Ag-α-Fe2O3上Ag纳米颗粒的大小对其光催化降解Rh B的影响,分析表明Ag负载在α-Fe2O3表面时,光生电子会自动转移至Ag上,并通过光激发的等离子体纳米结构产生比光子本身更高的局部电场促进载流子的分离。但LSPR产生的电子会从Ag纳米颗粒射入到α-Fe2O3的导带上导致电子空穴复合。故当Ag纳米颗粒的体积减小时,载流子分离的促进作用会小于抑制作用。Cao等[72]发现2 nm Au-α-Fe2O3的异质纳米颗粒的降解Rh B效果要比纯α-Fe2O3更差,证实了当负载贵金属颗粒体积过小时载流子复合不会被抑制,而会因其占据了α-Fe2O3表面反应位点而降低光催化效果。
综上,贵金属掺杂是通过贵金属与α-Fe2O3接触形成的肖特基势垒促进电子在异质结界面的移动、抑制光生电子空穴的复合,从而提高光催化活性[73]。而在一定情况下,过量负载或负载尺寸过小的贵金属纳米颗粒使其自身成为光生电子空穴的复合中心,且可能占据着α-Fe2O3的反应活性位点降低可见光催化活性。如何平衡贵金属掺杂剂的促进与抑制作用是未来研究中的难点。
2.4 多元共掺杂如前所述,研究者们研究了各种掺杂剂单独掺杂对α-Fe2O3晶体结构、光学性质的影响及其在可见光催化氧化有机污染物领域的应用。而多种掺杂剂共同掺杂改性α-Fe2O3也得到了关注。
Pradhan等[74]采用共沉淀法制备了S、N共掺杂α-Fe2O3光催化剂,结果表明S和N共掺杂的α-Fe2O3对Rh B的降解有显著的促进作用。共掺杂的协同促进作用来源于两方面:一方面是由于O的电负性比N和S强,与Fe3+的结合更紧密,共掺杂后S、N的杂化分子轨道与Fe3+重叠形成的反应空间更大。另一方面,S、N共掺杂在价带和导带之间形成一个分离带,当载流子在光照后产生时载流子被夹住,从而延迟了复合过程,促进了产生羟基自由基的氧化还原过程。Wang等[75]在Al/Ce和Al/Zr共掺杂α-Fe2O3的研究中发现,这类金属元素共掺杂有利于α-Fe2O3氧空位的形成,这与单一金属元素掺杂机制类似。因而构筑α-Fe2O3氧空位的“缺陷工程”是提高其可见光催化活性的有效方法,是掺杂改性α-Fe2O3的研究重点。另外,也不乏有对金属元素与贵金属共掺杂改性α-Fe2O3的研究。Rajamobhan等[76]采用共沉淀法将Ag负载在Bi-α-Fe2O3上,可见光下催化降解玫瑰红染料的反应速率是TiO2的6倍、ZnO的7.3倍。Ag/Bi-α-Fe2O3优异的光催化活性可归结于Ag与Bi共掺杂的协同作用:贵金属Ag改善了材料的光学和电导特性,金属元素Bi则促进了载流子的分离。
金属元素、非金属元素以及贵金属元素对α-Fe2O3掺杂已被证实是有效提高其光催化性能的改性方式。金属元素对控制纳米结构的尺寸及能级的引入有明显作用,非金属元素的改性能有效提高材料的电导率,贵金属元素则通过构建肖特基势垒来促进载流子的有效分离。多元素的共掺杂则弥补了单一元素掺杂对材料催化性能提升的局限性。许多研究已经证明多元掺杂是可以协同发挥各自的改性作用的。但是,源于掺杂剂种类的多样性及它们对材料影响的多面性造成了多元共掺杂的复杂性。故有关多元掺杂的研究仍需进一步开展,有针对性的选择掺杂剂以及适量掺杂不引入杂质是有待突破的瓶颈问题。
3 结语1) 光催化剂的制备方法与其形貌、结构、尺寸紧密关联,化学沉淀法、溶胶凝胶法和水热法等制备方法是研究热点。但制备方法仍需朝着降低成本、提高可操作性、可见光催化活性可控的方向不断深入研究,这还需要进一步探明制备过程中的反应机制和优化关键反应参数。
2) 掺杂改性α-Fe2O3可选择的掺杂剂种类较多,调控光催化剂性能的机制也不尽相同。掺杂改性过程中掺杂剂浓度和掺杂方式对α-Fe2O3的可见光催化活性具有关键影响作用。故选择合适的一元或多元掺杂剂掺杂改性α-Fe2O3时,以拓展光响应范围、促进载流子分离来提高光催化活性仍然是未来的研究趋势。多元掺杂剂协同增强α-Fe2O3可见光催化活性的机制仍有待深入探索。
3) 随着我国城市和工业进一步发展,废水排放量日益增加、水质复杂化等问题接踵而来,可见光催化技术在水环境净化领域具有广阔的应用前景。如何制备成本低、效率高、稳定性好且可回收利用的新型纳米α-Fe2O3可见光催化剂将是未来重要的研究方向。
| [1] |
Frank S N, Bard A J. Heterogeneous photocatalytic oxidation of cyanide ion in aqueous solutions at titanium dioxide powder[J]. Cheminform, 1977, 8(14): 303-304. |
| [2] |
Sundaramurthy J, Kumar P S, Kalaivani M, et al. Superior photocatalytic behaviour of novel 1D nanobraid and nanoporous α-Fe2O3 structures[J]. RSC Advances, 2012, 2(21): 8201-8208. DOI:10.1039/c2ra20608k |
| [3] |
Mishra M, Chun D M. α-Fe2O3 as a photocatalytic material:a review[J]. Applied Catalysis A:General, 2015, 498: 126-141. DOI:10.1016/j.apcata.2015.03.023 |
| [4] |
邢丽贞, 冯雷, 陈华东. 光催化氧化技术在水处理中的研究进展[J]. 水科学与工程技术, 2008(1): 7-10. XING Lizhen, FENG Lei, CHEN Huadong. Advances in photocatalytic oxidation technology in water treatment[J]. Water Sciences and Engineering Technology, 2008(1): 7-10. (in Chinese) DOI:10.3969/j.issn.1672-9900.2008.01.003 |
| [5] |
Zeng J, Li J, Zhong J, et al. Improved sun light photocatalytic activity of alpha-Fe2O3 prepared with the assistance of CTAB[J]. Materials Letters, 2015, 160: 526-528. DOI:10.1016/j.matlet.2015.08.037 |
| [6] |
Ye C, Hu K, Niu Z, et al. Controllable synthesis of rhombohedral α-Fe2O3 efficient for photocatalytic degradation of bisphenol A[J]. Journal of Water Process Engineering, 2019, 27: 205-210. DOI:10.1016/j.jwpe.2018.12.008 |
| [7] |
Fu Y, Li Y, Hu J, et al. Photocatalytic degradation of acetochlor by α-Fe2O3 nanoparticles with different morphologies in aqueous solution system[J]. Optik-International Journal for Light and Electron Optics, 2018(178): 36-44. |
| [8] |
Ghasemi E, Ziyadi H, Afshar A M, et al. Iron oxide nanofibers:a new magnetic catalyst for azo dyes degradation in aqueous solution[J]. Chemical Engineering Journal, 2015, 264: 146-151. DOI:10.1016/j.cej.2014.11.021 |
| [9] |
陈喜娣, 蔡启舟, 尹荔松, 等. 纳米α-Fe2O3光催化剂的研究与应用进展[J]. 材料导报, 2010(21): 122-128. CHEN Xidi, CAI Qizhou, YIN Lisong, et al. Progress in research and application of nano-hematite photocatalyst[J]. Materials Review, 2010(21): 122-128. (in Chinese) |
| [10] |
Machala L, Tucek J, Zboril R. ChemInform abstract: polymorphous transformations of nanometric Iron(Ⅲ) Oxide: a review[J/OL]. Cheminform, 2011, 42(39)[2019-09-25]. https://doi.org/10.1002/chin.201139208
|
| [11] |
Imran M, Abutaleb A, Ali M A, et al. UV light enabled photocatalytic activity of α-Fe2O3 nanoparticles synthesized via phase transformation[J]. Materials Letters, 2020, 258: 126748. DOI:10.1016/j.matlet.2019.126748 |
| [12] |
Lassoued A, Dkhil B, Gadri A, et al. Control of the shape and size of iron oxide (α-Fe2O3) nanoparticles synthesized through the chemical precipitation method[J]. Results in Physics, 2017, 7(30): 07-15. |
| [13] |
Fouad D E, Zhang C, El-Didamony H, et al. Improved size, morphology and crystallinity of hematite (α-Fe2O3) nanoparticles synthesized via the precipitation route using ferric sulfate precursor[J]. Results in Physics, 2019, 12: 1253-1261. DOI:10.1016/j.rinp.2019.01.005 |
| [14] |
Schwertmann U, Friedl J, Stanjek H. From Fe (Ⅲ) Ions to ferrihydrite and then to hematite[J]. J Colloid Interface Sci, 1999, 209(1): 215-223. DOI:10.1006/jcis.1998.5899 |
| [15] |
Supattarasakda K, Petcharoen K, Permpool T, et al. Control of hematite nanoparticle size and shape by the chemical precipitation method[J]. Powder Technology, 2013, 249: 353-359. DOI:10.1016/j.powtec.2013.08.042 |
| [16] |
Liang H, Liu K, Ni Y. Synthesis of mesoporous α-Fe2O3 via sol-gel methods using cellulose nano-crystals (CNC) as template and its photo-catalytic properties[J]. Materials Letters, 2015, 159: 218-220. DOI:10.1016/j.matlet.2015.06.103 |
| [17] |
Shao P, Ren Z, Tian J, et al. Silica hydrogel-mediated dissolution-recrystallization strategy for synthesis of ultrathin α-Fe2O3, nanosheets with highly exposed (1, 1, 0) facets:a superior photocatalyst for degradation of bisphenol S[J]. Chemical Engineering Journal, 2017, 323: 64-73. DOI:10.1016/j.cej.2017.04.069 |
| [18] |
Zhou X, Lan J, Liu G, et al. Facetâ-mediated photodegradation of organic dye over hematite architectures by visible light[J]. Angew Chem Int Ed Engl, 2012, 51(1): 178-182. DOI:10.1002/anie.201105028 |
| [19] |
Wang F, Qin X F, Meng Y F, et al. Hydrothermal synthesis and characterization of α-Fe2O3 nanoparticles[J]. Materials Science in Semiconductor Processing, 2013, 16(3): 802-806. DOI:10.1016/j.mssp.2012.12.029 |
| [20] |
Wu Z, Yang S, Wu W. Shape control of inorganic nanoparticles from solution[J]. Nanoscale, 2016, 8(3): 1237-1259. DOI:10.1039/C5NR07681A |
| [21] |
Kusior A, Michalec K, Jelen P, et al. Shaped Fe2O3 nanoparticles-synthesis and enhanced photocatalytic degradation towards RhB[J]. Applied Surface Science, 2018, 476: 342-352. |
| [22] |
Liu R, Jiang Y, Chen Q, et al. Nickel ions inducing growth of high-index faceted α-Fe2O3 and their facet-controlled magnetic properties[J]. RSC Advances, 2013, 3(22): 8261-8268. DOI:10.1039/c3ra40194d |
| [23] |
Liu R, Jiang Z, Liu Q, et al. Surface-dependent magnetic behavior of α-Fe2O3 quasi-cubes induced by Mg2+ ions[J]. CrystEngComm, 2015, 17(37): 7107-7112. DOI:10.1039/C5CE01176K |
| [24] |
Liu H T, Guo Y K, Wang N N, et al. Controllable synthesis and photocatalytic activity of ultrathin hematite nanosheets[J]. Journal of Alloys and Compounds, 2019, 771: 343-349. DOI:10.1016/j.jallcom.2018.08.267 |
| [25] |
Liu H T, Tong M L, Zhu K L, et al. Preparation and photo-Fenton degradation activity of nickel ions inducing growth of high-index faceted α-Fe2O3 and their facet-controlled magnetic propertie nanorings obtained by adding H2PO4-, SO42-, and citric acid[J]. Chemical Engineering Journal, 2020, 382: 123010. DOI:10.1016/j.cej.2019.123010 |
| [26] |
Liu J, Yang H, Xue X. Preparation of different shaped α-Fe2O3 nanoparticles with large particle of iron oxide red[J]. CrystEngComm, 2018, 21(7): 1097-1101. |
| [27] |
Apte S K, Naik S D, Sonawane R S, et al. Synthesis of nanosize-necked structure and α-Fe2O3 and its photocatalytic activity[J]. Journal of the American Ceramic Society, 2007, 90(2): 412-414. DOI:10.1111/j.1551-2916.2006.01424.x |
| [28] |
李秀艳, 徐记各, 李从举. 纳米纤维材料在光催化领域中的研究进展[J]. 材料导报, 2011, 25(23): 29-34. LI Xiuyan, XU Jige, LI Congju. Research progress of nanofiber materials in the field of photocatalysis[J]. Materials Reports, 2011, 25(23): 25-30. (in Chinese) |
| [29] |
Trpkov D, Panjan M, Kopanja L, et al. Hydrothermal synthesis, morphology, magnetic properties and self-assembly of hierarchical α-Fe2O3 (hematite) mushroom-, cube- and sphere-like superstructures[J]. Applied Surface Science, 2018, 457: 427-438. DOI:10.1016/j.apsusc.2018.06.224 |
| [30] |
Biju C S, Raja D H, Padiyan D P. Glycine assisted hydrothermal synthesis of α-Fe2O3 nanoparticles and its size dependent properties[J]. Chemical Physics Letters, 2014, 610-611: 103-107. DOI:10.1016/j.cplett.2014.07.024 |
| [31] |
Geng B, Tao B, Li X, et al. Ni2+/surfactant-assisted route to porous α-Fe2O3 nanoarchitectures[J]. Nanoscale, 2012, 4(5): 1671-1676. DOI:10.1039/c2nr12102f |
| [32] |
孟庆华, 朱亦仁, 顾绍玲, 等. 纳米α-Fe2O3合成及光催化法处理染料中间体废水[J]. 无机盐工业, 2011, 43(1): 48-51. MENG Qinghua, ZHU Yiren, GU Shaolin, et al. Synthesis of nano-sized α-Fe2O3 and treatment of dye intermediate wastewater by photocatalystic method[J]. Inorganic Chemicals Industry, 2011, 43(1): 48-51. (in Chinese) DOI:10.3969/j.issn.1006-4990.2011.01.016 |
| [33] |
Liu Y, Yu H, Zhan S, et al. Fast degradation of methylene blue with electrospun hierarchical α-Fe2O3 nanostructured fibers[J]. Journal of Sol-Gel Science and Technology, 2011, 58(3): 716-723. DOI:10.1007/s10971-011-2451-6 |
| [34] |
Mathevula L E, Noto L L, Mothudi B M, et al. Structural and optical properties of sol-gel derived α-Fe2O3 nanoparticles[J]. Journal of Luminescence, 2017, 192: 879-887. DOI:10.1016/j.jlumin.2017.07.055 |
| [35] |
Mohammadikish M. Hydrothermal synthesis, characterization and optical properties of ellipsoid shape α-Fe2O3, nanocrystals[J]. Ceramics International, 2014, 40(1): 1351-1358. DOI:10.1016/j.ceramint.2013.07.016 |
| [36] |
Li X, Yu X, He J, et al. Controllable fabrication, growth mechanisms, and photocatalytic properties of hematite hollow spindles[J]. The Journal of Physical Chemistry C, 2009, 113(7): 2837-2845. DOI:10.1021/jp8079217 |
| [37] |
Xu L, Xia J, Wang K, et al. Ionic liquid assisted synthesis and photocatalytic properties of α-Fe2O3 hollow microspheres[J]. Dalton Transactions, 2013, 42(18): 6468-6477. DOI:10.1039/c3dt50137j |
| [38] |
曾淑文, 王文中. α-Fe2O3光电催化分解水研究进展[J]. 表面技术, 2017, 46(4): 64-70. ZENG Shuwen, WANG Wenzhong. α-Fe2O3 photoelectrocatalytic water decomposition[J]. Surface Technology, 2017, 46(4): 64-70. (in Chinese) |
| [39] |
Sivula K, Leformal F, Gr Tzel M. Solar water splitting:progress using hematite (α-Fe2O3) photoelectrodes[J]. Chemsuschem, 2011, 4(4): 432-449. DOI:10.1002/cssc.201000416 |
| [40] |
Houda, Mansour, Radhouane, et al. Co-precipitation synthesis and characterization of tin-doped α-Fe2O3 nanoparticles with enhanced photocatalytic activities[J]. The Journal of Physics and Chemistry of Solids, 2018, 114: 1-7. |
| [41] |
Wang D, Jin L, Li Y, et al. Partial oxidation of vacuum residue over Al and Zr-doped α-Fe2O3 catalysts[J]. Fuel, 2017, 210: 803-810. DOI:10.1016/j.fuel.2017.09.008 |
| [42] |
Suresh R, Giribabu K, Manigandan R, et al. Synthesis of Co2+-doped Fe2O3, photocatalyst for degradation of pararosaniline dye[J]. Solid State Sciences, 2017, 68: 39-46. DOI:10.1016/j.solidstatesciences.2017.04.005 |
| [43] |
Satheesh R, Vignesh K, Suganthi A, et al. Visible light responsive photocatalytic applications of transition metal (M=Cu, Ni and Co) doped α-Fe2O3 nanoparticles[J]. Journal of Environmental Chemical Engineering, 2014, 2(4): 1956-1968. DOI:10.1016/j.jece.2014.08.016 |
| [44] |
张兆志, 魏雨, 刘辉, 等. Zn、Ni掺杂对制备纳米α-Fe2O3的影响研究[J]. 人工晶体学报, 2010, 39(6): 1429-1433. ZHANG Zhaozhi, WEI Yu, LIU Hui, et al. Influence of Zn, Ni doping on preparation of nano α-Fe2O3[J]. Journal of Synthetic Crystals, 2010, 39(6): 1429-1433. (in Chinese) DOI:10.3969/j.issn.1000-985X.2010.06.016 |
| [45] |
Xiao Z, Li J, Zhong J, et al. Enhanced photocatalytic decolorization of methyl orange by gallium-doped α-Fe2O3[J]. Materials Science in Semiconductor Processing, 2014, 24: 104-109. DOI:10.1016/j.mssp.2014.03.028 |
| [46] |
Li H, Niu D, Liu D, et al. Understanding the enhanced photoelectrochemical activity of Ta doped hematite[J]. Journal of Molecular Structure, 2017, 1139: 104-110. DOI:10.1016/j.molstruc.2017.03.008 |
| [47] |
Krehula S, ŠTefaniĆ G, Zadro K, et al. Synthesis and properties of iridium-doped hematite (α-Fe2O3)[J]. Journal of Alloys & Compounds, 2012, 545: 200-209. |
| [48] |
Mathevula L E, Mothudi B M, Dhlamini M S. Effect of Er3+ on structural and optical properties of microwave synthesized α-Fe2O3 nanoparticles[J]. Physica B:Condensed Matter, 2020, 578: 411698. DOI:10.1016/j.physb.2019.411698 |
| [49] |
Bagwasi, S, Tian B, et al. Synthesis, characterization and application of bismuth and boron Co-doped TiO2:a visible light active photocatalyst[J]. Chemical Engineering Journal, 2013, 217: 108-118. DOI:10.1016/j.cej.2012.11.080 |
| [50] |
Bak A, Choi S K, Park A H. Photoelectrochemical performances of hematite (α-Fe2O3) films doped with various metals[J]. Bulletin of the Korean Chemical Society, 2015, 36(5): 1487-1494. DOI:10.1002/bkcs.10290 |
| [51] |
Xiao Z, Li J, Zhong J, et al. Enhanced photocatalytic activity of Bi-doped α-Fe2O3[J]. Journal of Advanced Oxidation Technologies, 2014, 17(1): 93-98. |
| [52] |
Zhong J B, Li J Z, Zeng J, et al. Enhanced photocatalytic performance of Ga3+-doped ZnO[J]. Materials Research Bulletin, 2012, 47(11): 3893-3896. DOI:10.1016/j.materresbull.2012.08.031 |
| [53] |
陈思顺, 陈新华, 丁明洁, 等. α-Fe2O3纳米粉体的掺杂研究[J]. 上海化工, 2005, 30(11): 23-24, 28. CHEN Sishun, CHEN Xinhua, DING Mingjie, et al. Study on the adulteration synthesis of nanosized α-Fe2O3[J]. Shanghai Chemical Industry, 2005, 30(11): 23-24, 28. (in Chinese) |
| [54] |
王元生. 掺杂对纳米氧化铁晶化相的影响[J]. 功能材料, 1999(1): 60-62. WANG Yuansheng. Influence of doping on the structure of iron-oxide nanocrystalline phase[J]. Journal of Functional Materials, 1999(1): 60-62. (in Chinese) DOI:10.3321/j.issn:1001-9731.1999.01.024 |
| [55] |
Remya R, Abdul K M. Structural, optical and electrical properties of Cu doped α-Fe2O3 nanoparticles[J]. Materials Chemistry and Physics, 2018, 219: 42-54. |
| [56] |
余燕敏.基于畜牧废水中抗生素降解的新型功能材料制备与应用研究[D].北京: 中央民族大学, 2017. YU Yanming. Preparation and application of new functional materials based on antibiotic degradation in livestock wastewater[D]. Beijing: Minzu University of China, 2017. (in Chinese) |
| [57] |
Sheng G, Haojie W, Wei Y, et al. Scalable synthesis of Ca-doped α-Fe2O3 with abundant oxygen vacancies for enhanced degradation of organic pollutants through peroxymonosulfate activation[J]. Applied Catalysis B:Environmental, 2020, 262: 118250. DOI:10.1016/j.apcatb.2019.118250 |
| [58] |
Li J, Zhang W, Ran M, et al. Synergistic integration of Bi metal and phosphate defects on hexagonal and monoclinic BiPO4:enhanced photocatalysis and reaction mechanism[J]. Applied Catalysis B:Environmental, 2018, 243: 313-321. |
| [59] |
Song Z, Wang B, Yu J, et al. Density functional study on the heterogeneous oxidation of NO over α-Fe2O3, catalyst by H2O2:effect of oxygen vacancy[J]. Applied Surface Science, 2017, 413: 292-301. DOI:10.1016/j.apsusc.2017.04.011 |
| [60] |
Marschall R, Wang L. Non-metal doping of transition metal oxides for visible-light photocatalysis[J]. Catalysis Today, 2014, 225: 111-135. DOI:10.1016/j.cattod.2013.10.088 |
| [61] |
Demirci S, Yurddaskal M, Dikici T, et al. Fabrication and characterization of novel iodine doped hollow and mesoporous hematite (Fe2O3) particles derived from sol-gel method and their photocatalytic performances[J]. Journal of Hazardous Materials, 2018, 345: 27-37. DOI:10.1016/j.jhazmat.2017.11.009 |
| [62] |
Bemana H, Rashid-Nadimi S. Effect of sulfur doping on photoelectrochemical performance of hematite[J]. Electrochimica Acta, 2017, 229: 396-403. DOI:10.1016/j.electacta.2017.01.150 |
| [63] |
Rioult M, Stanescu D, Fonda E, et al. Oxygen vacancies engineering of Iron oxides films for solar water splitting[J]. The Journal of Physical Chemistry C, 2016, 120(14): 7482-7490. DOI:10.1021/acs.jpcc.6b00552 |
| [64] |
Xia C, Jia Y, Tao M, et al. Tuning the band gap of hematite α-Fe2O3 by sulfur doping[J]. Physics Letters A, 2013, 31/32/33: 1943-1947. |
| [65] |
Guo L, Chen F, Fan X, et al. S-doped α-Fe2O3 as a highly active heterogeneous Fenton-like catalyst towards the degradation of acid orange 7 and phenol[J]. Applied Catalysis B Environmental, 2010, 96(1/2): 162-168. |
| [66] |
Rahman M, Wadnerkar N, English N J, et al. The influence of Ti- and Si-doping on the structure, morphology and photo-response properties of α-Fe2O3 for efficient water-splitting:insights from experiment and first-principles calculations[J]. Chemical Physics Letters, 2014, 592: 242-246. DOI:10.1016/j.cplett.2013.12.021 |
| [67] |
Pengwei Yan, Jimin Shen, Lei Yuan, et al. Catalytic ozonation by Si-doped α-Fe2O3 for the removal of nitrobenzene in aqueous solution[J]. Separation and Purification Technology, 2019, 228: 115766. DOI:10.1016/j.seppur.2019.115766 |
| [68] |
Huang M C, Chang W S, Lin J C, et al. Magnetron sputtering process of carbon-doped α-Fe2O3 thin films for photoelectrochemical water splitting[J]. Journal of Alloys and Compounds, 2015, 636: 176-182. DOI:10.1016/j.jallcom.2015.02.166 |
| [69] |
Lin H, Liu Y, Deng J, et al. Au-Pd/mesoporous Fe2O3:highly active photocatalysts for the visible-light-driven degradation of acetone[J]. Journal of Environmental Sciences, 2018, 70: 74-86. DOI:10.1016/j.jes.2017.11.013 |
| [70] |
Li D, Yan X, Yang M, et al. 4-Mercaptobenzoic acid assisted synthesis of Au-decorated α-Fe2O3 nanopaticles with highly enhanced photocatalytic performance[J]. Journal of Alloys and Compounds, 2018, 775: 150-157. |
| [71] |
Zhang S, Ren F, Wu W, et al. Size effects of Ag nanoparticles on plasmon-induced enhancement of photocatalysis of Ag-α-Fe2O3 nanocomposites[J]. Journal of Colloid and Interface Science, 2014, 427: 29-34. DOI:10.1016/j.jcis.2013.12.012 |
| [72] |
Cao S W, Fang J, Shahjamali M M, et al. In situ growth of Au nanoparticles on Fe2O3 nanocrystals for catalytic applications[J]. CrystEngComm, 2012, 14(21): 7229-7235. DOI:10.1039/c2ce25746g |
| [73] |
Liang H, Jiang X, Chen W, et al. α-Fe2O3/Pt hybrid nanorings and their enhanced photocatalytic activities[J]. Ceramics International, 2014, 40(4): 5653-5658. DOI:10.1016/j.ceramint.2013.11.001 |
| [74] |
Pradhan G K, Sahu N, Parida K M. Fabrication of S, N co-doped α-Fe2O3 nanostructures: effect of doping, OH radical formation, surface area, [110]plane and particle size on the photocatalytic activity[J]. Rsc Advances, 2013, 3(21): 7912-7920.
|
| [75] |
Wang T T, Li Y, Jin L J, et al. Upgrading of coal tar with steam catalytic cracking over Al/Ce and Al/Zr co-doped Fe2O3 catalysts[J]. Journal of Fuel Chemistry and Technology, 2019, 47(3): 287-296. DOI:10.1016/S1872-5813(19)30013-1 |
| [76] |
Rajamohan S, Kumaravel V, Abdel W A, et al. Exploration of Ag decoration and Bi doping on the photocatalytic activity α-Fe2O3 under simulated solar light irradiation[J]. Canadian Journal of Chemical Engineering, 2018, 96: 1713-1722. DOI:10.1002/cjce.23122 |
 2020, Vol. 43
2020, Vol. 43

