本世纪初FFC剑桥工艺的提出[1],引发了人们对熔盐中电解固态SiO2制备Si的持续兴趣[2-5]。目前电解制备Si的研究不仅着重于提高Si的纯度和产率[5-9],而且也聚焦电化学还原机理以及对产物Si形貌、结构等的可控[8-13]。由于高温下固态SiO2不导电,一般认为SiO2只能在导电集流体-固态SiO2阴极-熔盐的三相界线(3PI)处开始还原反应[14-15],生成的Si核具有导电性,可以充当新的集流体。随着还原不断进行,Si核不断长大,3PI也不断扩展,直至SiO2全部还原。然而,远离集流体的SiO2在电解还原前也会受到熔盐介质的物理化学作用,导致这一部分SiO2最后电解还原时的形貌和显微结构不同于最初的SiO2,并可能对电化学还原过程和机理以及产物Si的形貌、结构等产生影响。
目前熔盐对SiO2显微结构影响的报道仅见于杨娟玉等[12]在1 173 K下对CaCl2熔盐与纳米SiO2颗粒压制的电极片的相互作用的研究。他们发现SiO2电极片在熔盐中浸泡30 min后相组成和化学组成均没有改变,但在纳米尺寸效应和熔盐的助熔作用下,结构和形貌变化很大,电极片由纳米颗粒组成的烧结多孔体转变为彼此相连的网状多孔体。外加电压促使熔融或者半熔融SiO2表面先电解形成Si核,然后Si核再与熔盐以及熔融或者半熔融SiO2形成新的3PI;随着熔融或者半熔融SiO2不断还原,Si核进一步长大并形成Si纳米线。
CaCl2熔盐因具有电导率高、稳定性好、价格低、绿色环保等优点而成为电解固态SiO2制备Si的研究中最常用的介质[2-15]。但CaCl2盐在空气中极易吸收水分而潮解,为避免水分对电解行为的干扰,在CaCl2盐升温或熔化过程中往往需要严格的脱水操作,这无疑增加了处理成本;另一方面,目前关于CaCl2盐水解反应的认识很有限[16-17],导致在升温或熔化过程中的脱水操作实际上并不统一[4, 8-12, 18]。笔者拟研究微米级SiO2压制的圆柱样与脱水不完全的CaCl2熔盐的相互作用,利用SEM-EDS及X射线衍射(XRD)等手段,结合有关热力学理论分析,考察水解反应下SiO2圆柱样显微特征的变化及其原因,为后续研究中指导CaCl2盐脱水处理以及调控电解产物Si的形貌、结构提供参考。
1 实验通过模具在1.56 MPa压力下将微米级SiO2粉末(分析纯,国药集团化学试剂有限公司)压制成直径5 mm、高10 mm的圆柱样(质量约0.2 g),圆柱样在1 673 K下烧结4 h。在烧结后的圆柱样中心用0.9 mm钻头手工钻一通孔,将长度1 m、直径1 mm的钼丝的一端沿通孔紧密穿过,钼丝末端弯折90°,以防浸泡或吊取时圆柱样脱落,这里的钼丝也可以视为模拟后续SiO2圆柱体电解还原时唯一的内置阴极集流体;在圆柱样上方的另一端钼丝用刚玉管保护。将约12 g CaCl2盐(分析纯,国药集团化学试剂有限公司)置于MgO坩埚(高60 mm,外径26 mm,内径22 mm),在真空干燥箱(真空度小于133 Pa)473 K烘干8 h。然后将装有CaCl2盐的MgO坩埚转移至硅碳管高温炉,高温炉内通入经硅胶干燥的高纯氩气(纯度99.999%,武汉钢铁集团气体有限责任公司)保护,炉温通过S型热电偶测定。高温炉以5 K·min-1的速率升至1 173 K,保温10 min,盐熔化后液面高度约15 mm。分别通过钼丝将2个烧结后的SiO2圆柱样悬吊,并一起缓慢放进CaCl2熔盐中浸泡(圆柱样间隔3 mm),开始计时,每隔1 h通过钼丝吊取一个圆柱样至刚玉炉管口冷却后取出。
将浸泡后的圆柱样放入超声波清洗仪中,用蒸馏水清洗30 min,圆柱样保持完整;然后再将其放置于真空干燥箱中373 K烘干。按图 1(a)分离烘干后的圆柱样,喷金处理后利用SEM-EDS显微表征圆柱样外表面以及靠近钼丝部位、断面中心和边部等部位(观察取样位置如图 1(b)所示)。由于浸泡后的圆柱样质量较小,未进行XRD等其他检测。为了对比,对SiO2原料粉末以及烧结后的SiO2圆柱体进行SEM-EDS形貌观察、成分分析以及XRD物相检测;对CaCl2原料也进行了XRD检测。

|
图 1 SiO2圆柱样在熔盐中浸泡后取样位置示意图 Fig. 1 Diagram of the sampling position of the SiO2 cylinder after immersion in the melt |
图 2为CaCl2和SiO2原料及烧结后SiO2的XRD图谱。可见CaCl2原料中的CaCl2主要以CaCl2·2H2O形式存在,未检测到CaO的存在;SiO2原料及压制成圆柱体烧结后的物相没有变化,均为纯SiO2晶体。
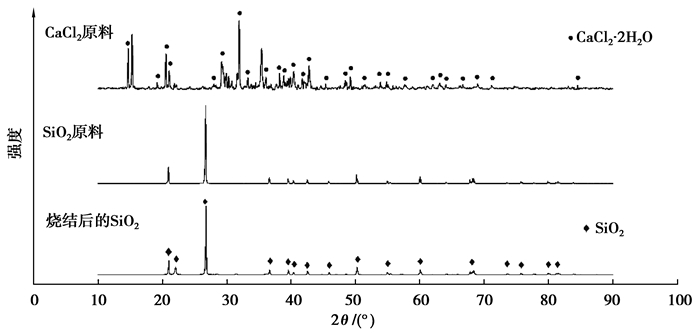
|
图 2 CaCl2和SiO2原料及烧结后SiO2的XRD图谱 Fig. 2 XRD patterns of CaCl2 and SiO2 raw materials and SiO2 cylinder after sintering |
图 3为SiO2烧结前后的SEM形貌及其放大图。SiO2原料(图 3(a))粉末比较松散,颗粒尺寸大小不一,一般在5~50 μm之间;压制和高温烧结后颗粒变得紧密,小颗粒变多,且容易附着在大颗粒表面(图 3b),表明SiO2原料在压制和烧结后有些大颗粒已碎裂变小。由于颗粒存在轻微软熔现象,彼此甚至轻微粘连在一起(图 3c),但颗粒仍能保持各自的形状。另外,SiO2烧结前后经EDS检测,成分没有任何变化。

|
图 3 SiO2的SEM图 Fig. 3 SEM images of SiO2 |
图 4为浸泡1 h后的SiO2圆柱样有关部位的SEM形貌及其放大图。表 1是相应位置点的EDS分析结果。从图 4(a)和4(d)可见,圆柱样外表面有放射状或者鳞片状物质形成,几乎见不到原烧结后存在的颗粒状SiO2(图 3(b)和3(c))。根据EDS分析(表 1)并结合SiO2·CaO相图[19],放射状或者鳞片状物质主要为3CaO·2SiO2(C3S2)相,粉末状物质主要为CaO·SiO2(CS)相,其他少量位置也有SiO2相。另外,与C3S2相共存的还有过量的CaO。从覆盖面积上看,外表面生成最多的是C3S2相,其次为CS相。显然,圆柱样外表面SiO2与熔盐中的CaO反应,生成了C3S2、CS等硅酸盐;而少量位置仅存在SiO2相可能是其覆盖层脱落、内部SiO2显露所致。总体上看,浸泡1 h后,SiO2圆柱样表层由于生成了多种硅酸盐,导致形貌以及组成、结构变化较大。

|
图 4 SiO2圆柱样在熔盐中浸泡1 h后的SEM图 Fig. 4 SEM images of SiO2 cylinder after immersion in the melt for 1 h |
| 表 1 图 4中SiO2圆柱体有关位置点的EDS成分分析 Table 1 EDS component analyses of relevant points of SiO2 cylinder in Fig. 4 |
在靠近钼丝部位(图 4(b)和4(e)),虽总体上仍保持颗粒状态,但相比于烧结样(图 3(b)和3(c)),形貌有少许变化,一些大颗粒表面镶嵌有很多半圆珠状的小颗粒(图 4(e))。经EDS分析(表 1),小半圆珠状物质组成主要包含Si、O以及极少量Ca元素,Ca的存在表明熔盐已开始沿钼丝与圆柱样中心之间的空隙渗透进来。因CaO已在圆柱体表层参与反应,随熔盐渗透进来的CaO浓度很低。结合SiO2-CaO相图[19]判断,小半圆珠应为SiO2及反应生成的很少量CS组成。表面光滑的大颗粒仍为SiO2相,基本不含CS。可以推测,浸泡时附着在大颗粒表面上已经轻微软熔的小颗粒SiO2,在熔盐助熔作用下,颗粒棱角进一步软熔或SiO2直接微量溶解[20];同时在熔盐中少量CaO作用下,小颗粒表面SiO2因生成少量CS而溶解,二者共同作用导致SiO2小颗粒的不规则棱角以及微小颗粒的溶解、消失。由于小颗粒处于溶解有SiO2和CS的熔盐环境中,当温度下降时,熔盐中SiO2和CS可在凝固的软熔小颗粒SiO2表面饱和析出,形成小半圆珠,并几乎半镶嵌在大颗粒表面。上述物理化学作用导致靠近钼丝部位的SiO2小颗粒形貌发生小许变化,但成分变化不大。在外力作用下,有少数半圆珠脱落,在大颗粒表面还留下相应的凹坑痕迹(图 4(e))。
在SiO2圆柱样断面中心部位(图 4(c)和4(f)),仍基本维持烧结后的颗粒形貌。因渗透进入的CaCl2熔盐量更少,上述小颗粒圆珠化的倾向虽然少量存在(表 1),但形貌变化不及靠近钼丝部位明显。
2.2.2 浸泡2 h图 5是SiO2圆柱样在熔盐中浸泡2 h后的SEM形貌及放大图,表 2是相应位置点的EDS分析结果。可以看出,与未浸泡(图 3)、浸泡1 h(图 4)相比,总体上SiO2圆柱样外表面形貌变化更大,形成了许多片状物质并垂直于表面,如图 5(a)~5(d)。经EDS分析(见表 2),这些最外层的片状物质主要为C2S相(图 5(b)和5(d)),甚至还包含有过量的CaO相。从断面(图 5(c)和5(d))上看,外层片状物质下面还有一层片状物质,但方向与垂直于外表面的片状物质不同;经EDS分析(表 2),该内层片状物质主要是CS相。内、外层总厚度约在120 μm以内,显然该厚度与SiO2圆柱样致密度有关。外表面生成的片状物质多垂直于表面且分层张开,可能与其组成主要为2CaO·SiO2 (C2S)相和CaO有关,冷却过程中由于C2S相存在晶型转变,体积会发生变化。另外,浸泡2 h的外层主要为C2S,内层主要为CS,而浸泡1 h的外层主要为C3S2,显示硅酸盐有逐级形成的倾向。

|
图 5 SiO2圆柱样在熔盐中浸泡2 h后的SEM图 Fig. 5 SEM images of SiO2 cylinder after immersion in the melt for 2 h |
| 表 2 图 5中SiO2圆柱体有关位置点的EDS成分分析 Table 2 EDS component analyses of relevant points of SiO2 cylinder in Fig. 5 |
圆柱样靠近钼丝(图 5(e)和5(f))以及断面中心部位(图 5(g)和5(h))的颗粒形貌也有明显变化。虽然大部分仍是SiO2颗粒,但由于浸泡时间较长,有较多熔盐渗入,导致局部形态和组成已开始变化。如靠近钼丝的位置点(图 5(f)点1)已生成了新相CS,断面中心部位已有位置点(图 5(h)点1和3)少量片状化,存在CS相以及清洗后残留的CaCl2(参见表 2);另外,小颗粒也存在小半圆珠化,并且附着或镶嵌在大颗粒表面。
可见,浸泡2 h后的圆柱样表面进一步形成C2S相,并富集有过量CaO,导致形貌和结构变化更大;而内部(靠近钼丝部位及断面中心)因熔盐渗透较少,CaO含量较低,颗粒形貌变化相对较小,仅局部有CS相生成。但相比浸泡1 h,圆柱样内部变化更明显。
2.3 讨论 2.3.1 硅酸盐形成的热力学分析上述实验结果表明,圆柱体外表面和内部的形貌和结构发生变化的主要原因是SiO2与CaCl2熔盐中溶解的CaO形成CS、C3S2和C2S等硅酸盐。利用FactSage热力学软件,可获得1 173 K下生成硅酸盐的各反应的标准吉布斯自由能变化ΔG0数据,如表 3所示。可见在标准态下这些反应即可进行,而且在标准态下可以逐级形成CS、C3S2和C2S。表中aCaO为溶解于CaCl2熔盐中CaO的活度;xCaO为CaO的摩尔分数;wCaO为CaO的质量分数;γCaO为CaO的活度系数。
| 表 3 173 K温度下与生成硅酸盐有关的热力学数据 Table 3 Thermodynamic data related to the generation of silicates at 1 173 K |
在非标准态下,利用式(1),可计算生成各硅酸盐时的CaO平衡活度。溶解在CaCl2熔盐中的CaO活度以纯固态CaO为标准态;假设SiO2及各种硅酸盐不溶于熔盐,或即使它们在熔盐中有少许溶解,其浓度也能达到饱和,选择它们各自的纯固态物质为标准态时,其活度均为1。
| $ \Delta G = \Delta {G^0}+RT{\rm{ln}}\frac{1}{{{a_{{\rm{CaO}}}}}} = 0, $ | (1) |
式中:ΔG为反应在非标准态下的吉布斯自由能变化,J·mol-1;R是气体常数,R=8.314 J·(mol·K)-1;T是热力学温度,这里T=1 173 K。xCaO可按式(2)得到:
| $ {a_{{\rm{CaO}}}} = {\gamma _{{\rm{CaO}}}}{x_{{\rm{CaO}}}}。$ | (2) |
文献中关于CaO在CaCl2熔盐中达到饱和(1 173 K时其饱和浓度达20 mol%)时的γCaO有2个类似公式:
| $ RT\;{\rm{ln}}{\gamma _{{\rm{CaO}}}} = 8\;669+6.146{T^{[21]}}, $ | (3) |
| $ RT\;{\rm{ln}}{\gamma _{{\rm{CaO}}}} = 6\;961+5.06{T^{[22]}}。$ | (4) |
当T=1 173 K时,式(3)和(4)计算的γCaO值分别为5.1和3.8,二者差别不大,均表明CaCl2-CaO熔体相对理想溶液呈现明显的正偏差。假设γCaO与xCaO无关,将CaO饱和时的γCaO值代入式(2)可得到对应的xCaO,并进一步转换成wCaO,结果见表 3。
可见在CaCl2熔盐中生成各硅酸盐所对应的CaO平衡活度很低,生成CS时对应的CaO活度最小,仅1.2×10-4(对应的质量分数平均为0.001 4%),生成C2S时的CaO活度较大,也仅为1.0×10-3(对应的质量分数平均为0.012%)。
参加反应的CaO只能来源于CaCl2盐的水解反应(稍后分析),并且很容易达到形成各硅酸盐所需的活度。圆柱体外表面同时存在多种硅酸盐,可能与外表面局部CaO活度不均匀以及硅酸盐逐级形成有关,另外也存在外表层局部脱落和冷却过程中C2S与SiO2进一步反应转变为CS的可能(表 3)。这些热力学分析与上述浸泡实验观察结果基本一致。
2.3.2 硅酸盐理论分解电压计算CaCl2熔盐中溶解适量CaO有利于固态SiO2电解还原时O2-的迁移[20-21]。相当多研究[5, 15, 20, 23-24]已发现固态SiO2电解还原过程中生成了中间产物CS或C2S等。有研究指出,CS在1 123 K的CaCl2熔盐中的溶解度(质量分数)可达1.56%[20],甚至有学者直接利用溶解的硅酸盐制取Si纳米线、纳米颗粒[20, 25]。显然,本研究中浸泡在脱水不完全熔盐中的固态SiO2圆柱体,其表面在未电解条件下也很容易生成固态硅酸盐。针对生成的各种硅酸盐,可利用标准态的理论分解电压E0来评估它们与SiO2电解还原相比的难易程度。这里仍假设它们均不溶于CaCl2熔盐,在后续电解过程中均以纯固态形式在惰性电极上被还原。利用FactSage热力学软件,通过式(5)计算1 173 K下体系中各组元的E0,结果见表 4。
| $ \Delta {G^{0}} = - n{E^{0}}F, $ | (5) |
| 表 4 在1 173 K标准态下体系内相关反应的ΔG0和组元的E0 Table 4 ΔG0 of the reactions and E0 of components at 1 173 K |
式中:n为各反应电子交换数,F为法拉第常数(96 485 C·mol-1)。
可见相比于固态SiO2,硅酸盐电解制备Si的分解电压都增大了,其中CS的分解电压增大约0.2 V,而其他硅酸盐分解电压增大约0.3 V,显示SiO2转变为硅酸盐后电解变得困难。为此,在外加大电压电解条件下,不仅使硅钙合金或钙金属也可能被还原出来,污染产物硅[4-5, 9, 15, 23],而且也影响到产物硅的形貌和长大[9, 20]。因此,在采用FFC工艺制备硅的过程中,应尽量避免各种固态硅酸盐生成,以降低CaCl2熔盐中固态SiO2全部还原的难度。
2.3.3 CaCl2盐的水解反应室温下CaCl2因暴露在空气中不可避免含有一定量的自由水和结晶水,自由水通过蒸发可有效脱除,而结晶水(参见图 2)需先高温分解、然后蒸发脱除。考虑动力学因素,升温过程中含水CaCl2完全脱水较为困难。一般认为在升温过程或在熔融状态下CaCl2盐与H2O有2种生成CaO的水解反应机理[16]。
第1种:
| $ {\rm{CaC}}{{\rm{l}}_{\rm{2}}}{\rm{+ }}{{\rm{H}}_{\rm{2}}}{\rm{O = CaO + 2HCl}}\left( {\rm{g}} \right)。$ | (6) |
第2种:
| $ {\rm{CaC}}{{\rm{l}}_{\rm{2}}}{\rm{+ 2}}{{\rm{H}}_{\rm{2}}}{\rm{O = Ca}}{\left( {{\rm{OH}}} \right)_{\rm{2}}}{\rm{+ 2HCl}}\left( {\rm{g}} \right), $ | (7) |
| $ {\rm{Ca}}{\left( {{\rm{OH}}} \right)_{\rm{2}}}{\rm{ = CaO + }}{{\rm{H}}_{\rm{2}}}{\rm{O}}。$ | (8) |
从热力学上看,第2种机理中反应式(7)(8)叠加,即转化为第1种机理反应式(6),因此这里主要从热力学上分析实验过程中第1种水解反应。
利用FactSage热力学软件,获得实验温度下水解反应(6)的ΔG0在不同T下的数据,结果如图 6所示。图中直线出现轻微转折是因为H2O(沸点373 K)与CaCl2(熔点1 045 K)先后发生了相变。可见在实验温度下,ΔG0>0,水解反应(6)在标准态下不可能进行。同时也可知温度越低,平衡常数越小。

|
图 6 反应(6)的ΔGθ-T的关系 Fig. 6 Relationship between ΔG0 and T of the reaction (6) |
利用式(9)可进一步获得反应(6)在不同温度、非标准态下的H2O与HCl的平衡分压(即pH2O和pHCl)的对应关系,这里选取473, 773, 973, 1 173 K等4个温度下比较,如图 7。在前3个温度下CaCl2和CaO均为固态(此时CaCl2和CaO的活度为1),在温度1 173 K为熔体状态(假设CaCl2和溶解的CaO活度均为1)。
| $ \Delta G = \Delta {G^{0}}+RT{\rm{ln}}\frac{{{{(\frac{{{p_{{\rm{HCl}}}}}}{{{p^0 }}})}^2}}}{{\frac{{{p_{\rm{H}}}_{_{\rm{2}}{\rm{O}}}}}{{{p^{0}}}}}}{\rm{ = }}0, $ | (9) |

|
图 7 反应(6)的pH2O与pHCl的平衡关系 Fig. 7 Equilibrium relationship between pH2O and pHCl of the reaction (6) |
式中:pH2O和pHCl分别为H2O与HCl的平衡分压,Pa;p0为标准态压力(100 kPa)。
从图 7中可知,温度越低,平衡线上相同的pH2O对应的pHCl也越低。平衡线以下区域为水解区(即CaO生成区)。在某温度下脱水过程中,固态CaCl2盐表层初始水蒸气分压往往较大甚至饱和,当HCl的分压很低(例如初始气氛)时,水解反应(6)即可正向进行,并可达到平衡。平衡线以上区域为H2O稳定区,此时可采取抽真空或在流动气氛下降低水蒸气分压脱水。但由于水解反应(6)中1 mol的H2O蒸气可生成2 mol的HCl气体,抽真空或在流动气氛操作会导致水解平衡反应向正方向(即生成CaO方向)移动。又由于反应(6)为吸热反应(FactSage热力学软件数据),温度越高,其正向进行程度(平衡常数)越大,特别是在高温熔体状态CaO活度远小于1的条件下更容易水解生成CaO。考虑动力学因素,低温下的水解反应即使能进行也将很缓慢,在相对低温下不抽真空或采取抽真空或流动气氛的脱水操作是合理的[4, 8-12, 18, 26]。高温熔体预电解虽可继续脱除残余水分[9, 12, 15, 20-21, 26](参见表 4),但在预电解之前CaCl2可能已经水解,并生成了CaO;当然,预电解对脱除熔盐中其他杂质仍有利。因此,在低温下充分脱水对于抑制水解反应、控制CaO的生成更重要。
由于水分是从表面到内层逐步脱除的,鉴于CaCl2在约517 K后才失去全部结晶水[25],为严格控制CaCl2盐高温水解产生CaO,建议加强CaCl2原料在573 K以下的低温长时间保温或缓慢升温的脱水操作。
本实验中尽管在473 K的干燥箱内对CaCl2盐进行了低温真空(真空度小于133 Pa)脱水操作,但转移到高温炉的过程又暴露在空气中,且实验中并没有特意在高温炉内氩气(仅用硅胶干燥)流动气氛下再次进行长时间低温保温或缓慢升温的脱水操作,导致CaCl2盐脱水不完全,高温水解生成了CaO,并溶于CaCl2熔盐,CaO扩散至SiO2圆柱体表面发生反应,并伴随熔盐渗透扩散,在圆柱体表面和内部分别与SiO2形成了各种硅酸盐。上述热力学计算已经表明,在圆柱体外表面由于CaO的活度(浓度)大,容易生成高钙硅酸盐,如C3S2或C2S;在内部由于CaO的活度(浓度)小,则可能生成低钙硅酸盐,如CS。对于仅内置阴极集流体的SiO2圆柱体在外加电压时,依据3PI还原理论[14-15],外表面形成的硅酸盐层只能在最后阶段还原,硅酸盐层的持续存在可在一定程度上阻碍CaCl2熔盐向圆柱体内部的扩散和3PI的形成,同时也降低内部SiO2还原产生的O2-向外传递的速度,最终使SiO2圆柱体阴极还原速度减慢、还原难度增加。
3 结论1) 在1 173 K的CaCl2熔盐中浸泡不同时间后,SiO2圆柱样外表面形貌、组成、结构变化较大,内部形貌变化较小。形貌、结构发生变化的主要原因是SiO2与熔盐中溶解的CaO作用,逐级生成多种硅酸盐。外表面CaO浓度高,可生成C2S或C3S2;内部则可能生成CS,也会受到渗透熔盐的轻微助熔作用。
2) 热力学计算表明,SiO2圆柱样在CaCl2熔盐中生成硅酸盐所需CaO的活度很低。生成CS时CaO的活度仅为1.2×10-4;生成C2S时CaO的活度也仅为1.0×10-3。SiO2转变为硅酸盐后,理论分解电压增大,电解还原难度增加,还原速度也减慢。
3) 在CaCl2熔盐中生成各种硅酸盐所需的CaO来自盐的水解反应。温度越高,水解反应越容易进行。为严格控制CaCl2盐中的CaO含量,宜加强CaCl2原料在低温(一般在573 K以下)下不抽真空或在真空或干燥流动气氛下长时间保温或缓慢升温的脱水操作。
| [1] |
Chen G Z, Fray D J, Farthing T W. Direct electrochemical reduction of titanium dioxide to titanium in molten calcium chloride[J]. Nature, 2000, 407(6802): 361-364. DOI:10.1038/35030069 |
| [2] |
Nohira T, Yasuda K, Ito Y. Pinpoint and bulk electrochemical reduction of insulating silicon dioxide to silicon[J]. Nature Materials, 2003, 2(6): 397-401. DOI:10.1038/nmat900 |
| [3] |
Jin X B, Gao P, Wang D H, et al. Electrochemical preparation of silicon and its alloys from solid oxides in molten calcium chloride[J]. Angewandte Chemie International Edition, 2004, 43(6): 733-736. DOI:10.1002/anie.200352786 |
| [4] |
Yasuda K, Nohira T, Ito Y. Effect of electrolysis potential on reduction of solid silicon dioxide in molten CaCl2[J]. Journal of Physics and Chemistry of Solids, 2005, 66(2/3/4): 443-447. |
| [5] |
Zhao J, Lu S M, Hu L Y, et al. Nano Si preparation by constant cell voltage electrolysis of FFC-Cambridge Process in molten CaCl2[J]. Journal of Energy Chemistry, 2013, 22(6): 819-825. DOI:10.1016/S2095-4956(14)60259-X |
| [6] |
Yasuda K, Nohira T, Kobayashi K, et al. Improving purity and process volume during direct electrolytic reduction of solid SiO2 in molten CaCl2 for the production of solar-grade silicon[J]. Energy Technology, 2013, 1(4): 245-252. DOI:10.1002/ente.201300001 |
| [7] |
Homma T, Matsuo N, Yang X, et al. High purity silicon materials prepared through wet-chemical and electrochemical approaches[J]. Electrochimica Acta, 2015, 179: 512-518. DOI:10.1016/j.electacta.2015.03.148 |
| [8] |
Yang X, Yasuda K, Nohira T, et al. The role of granule size on the kinetics of electrochemical reduction of SiO2 granules in molten CaCl2[J]. Metallurgical and Materials Transactions B, 2016, 47(1): 788-797. DOI:10.1007/s11663-015-0456-1 |
| [9] |
Xiao W, Jin X B, Chen G Z. Up-scalable and controllable electrolytic production of photo-responsive nanostructured silicon[J]. Journal of Materials Chemistry A, 2013, 1(35): 10243. DOI:10.1039/c3ta11823a |
| [10] |
Zhong M, Yang X, Yasuda K, et al. Effect of Si addition on the electrochemical reduction rate of SiO2 granules in molten CaCl2[J]. Metallurgical and Materials Transactions B, 2018, 49(1): 341-348. DOI:10.1007/s11663-017-1132-4 |
| [11] |
Nishimura Y, Nohira T, Kobayashi K, et al. Formation of Si nanowires by direct electrolytic reduction of porous SiO2 pellets in molten CaCl2[J]. Journal of the Electrochemical Society, 2011, 158(6): E55-E59. DOI:10.1149/1.3575635 |
| [12] |
杨娟玉, 卢世刚, 丁海洋, 等. 熔盐电解法制备硅纳米线的过程机理[J]. 无机化学学报, 2010, 26(10): 1837-1843. Yang J Y, Lu S G, Ding H Y, et al. Process mechanism of silicon nanowires preparation by electrolytic method in molten salt[J]. Chinese Journal of Inorganic Chemistry, 2010, 26(10): 1837-1843. (in Chinese) |
| [13] |
Zhao J, Li J, Ying P L, et al. Facile synthesis of freestanding Si nanowire arrays by one-step template-free electro-deoxidation of SiO2 in a molten salt[J]. Chemical Communications, 2013, 49: 4477-4479. DOI:10.1039/c3cc00101f |
| [14] |
Xiao W, Jin X, Deng Y, et al. Electrochemically driven three-phase interlines into insulator compounds: electroreduction of solid SiO2in molten CaCl2[J]. Chemphyschem, 2006, 7(8): 1750-1758. DOI:10.1002/cphc.200600149 |
| [15] |
Xiao W, Jin X B, Deng Y, et al. Rationalisation and optimisation of solid state electro-reduction of SiO2 to Si in molten CaCl2 in accordance with dynamic three-phase interlines based voltammetry[J]. Journal of Electroanalytical Chemistry, 2010, 639: 130-140. DOI:10.1016/j.jelechem.2009.12.001 |
| [16] |
Kondo H, Asaki Z, Kondo Y. Hydrolysis of fused calcium chloride at high temperature[J]. Metallurgical Transactions B, 1978, 9(4): 477-483. DOI:10.1007/BF02654424 |
| [17] |
Olsen E, Hansen M, Nygard H S. Hydrolysis of molten CaCl2-CaF2 with additions of CaO[J]. AIMS Energy, 2017, 5(6): 873-886. DOI:10.3934/energy.2017.6.873 |
| [18] |
Chen G Z, Fray D J. Voltammetric studies of the oxygen-titanium binary system in molten calcium chloride[J]. Journal of The Electrochemical Society, 2002, 149(11): 455-467. DOI:10.1149/1.1513985 |
| [19] |
Verein Deutscher Eisenhüttenleute (VDEh). Slag atlas[M]. 2nd Ed. Dusseldorf: Verlag Stahleisen GmbH, 1995: 63.
|
| [20] |
Xiao W, Wang X, Yin H, et al. Verification and implications of the dissolution-electrodeposition process during the electro-reduction of solid silica in molten CaCl2[J]. RSC Advances, 2012, 2(19): 7588-7593. DOI:10.1039/c2ra20698f |
| [21] |
Pistorius P C, Fray D J. Formation of silicon by electrodeoxidation, and implications for titanium metal production[J]. The Journal of The South African Institute of Mining and Metallurgy, 2006, 106: 31-41. |
| [22] |
Wang S L, Zhang F S, Liu X, et al. CaO solubility and activity coefficient in molten salts CaCl2-x (x=0, NaCl, KCl, SrCl2, BaCl2 and LiCl)[J]. Thermochimica Acta, 2008, 470(1/2): 105-107. |
| [23] |
Yasuda K, Nohira T, Hagiwara R, et al. Diagrammatic representation of direct electrolytic reduction of SiO2 in molten CaCl2[J]. Journal of The Electrochemical Society, 2007, 154(7): E95-E101. DOI:10.1149/1.2736641 |
| [24] |
王淑兰, 张华, 庄立军. 二氧化硅电脱氧反应的交流阻抗谱[J]. 东北大学学报(自然科学版), 2007, 28(4): 537-540. Wang S L, Zhang H, Zhuang L J. AC impedance spectrum of electro-deoxidation reaction of silicon dioxide[J]. Journal of Northeastern University (Natural Science), 2007, 28(4): 537-540. (in Chinese) DOI:10.3321/j.issn:1005-3026.2007.04.021 |
| [25] |
Dong Y F, Slade T, Stolt M J, et al. Low-temperature molten-salt production of silicon nanowires by the electrochemical reduction of CaSiO3[J]. Angewandte Chemie International Edition, 2017, 56: 14453-14457. DOI:10.1002/anie.201707064 |
| [26] |
Nie X M, Dong L Y, Bai C G, et al. Preparation of Ti by direct electrochemical reduction of solid TiO2 and its reaction mechanism[J]. Transactions of Nonferrous Metals Society of China, 2006, 16: s723-s727. DOI:10.1016/S1003-6326(06)60288-4 |
 2021, Vol. 44
2021, Vol. 44

