b. 西安建筑科技大学 陕西省黄金与资源重点实验室, 西安 710055
b. Key Laboratory of Gold and Resources of Shaanxi Province, Xi'an University of Architecture & Technology, Xi'an 710055, P. R. China
锂离子电池储能密度高、体积小、寿命长[1],随着其用量逐年增加,产生了大量的废旧锂离子电池,预计到2023年废旧锂离子电池的数量将达到116万吨[2]。废旧三元锂离子电池中的有价金属Ni、Co、Li、Mn都具有极高的回收价值,考虑到环境保护和经济效益,废旧锂离子电池的回收问题也迫在眉睫。
正极材料的回收一般包括预处理、选择性分离有价金属和再利用三部分[3]。预处理常用机械破碎[4-6]、热处理[7-9]和溶解法[10-12]等分离出正极活性物质。选择性分离有价金属常用湿法酸浸工艺,酸浸所用的无机酸包括H3PO4[13]、H2SO4[14]、HCl[15-16]、HNO3[17]等,有机酸包括苹果酸[18]、柠檬酸[19-20]、抗坏血酸[21]、草酸[22]等;为了浸出高价金属氧化物,酸浸时常加入H2O2[23]、(NH4)2SO3[24]等还原剂。回收再利用分为逐步分离回收和同时回收多种有价金属并直接制备成新材料[25]。王晓峰等[26]用氨水络合并利用弱酸性阳离子交换树脂提取出有价金属,再用不同浓度的(NH4)2SO4溶液分别洗脱出Ni和Co,用H2SO4溶液洗脱出剩余Co,Co和Ni的回收率达到84.9%和89.1%;陈亮等[27]用黄钠铁矾法分离铁,萃取剂N902分离铜,水解沉淀法分离铝,最后用碳酸盐共沉淀法制备镍钴锰碳酸盐前躯体,回收率均达到95%;Liu等[28]用P227萃取出Ni、Co、Mn,用HCl剥离负载有机相,再用草酸共沉淀和高温煅烧法制备出电化学性能优异的NCM333电池材料。
NiCoO2材料有广泛的应用,Ning等[29]将三维NiCoP纳米粒子嵌入NiCoO2纳米线电极中,制备出非对称超级电容器NiCoO2/NiCoP-20,具有优异的灵活性、导电性和氧化还原活性。Mo等[30]开发出NiCoO2-C复合材料作为高效的双功能电化学水分解催化剂。NiCoO2材料一般采用水热法制备,例如段晓净[31]以硝酸镍和硝酸钴作为原料,在反应釜中进行水热反应,然后在氮气气氛中高温退火合成NiCoO2球型粉末。
笔者采用H2SO4配合还原剂H2O2选择性浸出正极活性物质中的有价金属Ni和Co,采用正交实验优化浸出条件。用KMnO4沉淀法除去浸出液中的Mn,用水热-煅烧法从浸出液中制备出黑色链状NiCoO2,实现了正极材料中Ni和Co的同时回收。
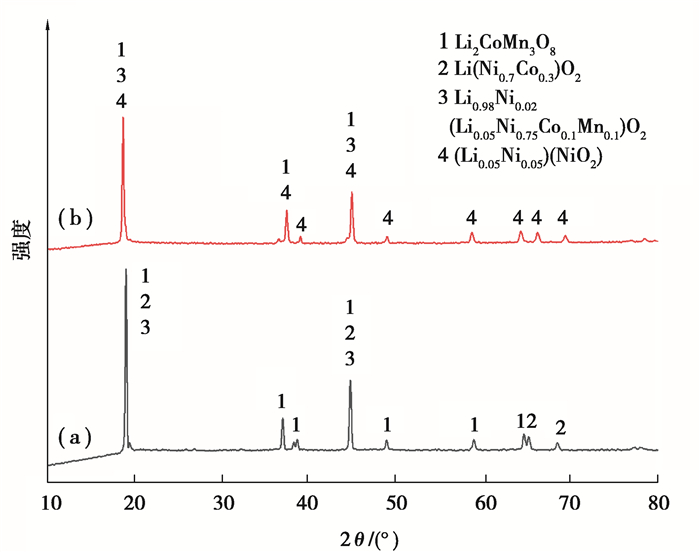
1 实验 1.1 实验原料实验所用原料是经放电、拆解的废旧NCM523型三元锂离子电池正极材料[32],用硝酸对电极材料进行预处理以分离活性物质与集流体(Al箔)。表 1及图 1所示的是预处理前后电极材料的质量分数及物相组成(XRD),可以看出正极材料主要含有Li、Ni、Co、Mn等元素,且经过预处理后,杂质含量降低。
| 表 1 预处理前后电池正极材料各元素质量分数 Table 1 Mass fraction of elements in cathode materials of batteries before and after pretreatment |
|
图 1 预处理前后的XRD图谱对比: (a)预处理前;(b)预处理后 Fig. 1 Phase contrast diagram before and after pretreatment |
选用H2SO4+H2O2作为浸出剂,是因为H2SO4挥发性小、浸出效果较好且廉价易得,但是电池正极材料中Ni、Co高价化合物都不易溶于酸,所以还要加入还原剂将高价金属离子还原,H2O2具有较好的还原性[33]且分解后不会引入新的杂质,故本实验选用H2O2作为还原剂。
浸出过程的化学反应如式(1)所示:
| $ \begin{gathered} 2 \operatorname{LiNi}_{x} \mathrm{Co}_{y} \mathrm{Mn}_{1-x-y} \mathrm{O}_{2}+3 \mathrm{H}_{2} \mathrm{SO}_{4}+\mathrm{H}_{2} \mathrm{O}_{2}=\mathrm{Li}_{2} \mathrm{SO}_{4}+2 x \mathrm{NiSO}_{4}+2 y \mathrm{CoSO}_{4}+ \\ 2(1-x-y) \mathrm{MnSO}_{4}+\mathrm{O}_{2} \uparrow+4 \mathrm{H}_{2} \mathrm{O}。\end{gathered} $ | (1) |
取5 g正极活性物质粉末于250 mL的三颈烧瓶中,依次加入一定浓度的H2SO4、一定体积分数的H2O2,控制固液比,将烧瓶置于恒温水浴锅,控制搅拌速率和反应时间,进行浸出实验。用ICP-OES检测浸出液中Ni、Co、Mn的含量并计算其浸出率。浸渣水洗、烘干后进行分析检测。
1.2.2 净化采用KMnO4沉淀法[34]将浸出液中的Mn2+以MnO2形式沉淀除去,化学反应式如下:
| $ 2 \mathrm{KMnO}_{4}+3 \mathrm{MnSO}_{4}+2 \mathrm{H}_{2} \mathrm{O}=5 \mathrm{MnO}_{2} \downarrow+\mathrm{K}_{2} \mathrm{SO}_{4}+2 \mathrm{H}_{2} \mathrm{SO}_{4} 。$ | (2) |
在pH=5的弱酸环境下,KMnO4可以将Mn杂质以MnO2的形式沉淀[35],强酸会生成Mn2+,碱性条件会生成MnO42-。加入理论用量的KMnO4时,由于氧化作用和吸附作用,除锰效果最好且Ni和Co损失最小,如继续加入KMnO4则会出现返锰。
取定容100 mL的浸出液在搅拌状态下加入0.21 g KMnO4,控制温度10 ℃、pH=5左右,在300 r/min搅拌状态下反应100 min,过滤除去红棕色杂质沉淀MnO2,得到浸出净化液。通过测定上清液中Mn残余量计算出除锰率,从而确定除锰所需KMnO4用量、温度和pH值等条件。
1.2.3 产物回收由于Ni和Co的浸出率相对较高,Mn浸出率较低,且Mn容易被沉淀除去,因此采用水热合成-煅烧法[36]从浸出净化液中制备NiCoO2。
室温下,在100 mL浸出液中补加0.788 6 g的NiSO4·6H2O和1.686 6 g的CoSO4·7H2O,搅拌均匀后加入1.5 g表面活性剂聚乙二醇2000, 连续搅拌30 min后加入4.538 5 g草酸,将上述溶液装入100 mL聚四氟乙烯反应釜中,在160 ℃烘箱中保温5 h。然后冷却至室温,抽滤分离出固体沉淀,并用无水乙醇和去离子水混合洗涤,然后在干燥箱中60 ℃干燥5 h,得到前驱体。最后,在有氧气氛下,将前驱体在400 ℃煅烧2 h,得到回收产物。
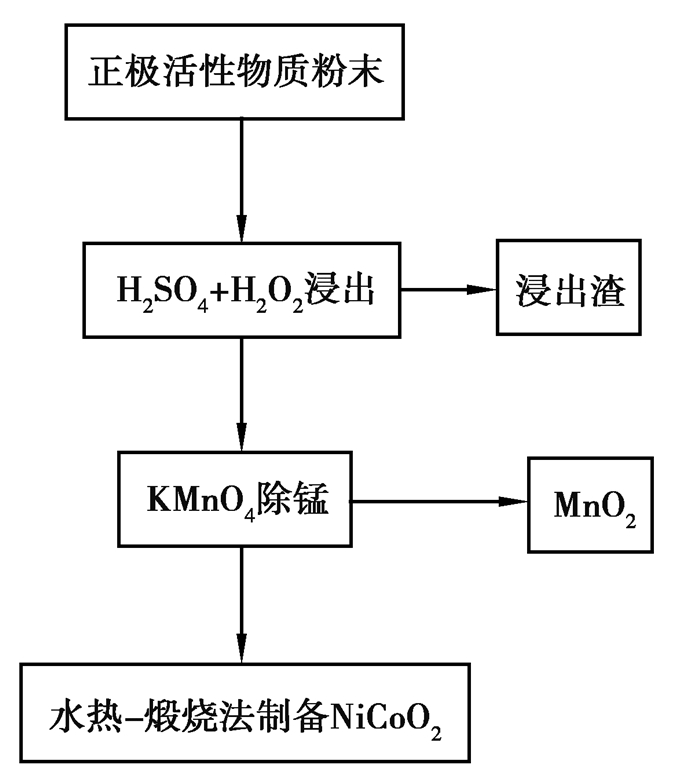
实验的工艺流程如图 2所示。
|
图 2 实验流程图 Fig. 2 Experimental flow chart |
电极材料、预处理后活性物质粉末及浸出液中Ni、Co、Mn的含量分析采用Agilent 5110型电感耦合等离子发射光谱仪(ICP-OES);电极材料、预处理后活性物质粉末、浸出渣、沉淀分离的杂质及回收产物的物相组成分析用D8 ADVANCE A25型X射线衍射仪(XRD)分析;活性物质粉末、浸出渣、沉淀分离的杂质及回收产物的微观形貌特征采用型号为Gemini SEM 300场发射扫描电子显微镜(SEM)分析。
浸出液中有价元素浸出率的计算公式为
| $ \eta=\frac{m_{\mathrm{Me}}^{\prime}}{m_{\mathrm{Me}}} \times 100 \% , $ | (3) |
式中:m′Me为浸出液中Ni、Co、Mn的质量;mMe为浸出原料中Ni、Co、Mn的质量。
2 结果与讨论 2.1 浸出条件对浸出率的影响 2.1.1 正交实验设计设计了5因素4水平的正交实验,浸出率结果如表 2所示,极差分析如表 3所示。
| 表 2 正交实验浸出率 Table 2 Leaching rate of orthogonal experiment |
| 表 3 正交实验结果的极差分析 Table 3 Range analysis of orthogonal experiment results |
表 3中的k值代表各个因素的水平均值,R为因素的极差,根据极差R的大小可以判断各因素影响的主次关系。影响Ni和Co的浸出率的因素主次关系相同:浸出温度>H2SO4浓度>H2O2体积分数>固液比>浸出时间;影响Mn的浸出率因素的主次关系为:浸出温度>固液比>H2O2体积分数>H2SO4浓度>浸出时间;浸出温度是对Ni、Co和Mn的浸出率影响最大的因素,浸出时间在一定范围内影响最小,根据影响因素的影响程度依次进行单因素实验,以确定出最佳反应条件。
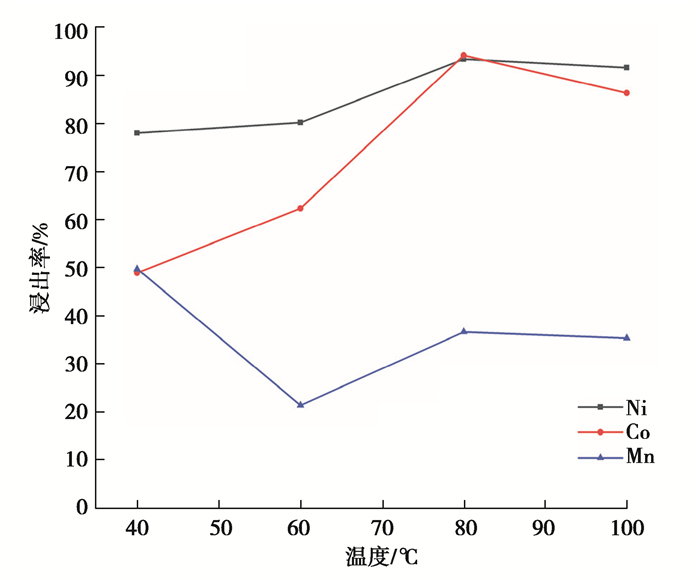
2.1.2 单因素实验1) 浸出温度对浸出率的影响。用浓度为3.0 mol/L的H2SO4,体积分数为4%的H2O2,固液比1∶14 g/mL,浸出反应60 min,探究浸出温度分别为40,60,80,100 ℃时Ni、Co、Mn浸出率的变化情况,结果如图 3所示。
|
图 3 浸出温度对镍钴锰浸出率的影响 Fig. 3 Effect of leaching temperature on leaching rates of nickel, cobalt and manganese |
可以看出,Ni、Co、Mn的浸出率受温度的影响较大,随着反应温度的升高,Ni、Co的浸出率曲线呈先大幅度增加后微减的趋势,Mn的浸出率是先减少再平稳增加。这可能是因为在硫酸浸出过程中,活性物质粉末的溶解浸出是固液非均相反应,升温可以促进化学反应速率和扩散速率。所以综合考虑浸出效果和能耗的损失,选择浸出温度为80 ℃,此时Ni、Co、Mn的浸出率为93.41%、94.21%、36.55%。
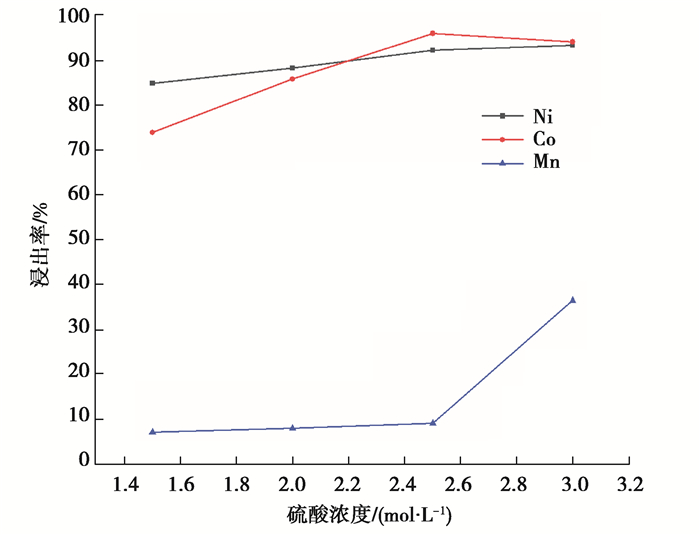
2) 硫酸浓度对浸出率的影响。用体积分数为4%的H2O2,固液比1∶14 g/mL在80 ℃的温度下浸出反应60 min,探究了H2SO4浓度分别为1.5, 2.0, 2.5, 3.0 mol/L时Ni、Co、Mn浸出率的变化,结果如图 4所示。
|
图 4 硫酸浓度对镍钴锰浸出率的影响 Fig. 4 Effect of sulfuric acid concentration on the leaching rates of nickel, cobalt and manganese |
可以看出,H2SO4浓度增大,Ni、Co、Mn的浸出率均增加,Ni的浸出率平缓增大,Co的浸出率先增大,到2.5 mol/L时达到顶峰然后稍有下滑,而Mn的浸出率前期变化不大,到2.5 mol/L后急剧增加。考虑到Mn进入浸出液中为杂质的原因,选择H2SO4浓度为2.5 mol/L,此时Ni、Co、Mn的浸出率为92.26%、95.99%、9.21%。
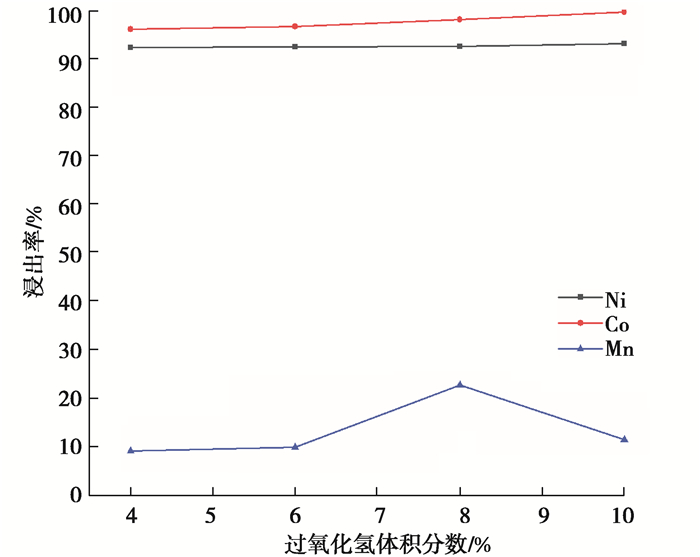
3) 过氧化氢体积分数对浸出率的影响。用2.5 mol/L的H2SO4,固液比1∶14 g/mL,在80 ℃的温度下浸出反应60 min,探究了H2O2体积分数分别为4%、6%、8%、10%时Ni、Co、Mn浸出率的变化,结果如图 5所示。
|
图 5 过氧化氢体积分数对镍钴锰浸出率的影响 Fig. 5 Effect of hydrogen peroxide on leaching rate of nickel, cobalt and manganese |
可以看出,还原剂H2O2的还原效果较好,体积分数的变化对Ni、Co的浸出率影响不大,H2O2体积分数增加,Ni、Co的浸出率稍有增加,Mn的浸出率则是先增大后减小。因为Ni在氧化物中是+2价,容易被浸出。而Mn的浸出率低,可能是因为Mn-O键不易被破坏[37]。所以综合分析,选择H2O2体积分数为10.0%,Ni、Co、Mn的浸出率分别为93.03%、99.55%、11.52%。
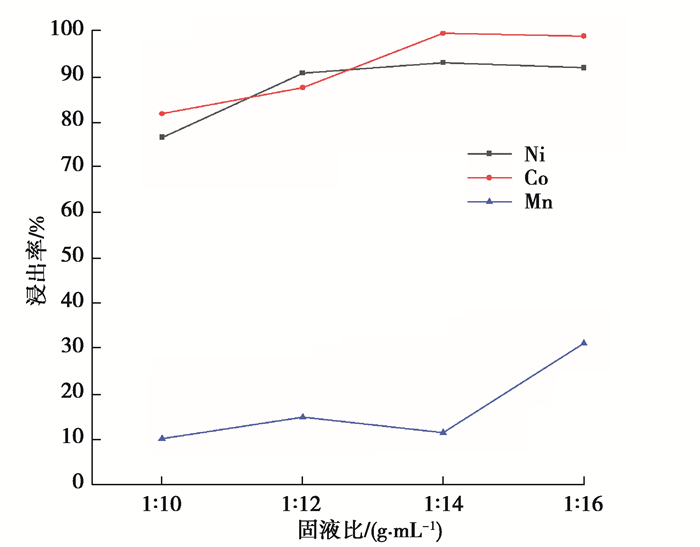
4) 固液比对浸出率的影响。用2.5 mol/L的H2SO4和体积分数为10%的H2O2,在80 ℃的温度下浸出反应60 min,探究了固液比分别为1∶10,1∶12,1∶14,1∶16 g/m L时Ni、Co、Mn浸出率的变化,结果如图 6所示。
|
图 6 固液比对镍钴锰浸出率的影响 Fig. 6 Effect of solid-to-liquid ratio on leaching rate of nickel, cobalt and manganese |
可以看出,固液比增加,Ni、Co的浸出率先增加后微减,Mn的浸出率则总体增大。固液比大于1∶14 g/mL时,Ni、Co的浸出率上升后开始缓慢下降,主要原因可能是增大固液比,固体颗粒与溶液接触更充分,浸出体系的流动性也更好,浸出过程中细小颗粒的运动和碰撞加剧,从而促进了反应的进行;但固液比过大会导致浸出液浓度降低,不利于后续回收工作。所以综合考虑,选固液比为1∶14 g/mL,Ni、Co、Mn的浸出率分别为93.03%、99.55%、11.52%。
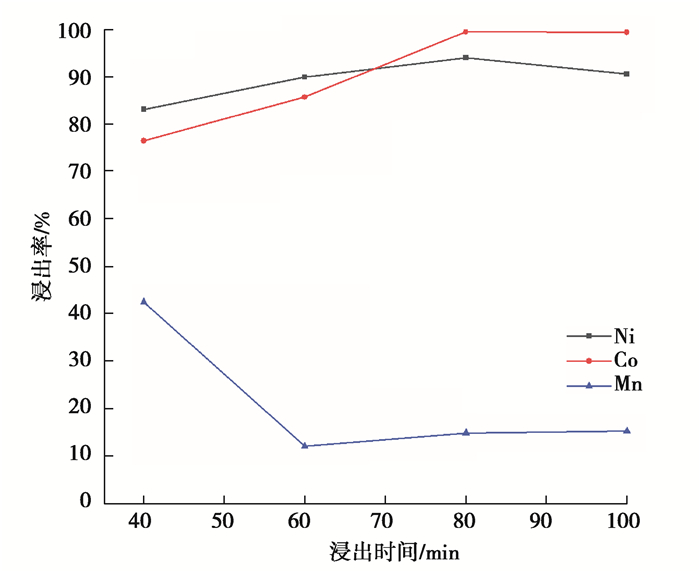
5) 浸出时间对浸出率的影响。用2.5 mol/L的H2SO4和体积分数10%的H2O2,固液比1∶14 g/mL,在80 ℃的温度下浸出反应,探究了浸出时间分别为40, 60, 80, 100 min时Ni、Co、Mn浸出率的变化,结果如图 7所示。
|
图 7 浸出时间对镍钴锰浸出率的影响 Fig. 7 Effect of leaching time on leaching rate of nickel, cobalt and manganese |
可以看出,浸出时间增加到80 min时,Ni、Co的浸出率逐渐增加,然后继续反应,Ni的浸出率有所下降而Co的浸出率基本趋于稳定,Mn的浸出率曲线则先降后缓慢增加。当浸出时间大于80 min,3种金属的浸出率变化很小,说明继续延长浸出时间对浸出率已无明显提升。因此选择浸出时间为80 min。此时Ni、Co和Mn的浸出率为94.03%、99.56%、14.97%。
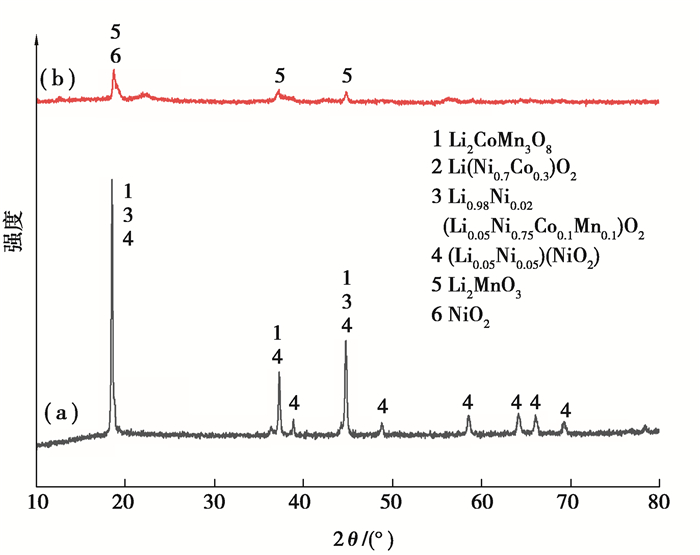
2.1.3 浸出前后固体分析将正极活性物质用2.5 mol/L的H2SO4和体积分数10%的H2O2,在固液比为1∶14 g/mL,80 ℃的温度下浸出80 min,固液分离后将浸渣洗涤、干燥。对浸出前活性物质粉末和浸出渣进行物相(XRD)和形貌(SEM)分析,结果如图 8、9所示。可以看出,浸出前正极活性物质的物相主要为镍钴锰锂化合物,浸出渣的物相主要是Li2MnO3和NiO2;浸出前的活性物质颗粒较大,是圆润的微米颗粒,浸出渣为纳米尖晶石结构团聚起来的微米颗粒。
|
图 8 浸出前后的XRD图谱:(a)浸出前;(b)浸出后 Fig. 8 XRD patterns before and after leaching |

|
图 9 浸出前后固体的SEM图:(a)浸出前;(b)浸出后 Fig. 9 SEM images of solids before and after leaching |
浸出渣中Mn的回收参考江泉[38]的研究:将锰酸盐酸浸后,加入NaOH溶液调节pH值在9~10左右,将其中的Mn以MnO2的形式浸出回收,经液固分离后在母液中加入Na2CO3,可得到Li2CO3。这部分工作将在后续研究中开展。
2.2 浸出液的净化净化后的溶液中,Mn杂质的浓度可降至0.45 mmol/L以下,计算得到Mn的除杂率大于98%。所得红棕色沉淀的物相(XRD)和形貌(SEM)分别如图 10及11所示。可以看出,沉淀产物为MnO2。
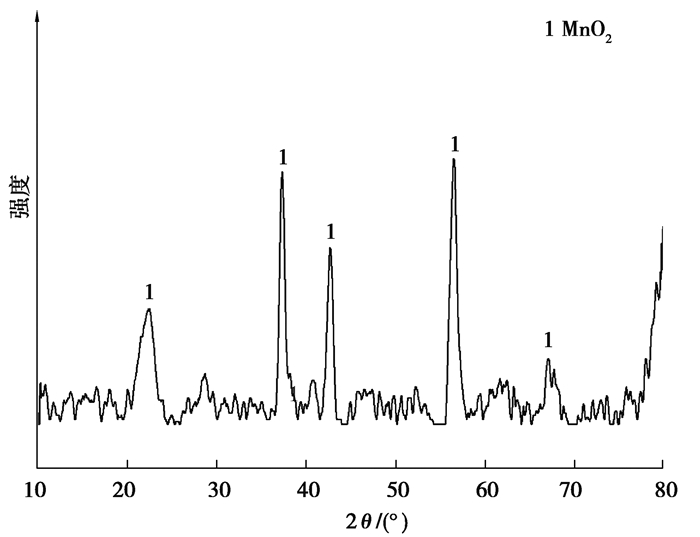
|
图 10 MnO2的XRD图谱 Fig. 10 XRD pattern of MnO2 |

|
图 11 MnO2的SEM图 Fig. 11 SEM image of MnO2 |
回收产物的形貌(SEM)、能谱(EDS)和物相(XRD)分析分别如图 12~14所示。

|
图 12 回收产物SEM图 Fig. 12 SEM image of recovery product |
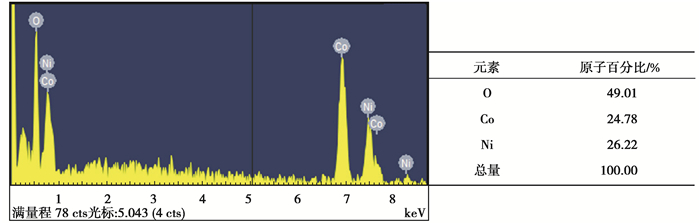
|
图 13 回收产物的EDS测试 Fig. 13 EDS spectrum of recovery product |
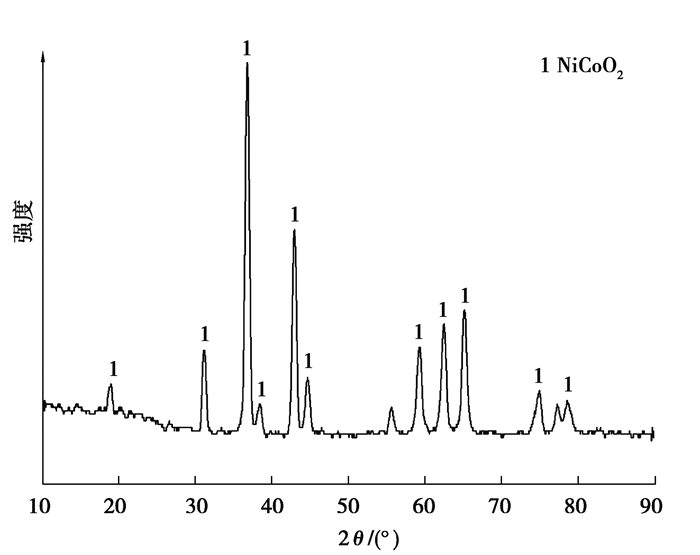
|
图 14 回收产物的XRD图谱 Fig. 14 XRD pattern of recovery product |
由图 12可以看出,产物的形貌为均匀的微米级链状结构,从图 13的能谱数据可以看出,产物中存在Ni、Co、O三种元素,其原子百分比接近1∶1∶2,结合XRD分析结果可以推测回收产物为NiCoO2。
因此以聚乙二醇2000做活性剂,采用160 ℃水热合成、400 ℃煅烧法可从电池正极活性材料的浸出净化液中回收制备出形貌均匀的黑色链状NiCoO2。
浸出净化液中含有的少量的Li+和除杂带入的K+不与草酸发生反应。用水热法从浸出液中络合沉淀出镍和钴后,母液中又产生H2SO4,控制好草酸的加入量,可使含有H2SO4的母液返回浸出阶段再利用。
3 结论1) 采用H2SO4与H2O2为浸出剂和还原剂浸出NCM523型废旧锂离子电池正极活性物质中的有价金属Ni、Co、Mn,正交实验结果表明浸出因素的影响程度从大到小为:浸出温度>H2SO4浓度>H2O2体积分数>固液比>浸出时间,单因素实验得到的最佳浸出条件为:浸出温度80 ℃、H2SO4浓度2.5 mol/L、H2O2体积分数10%、固液比为1∶14 g/mL、浸出时间80 min。此时Ni、Co、Mn的浸出率分别为94.03%、99.56%、14.97%。通过控制浸出条件,可实现Ni、Co的选择性浸出。
2) 以KMnO4做氧化剂,浸出液中Mn残余浓度可降至0.45 mmol/L以下。
3) 以聚乙二醇2000作表面活性剂,草酸作沉淀剂,经160 ℃水热合成、400 ℃煅烧可从浸出净化液中制备出形貌均匀的黑色链状NiCo2O4,实现正极材料中有价金属Ni和Co的综合回收。
| [1] |
昝文宇, 马北越, 刘国强. 动力锂电池回收利用现状与展望[J]. 稀有金属与硬质合金, 2020, 48(5): 5-9, 71. Zan W Y, Ma B Y, Liu G Q. Current situation and prospect of recovery and utilization of power lithium batteries[J]. Rare Metals and Cemented Carbides, 2020, 48(5): 5-9, 71. (in Chinese) |
| [2] |
周和平. 市值超300亿元, 废旧电池回收"钱"景看好[J]. 中国石油和化工, 2019(6): 28. Zhou H P. Market value of more than 30 billion yuan, waste battery recycling "money" prospects[J]. China Petroleum and Chemical Industry, 2019(6): 28. (in Chinese) |
| [3] |
魏锦雯, 杜英, 谢丽娟, 等. 电动汽车废旧电池回收工艺研究[J]. 内燃机与配件, 2020(1): 23-24. Wei J W, Du Y, Xie L J, et al. Research on recycling technology of waste battery for electric vehicle[J]. Internal Combustion Engine & Parts, 2020(1): 23-24. (in Chinese) DOI:10.3969/j.issn.1674-957X.2020.01.013 |
| [4] |
Shin S M, Kim N H, Sohn J S, et al. Development of a metal recovery process from Li-ion battery wastes[J]. Hydrometallurgy, 2005, 79(3/4): 172-181. |
| [5] |
卫寿平, 孙杰, 周添, 等. 废旧锂离子电池中金属材料回收技术研究进展[J]. 储能科学与技术, 2017, 6(6): 1196-1207. Wei S P, Sun J, Zhou T, et al. Research development of metals recovery from spent lithium-ion batteries[J]. Energy Storage Science and Technology, 2017, 6(6): 1196-1207. (in Chinese) |
| [6] |
Bertuol D A, Toniasso C, Jiménez B M, et al. Application of spouted bed elutriation in the recycling of lithium ion batteries[J]. Journal of Power Sources, 2015, 275: 627-632. DOI:10.1016/j.jpowsour.2014.11.036 |
| [7] |
孙亮. 废旧锂离子电池回收利用新工艺的研究[D]. 长沙: 中南大学, 2012. Sun L. A novel reclamation process for spent lithium-ion batteries[D]. Changsha: Central South University, 2012. (in Chinese) |
| [8] |
Sun L, Qiu K Q. Vacuum pyrolysis and hydrometallurgical process for the recovery of valuable metals from spent lithium-ion batteries[J]. Journal of Hazardous Materials, 2011, 194: 378-384. DOI:10.1016/j.jhazmat.2011.07.114 |
| [9] |
Yang Y, Huang G Y, Xu S M, et al. Thermal treatment process for the recovery of valuable metals from spent lithium-ion batteries[J]. Hydrometallurgy, 2016, 165: 390-396. DOI:10.1016/j.hydromet.2015.09.025 |
| [10] |
Zhang X H, Xie Y B, Cao H B, et al. A novel process for recycling and resynthesizing LiNi1/3Co1/3Mn1/3O2 from the cathode scraps intended for lithium-ion batteries[J]. Waste Management, 2014, 34(9): 1715-1724. DOI:10.1016/j.wasman.2014.05.023 |
| [11] |
王光旭, 李佳, 许振明. 废旧锂离子电池中有价金属回收工艺的研究进展[J]. 材料导报, 2015, 29(7): 113-123. Wang G X, Li J, Xu Z M. Recycling valuable metals from spent lithium ion batteries[J]. Materials Review, 2015, 29(7): 113-123. (in Chinese) |
| [12] |
周涛, 徐莉萍, 范百林, 等. 从废旧钴镍锰酸锂电池中回收有价金属的新工艺[J]. 徐州工程学院学报(自然科学版), 2017, 32(1): 6-12. Zhou T, Xu L P, Fan B L, et al. Recovering valuable metals from spent Li-ion batteries witt malic acid[J]. Journal of Xuzhou Institute of Technology (Natural Sciences Edition), 2017, 32(1): 6-12. (in Chinese) |
| [13] |
曹玲, 刘雅丽, 康铎之, 等. 废旧锂电池中有价金属回收及三元正极材料的再制备[J]. 化工进展, 2019, 38(5): 2499-2505. Cao L, Liu Y L, Kang D Z, et al. Recovery of valuable metals from spent lithium ion battery and the resynthesis of Li(Ni1/3Co1/3Mn1/3)O2 materials[J]. Chemical Industry and Engineering Progress, 2019, 38(5): 2499-2505. (in Chinese) |
| [14] |
Chen X P, Chen Y B, Zhou T, et al. Hydrometallurgical recovery of metal values from sulfuric acid leaching liquor of spent lithium-ion batteries[J]. Waste Management, 2015, 38: 349-356. DOI:10.1016/j.wasman.2014.12.023 |
| [15] |
Li J H, Li X H, Hu Q Y, et al. Study of extraction and purification of Ni, Co and Mn from spent battery material[J]. Hydrometallurgy, 2009, 99(1/2): 7-12. |
| [16] |
Wang R C, Lin Y C, Wu S H. A novel recovery process of metal values from the cathode active materials of the lithium-ion secondary batteries[J]. Hydrometallurgy, 2009, 99(3/4): 194-201. |
| [17] |
Lee C K, Rhee K I. Preparation of LiCoO2 from spent lithium-ion batteries[J]. Journal of Power Sources, 2002, 109(1): 17-21. DOI:10.1016/S0378-7753(02)00037-X |
| [18] |
Li L, Dunn J B, Zhang X X, et al. Recovery of metals from spent lithium-ion batteries with organic acids as leaching reagents and environmental assessment[J]. Journal of Power Sources, 2013, 233: 180-189. DOI:10.1016/j.jpowsour.2012.12.089 |
| [19] |
Dolker T, Pant D. Chemical-biological hybrid systems for the metal recovery from waste lithium ion battery[J]. Journal of Environmental Management, 2019, 248: 109270. DOI:10.1016/j.jenvman.2019.109270 |
| [20] |
Li L, Bian Y F, Zhang X X, et al. Process for recycling mixed-cathode materials from spent lithium-ion batteries and kinetics of leaching[J]. Waste Management, 2018, 71: 362-371. DOI:10.1016/j.wasman.2017.10.028 |
| [21] |
Li L, Lu J, Ren Y, et al. Ascorbic-acid-assisted recovery of cobalt and lithium from spent Li-ion batteries[J]. Journal of Power Sources, 2012, 218: 21-27. DOI:10.1016/j.jpowsour.2012.06.068 |
| [22] |
Sun L, Qiu K Q. Organic oxalate as leachant and precipitant for the recovery of valuable metals from spent lithium-ion batteries[J]. Waste Management, 2012, 32(8): 1575-1582. DOI:10.1016/j.wasman.2012.03.027 |
| [23] |
朱显峰, 赵瑞瑞, 常毅, 等. 废旧锂离子电池三元正极材料酸浸研究[J]. 电池, 2017, 47(2): 105-108. Zhu X F, Zhao R R, Chang Y, et al. Study on the acid leaching of ternary anode materials in spent Li-ion battery[J]. Battery Bimonthly, 2017, 47(2): 105-108. (in Chinese) |
| [24] |
孙明藏, 叶华, 陈武杰, 等. 从废旧锂离子电池中回收有价值金属的研究[J]. 有色金属(冶炼部分), 2019(3): 68-72. Sun M C, Ye H, Chen W J, et al. Study on recovering valuable metals from spent lithium-ion batteries[J]. Nonferrous Metals (Extractive Metallurgy), 2019(3): 68-72. (in Chinese) DOI:10.3969/j.issn.1007-7545.2019.03.016 |
| [25] |
王斌, 梁精龙, 李慧, 等. 废旧锂离子电池金属离子回收技术综述[J]. 电源技术, 2019, 43(1): 165-167. Wang B, Liang J L, Li H, et al. Current status of recovery of valuable metal ions in lithium ion batteries[J]. Chinese Journal of Power Sources, 2019, 43(1): 165-167. (in Chinese) DOI:10.3969/j.issn.1002-087X.2019.01.048 |
| [26] |
王晓峰, 孔祥华, 赵增营. 锂离子电池中贵重金属的回收[J]. 电池, 2001, 31(1): 14-15. Wang X F, Kong X H, Zhao Z Y. Recovery of noble metal in lithium ion battery[J]. Battery Bimonthly, 2001, 31(1): 14-15. (in Chinese) DOI:10.3969/j.issn.1001-1579.2001.01.006 |
| [27] |
陈亮, 唐新村, 张阳, 等. 从废旧锂离子电池中分离回收钴镍锰[J]. 中国有色金属学报, 2011, 21(5): 1192-1198. Chen L, Tang X C, Zhang Y, et al. Separation and recovery of Ni, Co and Mn from spent lithium-ion batteries[J]. The Chinese Journal of Nonferrous Metals, 2011, 21(5): 1192-1198. (in Chinese) |
| [28] |
Liu T C, Chen J, Shen X, et al. Regulating and regenerating the valuable metals from the cathode materials in lithium-ion batteries by nickel-cobalt-manganese co-extraction[J]. Separation and Purification Technology, 2021, 259: 118088. DOI:10.1016/j.seppur.2020.118088 |
| [29] |
Ning W W, Chen L B, Wei W F, et al. NiCoO2/NiCoP@Ni nanowire arrays: tunable composition and unique structure design for high-performance winding asymmetric hybrid supercapacitors[J]. Rare Metals, 2020, 39(9): 1034-1044. DOI:10.1007/s12598-020-01374-9 |
| [30] |
Kamali Moghaddam S, Ahmadian S M S, Haghighi B. NiCoO2-carbon composite as an efficient bifunctional catalyst for electrochemical water splitting[J]. Ionics, 2020, 26(8): 3959-3967. DOI:10.1007/s11581-020-03568-8 |
| [31] |
段晓净. Fe3+掺杂NiCoO2的制备及电催化性能研究[D]. 重庆: 重庆大学, 2017. Duan X J. Study on synthesis of iron-doped NiCoO2 and its electrocatalytic properties[D]. Chongqing: Chongqing University, 2017. (in Chinese) |
| [32] |
张晨露, 王碧侠, 李卓阳, 等. 废旧锂离子电池正极有价金属回收试验研究[J]. 有色金属工程, 2020, 10(11): 73-78. Zhang C L, Wang B X, Li Z Y, et al. Experiment study on recovery of valuable metals from cathode of the spent lithium ion battery[J]. Nonferrous Metals Engineering, 2020, 10(11): 73-78. (in Chinese) DOI:10.3969/j.issn.2095-1744.2020.11.011 |
| [33] |
陆修远, 张贵清, 曹佐英, 等. 采用硫酸-还原剂浸出工艺从废旧锂离子电池中回收LiNi0.6Mn0.2Co0.2O2[J]. 稀有金属与硬质合金, 2017, 45(6): 14-23. Lu X Y, Zhang G Q, Cao Z Y, et al. Recovery of LiNi0.6Mn0.2Co0.2O2 from spent lithium ion batteries by leaching with H2SO4 and reductants[J]. Rare Metals and Cemented Carbides, 2017, 45(6): 14-23. (in Chinese) |
| [34] |
陈莹博, 王磊, 马洁珺, 等. 氧化法去除废旧锂电池正极材料酸浸液中锰的研究[J]. 有色金属工程, 2020, 10(1): 55-61. Chen Y B, Wang L, Ma J J, et al. Study on the removal of manganese from acid leaching solution of waste positive material of lithium battery by oxidation[J]. Nonferrous Metals Engineering, 2020, 10(1): 55-61. (in Chinese) DOI:10.3969/j.issn.2095-1744.2020.01.009 |
| [35] |
Srivastava R R, Kim M S, Lee J C, et al. Resource recycling of superalloys and hydrometallurgical challenges[J]. Journal of Materials Science, 2014, 49(14): 4671-4686. DOI:10.1007/s10853-014-8219-y |
| [36] |
万宇驰, 湛菁, 陈军. 不同形貌纳米NiCo2O4的研究进展[J]. 无机材料学报, 2019, 34(2): 121-129. Wan Y C, Zhan J, Chen J. Preparation of NiCo2O4 with various morphologies: a review[J]. Journal of Inorganic Materials, 2019, 34(2): 121-129. (in Chinese) |
| [37] |
沈棒, 顾卫星, 袁海平, 等. 废旧三元锂离子电池浸出及纯化技术研究进展[J]. 环境科学与技术, 2018, 41(2): 114-121. Shen B, Gu W X, Yuan H P, et al. A review on leaching and purification technologies of spent ternary Li-ion batteries[J]. Environmental Science & Technology, 2018, 41(2): 114-121. (in Chinese) |
| [38] |
江泉. 电动汽车锰酸锂电池中锰的回收和处理研究[J]. 中国锰业, 2016, 34(6): 148-149, 152. Jiang Q. Recovery and treatment of lithium battery electric vehicles in manganese[J]. China's Manganese Industry, 2016, 34(6): 148-149, 152. (in Chinese) |
 2021, Vol. 44
2021, Vol. 44


