印染废水排量大,成分复杂,含偶氮基团等致癌物质,常规工艺较难处理[1-2],工业上多采取芬顿/类芬顿氧化技术[3-4]。相较于传统芬顿技术,非均相光芬顿因其更广的pH范围,可循环利用,不产生铁泥以及易于固液分离等特点而受到关注[5-6]。鉴于α-Fe2O3在自然界中广泛存在、热稳定性强且具有较强的光生空穴氧化能力,采用光催化α-Fe2O3的非均相芬顿体系降解水中有机污染物近年来受到关注[7-8],该体系中催化性能不但受材料本身表面性质与形貌结构的影响[9],固液两相界面所导致的催化剂活性位点与H2O2接触面积的减少对催化性能具有一定抑制作用[10]。
Mou等[11]研究表明通过选择性地暴露α-Fe2O3的{104}、{001}、{102}、{110}、{101}、{012}、{113}和{018}具有更多活性位点的晶面,可有效提高催化性能。Chan等[12]采用水热合成法调控暴露{104},{113}和{001}晶面光催化降解亚甲基蓝,3 h去除率约50%。Li等[13]采用水热法调控暴露α-Fe2O3的{110}晶面强化对罗丹明B的光催化降解能力,反应4 h的去除率约为80%。大量的文献检阅表明:目前大多研究集中于强调高能晶面的高比例暴露,而较少考虑通过不同晶面间的合理暴露比例促进电子迁移更为快速地还原Fe3+为Fe2+,使非均相芬顿反应快速进行,从而进一步提高催化效率。
因此,研究提出通过调控非均相体系中α-Fe2O3{110}和{113}晶面的暴露比例,以甲基橙为目标污染物,考察H2O2浓度、催化剂投加量、污染物初始质量浓度以及初始pH对催化性能的影响,探究{110}和{113}晶面特定比例下的协同催化效应,并通过H2O2消耗分析及自由基捕获实验进行机理分析,为α-Fe2O3晶面调控非均相芬顿体系光催化降解有机污染物提供借鉴。
1 材料与方法 1.1 试剂与仪器甲基橙、磷酸二氢钠、无水乙醇、浓盐酸、氢氧化钠、浓硫酸、过氧化氢、冰乙酸、乙酸铵、叔丁醇、对苯醌以及草酸钠,购于重庆川东化工有限公司;氟化钠、盐酸羟胺,购于成都科龙化工试剂厂;邻菲罗啉、草酸钛钾,购于天津科密欧化学品有限公司;六水合氯化铁,购于上海阿拉丁试剂有限公司。以上试剂均为分析纯。
万分之一天平(美国奥豪斯,CP214C)、磁力搅拌器(上海予申,85-1型)、反应釜(秋佐科技,100 mL)、UV紫外灯(飞利浦灯具,主波长254 nm)、超声波清洗机(宁波新芝,SB-4200TDS)、恒温鼓风干燥箱(北京泰合格润,101-DFD-7000)、冷冻离心机(湖南迈克尔,TGL-20M)、便携式pH计(上海仪电,PHB-4型)、紫外分光光度计(德国WTW,Photolab7600 UV-VIS)、超纯水机(上海和泰,Smart-S15)、X射线衍射仪(德国Bruker D8 advance)、透射电子显微镜(美国FEI,FEI Tecnai G2 F20)、傅里叶红外光谱仪(美国尼高力,FTIR Nicoet 4)、紫外可见近红外分光光度计(日本岛津,UV-3600)。
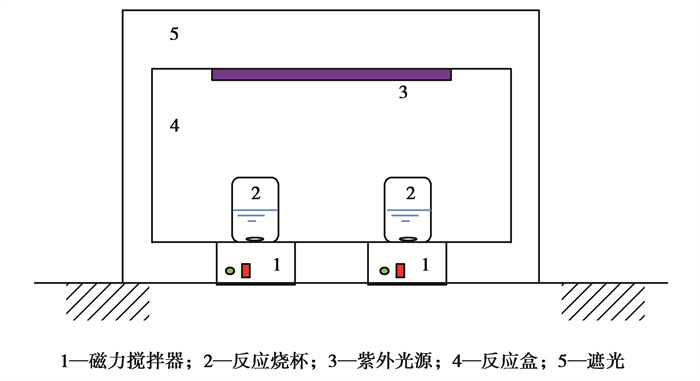
非均相光芬顿反应实验装置示意图如图 1所示。紫外灯管作为光源,功率为6 W,紫外线剂量为57.6 J/cm2;反应烧杯中放入搅拌转子,采用磁力搅拌器保证反应过程中催化剂分散均匀。
|
图 1 非均相光芬顿反应装置示意图 Fig. 1 Schematic diagram of heterogeneous photo-Fenton reaction device |
取FeCl3·6H2O、NaF及NaH2PO4于烧杯中,加入30 mL去离子水,玻璃棒搅拌5 min后超声30 min;将上述混合体系转移至聚四氟乙烯内衬并放入反应釜中,于鼓风干燥箱保持高温高压状态反应24 h;待反应釜自然冷却至室温,将制得的α-Fe2O3于8 000 r/min条件下离心5 min,采用无水乙醇和去离子水各清洗3次;清洗完成后于鼓风干燥箱中保持60 ℃烘干。采用单因素实验考察FeCl3·6H2O浓度,NaF投加量,NaH2PO4投加量以及反应温度对α-Fe2O3{110}和{113}晶面暴露比例的影响。
1.3 催化降解特性实验取20~60 mg/L的甲基橙,转移至反应烧杯并调节pH;加入α-Fe2O3催化剂后置于搭建的实验装置中;加入H2O2,常温下进行非均相光芬顿实验2 h,每隔20 min用一次性注射器取样4 mL,经过0.45 μm聚醚砜(PES)滤膜分离催化剂后,测定样品中甲基橙吸光度。
采用单因素实验考察H2O2浓度、催化剂投加量、初始pH以及甲基橙初始质量浓度对甲基橙去除率的影响。并在最佳反应条件下,通过重复实验,采用邻菲罗啉比色法测定反应过程中铁离子的质量浓度,验证催化剂的稳定性。
1.4 H2O2消耗分析及自由基捕获实验取50 mL初始质量浓度为40 mg/L的甲基橙溶液于烧杯中,α-Fe2O3催化剂投加量为200 mg/L,H2O2用量为20 mmol/L,调节反应初始pH=5,常温下于非均相光芬顿反应实验装置中反应2 h,间隔20 min取样。采用钛盐光度法测定样品中的H2O2浓度。同时设置未添加H2O2的空白对照组。
保持实验条件不变,通过投加不同浓度的叔丁醇、对苯醌以及草酸钠,分别捕获羟基自由基、超氧自由基以及空穴,观察对甲基橙去除率的影响。
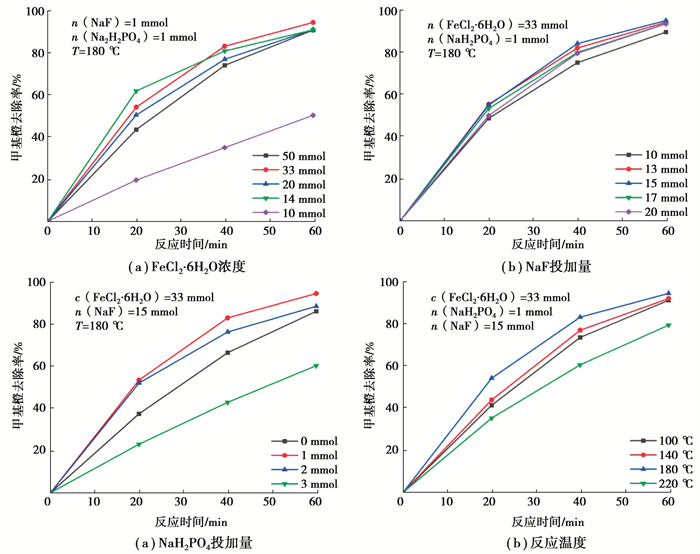
2 结果与讨论 2.1 α-Fe2O3催化剂的制备优化由图 2(a)可知,当FeCl3·6H2O浓度为33 mmol/L时,催化剂性能最好。FeCl3·6H2O浓度过低时,晶体无法完全发育成熟;浓度过高时,在某一时刻晶体成核会呈现爆发式增长,形成许多尺寸较小的晶核,不利于后续的生长发育完善过程[14]。
|
图 2 控制因素对催化剂降解甲基橙效果的影响 Fig. 2 Effects of operational parameters on degradation of MO(methyl orange) by the catalyst |
由图 2(b)可知,随着F-投加量的增加,甲基橙去除效率先升高后降低。当投加量为15 mmol时催化效果最佳。结合XRD、TEM/HRTEM表征结果及Chan等人的研究[12],说明F-通过调控催化剂{113}晶面暴露情况从而影响了催化效果。可以推测暴露的{113}晶面随投加量增加而增大,当投加量增加到一定程度时,其他晶面可能由于竞争影响而逐渐减小甚至消失。此时催化效果降低说明单纯高比例暴露某一高能晶面并不能使催化剂获得最优效果,晶面之间的相互作用更具有意义[15]。
由图 2(c)可知,随着H2PO4-投加量增加,甲基橙去除效率先升高后降低,投加量为1 mmol时催化效果最佳。结合Li等[13]的研究,说明H2PO4-通过调控催化剂{110}晶面暴露情况从而影响了催化效果。此外,其控制的{110}晶面与F-控制的{113}晶面之间存在相互作用,过高或过低暴露某一晶面都将导致催化剂性能降低。
由图 2(d)可知,随着温度升高,甲基橙去除效率先升高后降低,当温度为180 ℃时,催化剂性能最优。因为在晶体α-Fe2O3合成过程中,温度升高会促进Fe3+水解,有利于晶核的形成,促进晶体生长趋于完善,从而影响催化剂形貌结构,但过高温度会导致发育完好的晶体结构发生崩塌溶解。
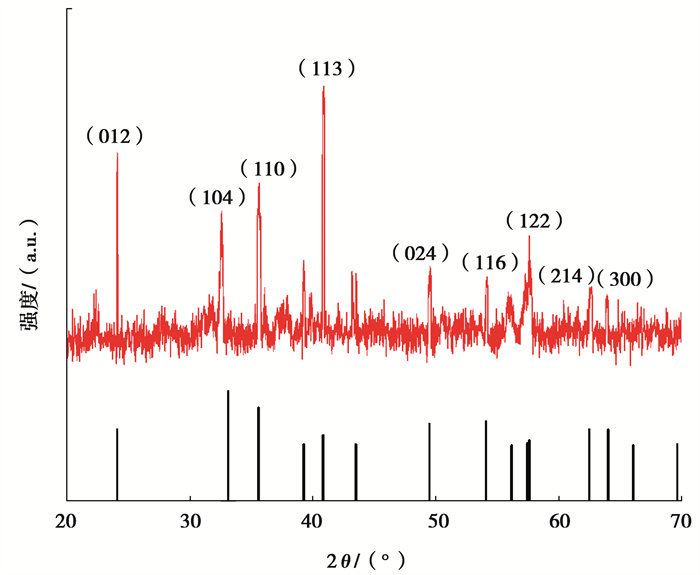
2.2 材料表征分析 2.2.1 X-射线衍射分析(XRD)表征结果如图 3所示。可以看到,α-Fe2O3在2θ为24.1°,33.1°,35.6°,40.8°,249.4°,54.0°,57.4°,62.4°,63.9°附近出现了明显的衍射峰,分别对应{012},{104},{110},{113},{024},{116},{122},{214},{300}晶面,对比标准卡片(JCPDS: 33-0664),二者位置基本一致。其中{110}晶面和{113}晶面的衍射峰强度较标准卡片更强,说明通过添加NaH2PO4和NaF调控{110}晶面和{113}晶面使其获得了高度暴露;且{113}晶面衍射峰强度明显高于{110}晶面,这也与实验中NaF投加量远大于NaH2PO4有关。
|
图 3 α-Fe2O3的XRD图谱 Fig. 3 XRD spectrum of α-Fe2O3 |
表征结果如图 2.3所示。由图 4(a)~(d)可以看到,催化剂呈分散颗粒状,尺寸大小约为500 nm。图 4(e)~(h)中,可以看到催化剂表面明显的晶格条纹,通过Digital Micrograph软件分析可测得晶格间距为0.22 nm、0.25 nm,分别归属于α-Fe2O3的{113}晶面和{110}晶面,表明催化剂表面大量暴露{113}晶面和{110}晶面,这一点与XRD测试结果相吻合。

|
图 4 α-Fe2O3的(a~d)透射电镜图及(e~h)高分辨率透射电镜图 Fig. 4 TEM images (a-d) and HRTEM images (e-h) of α-Fe2O3 |
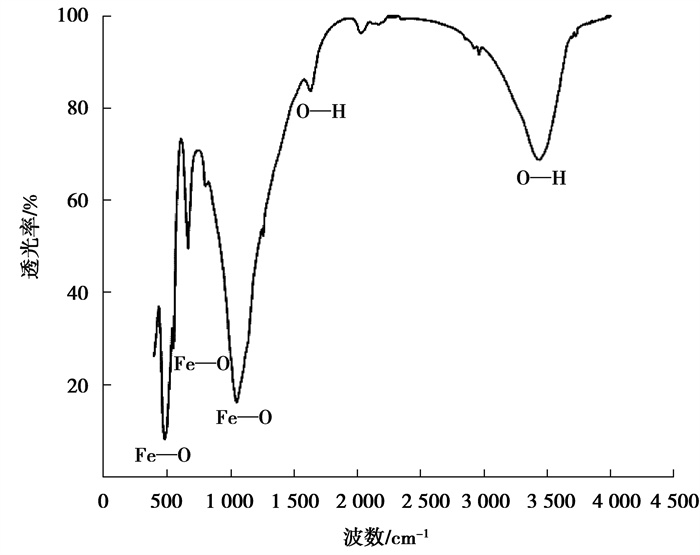
表征结果如图 5所示。可以看出,样品在465 cm-1、544 cm-1、1 087 cm-1附近出现了α-Fe2O3的特征吸收峰,该3处吸收峰归属于Fe3+—O2-伸缩振动[16-17];1 643 cm-1附近吸收峰由H—O—H+的弯曲振动引起;而3 438 cm-1附近吸收峰是α-Fe2O3表面O—H与水形成的氢键伸缩振动所引起[18]。由此可知,α-Fe2O3表面主要存在的官能团为Fe—O和O—H,其催化活性主要与这些官能团的性质有关。
|
图 5 α-Fe2O3的FTIR图谱 Fig. 5 FTIR spectrum of α-Fe2O3 |
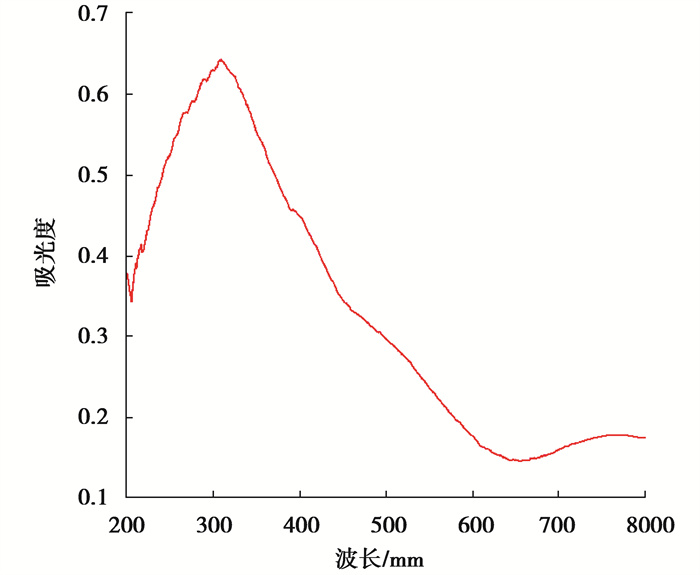
表征结果如图 6所示。在波长200~400 nm范围内,催化剂具有较高的吸收强度,说明对紫外光有良好的响应。但其在400~760 nm的可见光区的吸收强度相对较低。
|
图 6 α-Fe2O3的UV-vis DRS图 Fig. 6 UV-vis DRS diagram of α-Fe2O3 |
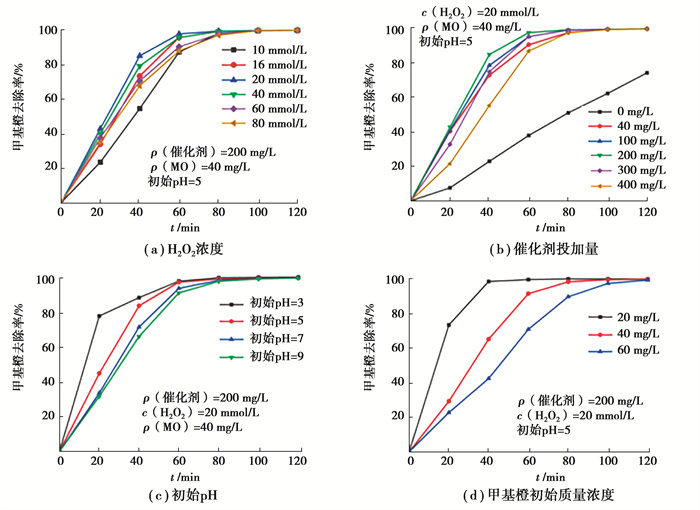
由图 7(a)可知,随着H2O2浓度的增加,甲基橙去除效率先升高后降低。当H2O2浓度为20 mmol/L时,去除效果最佳,反应60 min去除率达97.83%;这是因为当H2O2浓度过低时,无法产生足够的·OH;浓度过高时,·OH被过量H2O2竞争消耗。此外,当反应时间足够长,不同H2O2浓度下的甲基橙去除率不存在明显差异。因为H2O2浓度过高时,消耗·OH产生了其他氧化能力较弱的基团(如·OOH),同时H2O2本身具有氧化能力,可维持反应进行;而H2O2浓度不足时,紫外光辅助芬顿在一定程度上促进了α-Fe2O3表面进行光催化,产生强氧化性的光生电子和空穴并分离,空穴可直接降解甲基橙,也可与H2O反应生成·OH。
|
图 7 控制因素对催化剂降解甲基橙效果的影响 Fig. 7 Effects of operational parameters on degradation of MO by the catalyst |
由图 7(b)可知,随着催化剂投加量的增加,甲基橙去除效率先升高后降低。当催化剂投加量为200 mg/L时,甲基橙去除率最高,反应60 min达97.83%。这是因为反应体系中固液接触界面随催化剂投量增加而增大,反应活性位点增加,单位时间内参与反应的H2O2增多;当催化剂投量过大时,过量的Fe2+将消耗·OH,且短时间产生的大量·OH来不及与污染物反应便发生自我猝灭,见式(1)和(2)。此外,当体系中未投加催化剂时,仅在紫外光和H2O2的自身作用下进行反应,二者氧化性远低于·OH,可以看到污染物降解效果大幅下降,反应60 min甲基橙去除率仅为38.03%。
| $ \cdot \mathrm{OH}+\mathrm{Fe}^{2+} \rightarrow \mathrm{Fe}^{3+}+\mathrm{OH}^{-} , $ | (1) |
| $ \cdot \mathrm{OH}+\cdot \mathrm{OH} \rightarrow \mathrm{H}_2 \mathrm{O}_2 \text { 。} $ | (2) |
由图 7(c)可知,随着pH的增大,甲基橙去除效率逐渐降低。当pH=3时,反应20 min甲基橙去除率达78%,与其他条件下的差异较为明显,可能一是由于pH=3条件下甲基橙分子结构中的偶氮键转变为了醌式结构,N=N键被破坏导致甲基橙分子结构的稳定性降低,使得催化反应更容易进行[19],二是由于过酸条件使得α-Fe2O3发生部分溶解,更多游离的Fe2+/Fe3+与H2O2接触,单位时间产生更多的·OH,从而提高了甲基橙去除率。而随着pH的增大,促使反应向生成氧化性更弱的·OOH移动,见式(3)和(4),消耗了·OH和H2O2,使得去除率降低;并且在较高的pH条件下,·OH氧化性减弱且H2O2分解加快,与一部分游离的Fe2+/Fe3+发生沉淀,影响了·OH的产量。pH=5条件下,反应60 min去除率为97.83%,与pH=3条件下98.09%的去除率相差无几,考虑到过酸条件下催化剂的损耗,认为pH=5为最适反应条件。反应时间足够长,不同pH条件下甲基橙的去除率几乎相同,表明催化剂在一定程度上拓宽了芬顿反应中pH的适用范围。
| $ \cdot \mathrm{OH}+\mathrm{H}_2 \mathrm{O}_2 \rightarrow \cdot \mathrm{OOH}+\mathrm{H}_2 \mathrm{O} , $ | (3) |
| $ \cdot \mathrm{OOH}+\mathrm{Fe}^{3+} \rightarrow \mathrm{Fe}^{2+}+\mathrm{H}^{+}+\mathrm{O}_2 。$ | (4) |
由图 7(d)可知,随着甲基橙初始质量浓度的增加,甲基橙去除效率逐渐降低。当初始质量浓度为20 mg/L时效果最佳,反应40 min去除率达98.65%。这是由于当初始质量浓度较低,反应体系中产生的·OH相对充足,从而在短时间内接近完全去除。而当初始质量浓度增大时,由于α-Fe2O3和H2O2的投加量固定,此时·OH的产生速率成为限制因素,因此去除率降低。
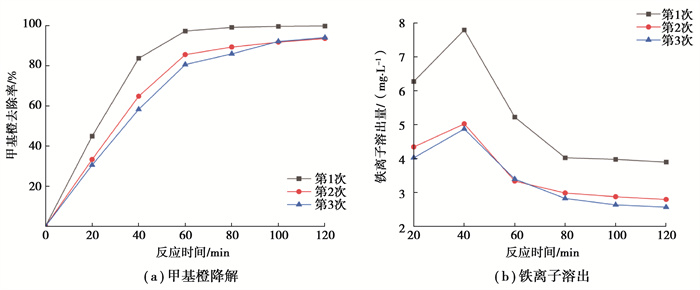
重复性实验结果如图 8所示。由图 8(a)可知,催化剂第二次使用时,去除效果有所降低,反应2 h的甲基橙去除率由97.83%降至93.74%;第三次使用时,去除效果与第二次无较大差异,表明催化剂重复利用性较好。
|
图 8 催化剂重复利用对甲基橙降解及铁离子溶出的影响 Fig. 8 Effects of catalyst repeated using on degradation of MO and leached iron concentration |
由图 8(b)可知,随着重复使用次数的增加,铁离子溶出量呈下降趋势,且随反应时间先增加后减少,最终趋于稳定。第一次使用时,铁离子溶出量相对较高,可能是由催化剂某些结晶度不高的松散表面溶出造成。在第二次使用时,铁离子溶出量大幅下降,反应40 min最大铁离子溶出量为5.02 mg/L,仅占催化剂投加量的2.51%,之后逐渐下降并稳定在2.79 mg/L附近。第三次使用时铁离子溶出量变化较小,说明催化剂趋于稳定。
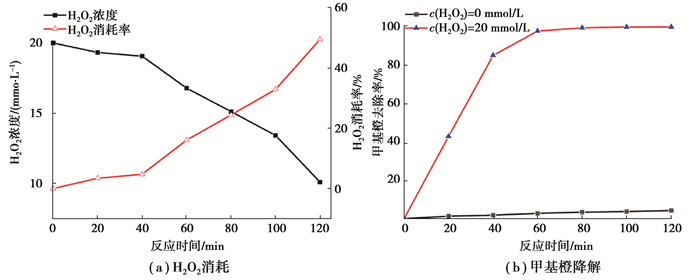
2.4 机理分析 2.4.1 H2O2消耗分析结果如图 9所示。随着反应进行,H2O2浓度逐渐降低,反应2 h的最终消耗率为55.33%,说明仍残留大量H2O2未被有效利用。反应初始阶段,H2O2的消耗缓慢,前40 min消耗率仅为4.71%,而这一过程中甲基橙迅速降解。可以推测在该阶段,除芬顿反应的作用外,还存在α-Fe2O3光催化所产生空穴的辅助氧化。这是因为α-Fe2O3表面覆盖的大量Fe3+,需要在H2O2、光生电子以及紫外光的作用下,转化为Fe2+才能参与芬顿反应,而空穴则可与H2O反应生成·OH对甲基橙进行降解。之后随着反应进行,H2O2的消耗速率明显加快,是因催化剂表面Fe2+/Fe3+循环进入正轨,芬顿反应快速发生而造成。对照组中甲基橙去除率保持在较低水平,反应2 h去除率不足5%,是因为体系中未投加H2O2,无法有效抑制光生空穴与电子的复合,从而影响了空穴辅助氧化的效果。
|
图 9 H2O2消耗情况和甲基橙降解情况 Fig. 9 Consumption of H2O2 and degradation of MO |
由图 10(a)可以看出,甲基橙去除率因投加叔丁醇捕获羟基自由基而大幅下降,且随投加量的增加而降幅增大。叔丁醇投加量为3 mmol/L,反应60 min的去除率较未投加时,由97.83%降至36.12%,从而证明羟基自由基在本实验体系中对降解甲基橙具有关键作用。
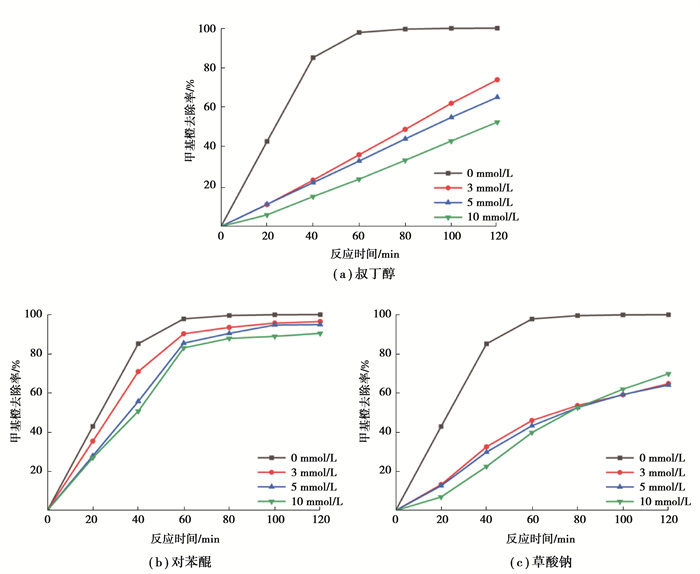
|
图 10 捕获自由基对甲基橙降解的影响 Fig. 10 Effects on degradation of MO by free radical trapping |
由图 10(b)可以看出,甲基橙去除率因投加对苯醌捕获超氧自由基而降低,但受影响程度较小。对苯醌投加量为3 mmol/L,反应60 min的去除率较未投加时下降7.16%,说明超氧自由基在该反应体系中对甲基橙的降解具有一定作用,但远小于羟基自由基。
由图 10(c)可以看出,甲基橙去除率因投加草酸钠捕获空穴而大幅降低。草酸钠投加量为3 mmol/L,反应60 min的去除率较未投加时下降51.8%,说明空穴在反应体系中对甲基橙的降解也十分关键。此外,草酸钠投加量由5 mmol/L增至10 mmol/L时,甲基橙去除率未出现明显持续性下降,可能是由于5 mmol/L的投加量足以捕获体系中所有空穴。
2.4.3 α-Fe2O3晶面调控非均相光芬顿催化氧化机制根据前述实验结果讨论,可以推断本实验体系中,主要反应过程如图 11所示。α-Fe2O3在紫外光作用下激发电子跃迁,产生光生电子(e-)及空穴(h+),其暴露的{110}/{113}晶面促进电子和空穴的分离。迁移至催化剂表面的电子促进Fe3+/Fe2+循环、与H2O2生成·OH,与分子氧生成超氧自由基;而空穴可直接氧化甲基橙,还可与H2O生成·OH。此外,催化剂表面Fe2+活性位点与H2O2接触产生·OH,在紫外光、光生电子以及H2O2的作用下,Fe3+/Fe2+实现稳定循环从而保障非均相光芬顿的持续快速进行;其次,部分微量溶出的Fe3+进行均相芬顿反应。最后,在·OH及空穴等活性物质共同作用下,实现甲基橙的高效降解,将其分解为小分子物质甚至矿化为CO2和H2O。
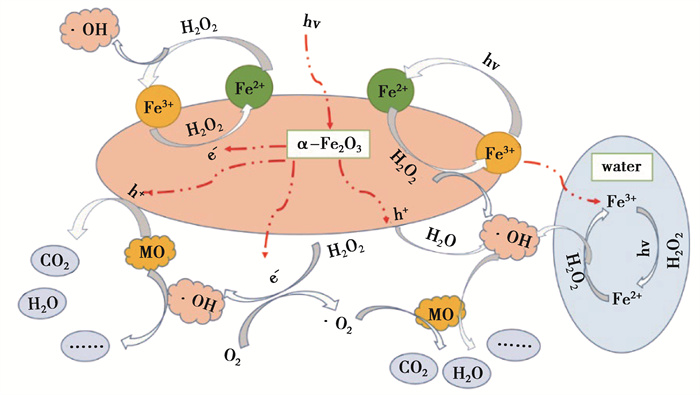
|
图 11 α-Fe2O3晶面调控在非均相光芬顿体系中降解甲基橙的机制示意图 Fig. 11 Schematic diagram of degradation mechanism of α-Fe2O3 crystal plane control in heterogeneous photo-Fenton system for MO |
本实验制备了{110}/{113}晶面暴露的高活性α-Fe2O3催化剂,呈分散颗粒状,尺寸约为500 nm,对紫外光有较高的吸收强度,且保持FeCl3·6H2O浓度为33 mmol/L,摩尔比FeCl3·6H2O∶NaH2PO4∶NaF为1∶1∶15时,在180 ℃下反应24 h获得的催化剂性能最优。在甲基橙初始质量浓度为40 mg/L,初始pH=5,H2O2浓度为20 mmol/L,催化剂投加量为200 mg/L的最佳反应条件下,反应60 min甲基橙去除率达97.83%,催化剂经三次重复利用后稳定性较好,反应2 h甲基橙去除率仍保持93.74%,发挥降解关键作用的是羟基自由基和光生空穴,超氧自由基作用较小。
| [1] |
Samsami S, Mohamadizaniani M, Sarrafzadeh M H, et al. Recent advances in the treatment of dye-containing wastewater from textile industries: Overview and perspectives[J]. Process Safety and Environmental Protection, 2020, 143: 138-163. DOI:10.1016/j.psep.2020.05.034 |
| [2] |
杨明, 刘琪, 孙健, 等. 印染废水深度处理研究及应用进展[J]. 净水技术, 2020, 39(10): 109-115. Yang M, Liu Q, Sun J, et al. Research and application progress of advanced treatment of dyeing wastewater[J]. Water Purification Technology, 2020, 39(10): 109-115. (in Chinese) |
| [3] |
陈婷, 赵琪, 陈泉源, 等. 不同光源照射下天然含铁矿物催化H2O2深度处理印染废水效果对比[J/OL]. 环境工程学报: 1-12[2021-03-23]. http://kns.cnki.net/kcms/detail/11.5591.X.20210301.1650.010.html. Chen T, Zhao Q, Chen Q Y, et al. Advanced treatment of printing and dyeing wastewater by H2O2 catalyzed with natural iron minerals under different light source irridation[J/OL]. Chinese Journal of Environmental Engineering: 1-12[2021-03-23]. http://kns.cnki.net/kcms/detail/11.5591.X.20210301.1650.010.html. (in Chinese) |
| [4] |
Jain B, Singh A K, Kim H, et al. Treatment of organic pollutants by homogeneous and heterogeneous Fenton reaction processes[J]. Environmental Chemistry Letters, 2018, 16(3): 947-967. DOI:10.1007/s10311-018-0738-3 |
| [5] |
吕来, 胡春. 多相芬顿催化水处理技术与原理[J]. 化学进展, 2017, 29(9): 981-999. Lyu L, Hu C. Heterogeneous Fenton catalytic water treatment technology and mechanism[J]. Progress in Chemistry, 2017, 29(9): 981-999. (in Chinese) |
| [6] |
舒弋芮, 张攀, 王玮, 等. 钛白副产硫酸亚铁光芬顿氧化降解甲基橙的研究[J]. 无机盐工业, 2021, 53(3): 68-72. Shu Y R, Zhang P, Wang W, et al. Titanium white by-product ferrous sulfate photofenton oxidation degradation of methyl orange in wastewater[J]. Inorganic Chemicals Industry, 2021, 53(3): 68-72. (in Chinese) |
| [7] |
Gao Y N, Chiang F K, Li S J, et al. Influence of hematite morphology on the CO oxidation performance of Au/α-Fe2O3[J]. Chinese Journal of Catalysis, 2021, 42(4): 658-665. DOI:10.1016/S1872-2067(20)63687-7 |
| [8] |
陈双影, 慕志远, 李志君, 等. 酞菁铜对纳米α-Fe2O3光催化剂的表面改性[J]. 哈尔滨工业大学学报, 2020, 52(6): 134-139. Chen S Y, Mu Z Y, Li Z J, et al. Surface modification of nano α-Fe2O3 by copper phthalocyanine[J]. Journal of Harbin Institute of Technology, 2020, 52(6): 134-139. (in Chinese) |
| [9] |
Pereira M C, Oliveira L C A, Murad E. Iron oxide catalysts: Fenton and Fentonlike reactions - a review[J]. Clay Minerals, 2012, 47(3): 285-302. DOI:10.1180/claymin.2012.047.3.01 |
| [10] |
Jia L D, Zhang Q R. Heterogeneous Fenton catalytic oxidation for water treatment[J]. Progress in Chemistry, 2020, 32(7): 978-988. |
| [11] |
Mou X L, Wei X J, Li Y, et al. Tuning crystal-phase and shape of Fe2O3 nanoparticles for catalytic applications[J]. CrystEngComm, 2012, 14(16): 5107. |
| [12] |
Chan J Y, Ang S Y, Ye E Y, et al. Heterogeneous photo-Fenton reaction on hematite (α-Fe2O3){104}, {113} and {001} surface facets[J]. Physical Chemistry Chemical Physics, 2015, 17(38): 25333-25341. |
| [13] |
Li P W, Ji J L, Deng X, et al. Fe2O3 icositetrahedra: evolution and their comparative photocatalytic activities[J]. CrystEngComm, 2015, 17(38): 7283-7289. |
| [14] |
Murray C B, Kagan C R, Bawendi M G. Synthesis and characterization of monodisperse nanocrystals and close-packed nanocrystal assemblies[J]. Annual Review of Materials Science, 2000, 30(1): 545-610. |
| [15] |
王翔, 李仁贵, 徐倩, 等. 锐钛矿(001)与(101)晶面在光催化反应中的作用[J]. 物理化学学报, 2013, 29(7): 1566-1571. Wang X, Li R G, Xu Q, et al. Roles of (001) and (101) facets of anatase TiO2 in photocatalytic reactions[J]. Acta Physico-Chimica Sinica, 2013, 29(7): 1566-1571. (in Chinese) |
| [16] |
Sugimoto T, Wang Y S, Itoh H, et al. Systematic control of size, shape and internal structure of monodisperse α-Fe2O3 particles[J]. Colloids and Surfaces A: Physicochemical and Engineering Aspects, 1998, 134(3): 265-279. |
| [17] |
Mohapatra M, Rout K, Singh P, et al. Fluoride adsorption studies on mixed-phase nano iron oxides prepared by surfactant mediation-precipitation technique[J]. Journal of Hazardous Materials, 2011, 186(2/3): 1751-1757. |
| [18] |
Ruan H D, Frost R L, Klopeogge J T, et al. Infrared spectroscopy of goethite dehydroxylation: Ⅲ. FT-IR microscopy of in situ study of the thermal transformation of goethite to hematite[J]. Spectrochimica Acta Part A: Molecular and Biomolecular Spectroscopy, 2002, 58(5): 967-981. |
| [19] |
王怡中, 符雁, 汤鸿霄. 二氧化钛悬浆体系太阳光催化降解甲基橙研究[J]. 环境科学学报, 1999, 19(1): 63-67. Wang Y Z, Fu Y, Tang H X. Solar photocatalytic oxidation of methyl orange with TiO2 suspension[J]. Acta Scientiae Circumstantiae, 1999, 19(1): 63-67. (in Chinese) |
 2023, Vol. 46
2023, Vol. 46

