艰难梭状芽孢杆菌(Clostridium difficile)是一种可以生长在很多种介质中的具有发酵氨基酸能力的梭状芽孢杆菌。它可以引起人类的胃肠道感染,也是病人进行长期抗生素治疗后引起腹泻并发症的最重要的原因之一。初期的研究表明对羟基甲苯(一种致病性化合物),可能是艰难梭状芽孢杆菌所引起的疾病中的一个非常重要的致病因子,而该化合物的作用方式主要是通过抑制被抗生素改变了的肠道菌群的正常繁殖与调节[1, 2]。在酪氨酸的发酵反应中,前体对羟基苯乙酸形成终产物对羟基甲苯是经过脱羧反应进行和完成的,催化这一反应的酶被鉴定为HPA脱羧酶[3, 4, 5]。该酶的催化是通过产生甘氨酸自由基进行,属于甘氨酸自由基酶(GREs)系统[6, 7, 8, 9, 10]。由于该类酶具有其他几种已知的GREs所没有的一些结构和功能(如PFL 和NRD),被认为是一种新型的GREs。尤其是小亚基结构的存在,属于该类酶在基因水平上所独有的特殊结构,理论上可以推测,该甘氨酸自由基脱羧酶体系应该具备某种其他GREs所不具备的特殊性质,部分研究结果对这一推测进行了初步的证实,如纯化后的HPA脱羧酶含有FeS簇,而其他几种研究较为深入的GREs不含有这一金属簇合物结构,酶的催化活性需要较高级的酶聚合态,以及在进行脱羧反应的催化过程中的甘氨酸自由基存在产生与淬灭的动态平衡等[4, 5]。Paula等[5]采用直接提取法对野生型的HPA进行了分离和纯化,并作了相应的酶活性测试,结果发现,蛋白质分离纯化之前的无细胞提取液(cell free extract)具有脱羧酶的催化活性,但对其中的蛋白质进行分离纯化后,该复合物完全丧失催化活性,对纯化后的蛋白质进行理化分析,发现该复合物为二聚体,不具有小亚基结构,小亚基在分离纯化的过程已经丢失,说明小亚基的存在直接影响或决定着整个脱羧酶体系的催化活性。因此深入解析小亚基在整个自由基脱羧酶体系中的存在形式与功能对理解整个脱羧酶的催化方式具有非常重要的意义,对临床研究艰难梭状芽孢杆菌的解毒与脱毒也具有很重要的参考意义和价值。
对小亚基氨基酸序列进行数据库搜索,未发现与任何已知功能的蛋白质具有相似性,从前期的实验结果中,初步推断小亚基可能参与复合酶的磷酸化以及高级聚合态的形成,但未进行系列的实验验证,随着CsdBC蛋白质晶体结构的完成[11]及更精细的催化机理解析[12],对小亚基在其中的可能功能进行了理论上的推测,即一方面小亚基与FeS簇直接结合,可能参与调控复合酶的电子传输;另一方面,小亚基的存在可能直接影响复合酶的高级聚合状态及溶解性等。深入细致地研究小亚基在HPA酶催化体系中的功能,可以更好地了解该酶体系的催化特性,并帮助了解FeS簇在催化过程中是否参与自由基淬灭过程,同时加深对催化所需要的复合物的形态认识。为此,笔者从小亚基入手,采用分子生物学技术构建了几种杂化复合酶体系,以期对小亚基在HPA脱羧酶体系中的功能进行深入解析及实验验证。
1 材料与方法所有的基因克隆与亚克隆操作均采用DH5α(感受态细胞中(Invitrogen),基因表达在RossettaTM (DE3) pLysS(Novagen)宿主细胞中进行。质粒的提取、PCR产物分离与纯化实验分别采用试剂盒QIAprep Spin Miniprep kit(Qiagen),QIAquick PCR purification kit(Qiagen)进行。
野生型脱羧酶的表达质粒pASK7-hpdBC,pASK7-csdBC,pASK7-tfdBC在前期研究中已经构建完成并为本实验室储存。
1.1 编码组合杂化酶的表达质粒的构建主要是将hpdBC,tfdBC 和csdBC 3个体系的甘氨酸自由基脱羧酶表达体系的大小亚基基因进行交叉连接与组合,最终获得基于表达载体pASK-IBA7的6个重组杂化脱羧酶表达质粒:pASK7-hpdB/tfdC,pASK7-hpdB/csdC,pASK7-tfdB/csdC,pASK7-tfdB/hpdC,pASK7-csdB/tfdC,pASK7-csdB/hpdC。
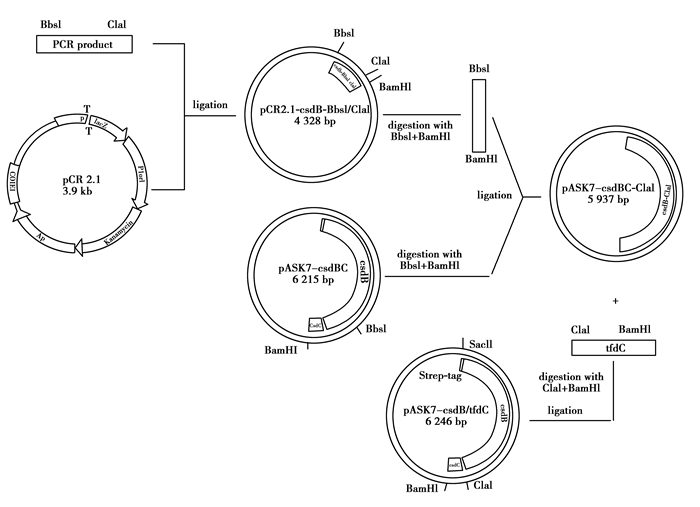
通过DNA序列比对与分析,在TfdBC序列上,大亚基tfdB的终止子下游和小亚基tfdC的核糖体结合位点之间有一个ClaI酶切位点,该位点在原始杂化酶质粒上具有唯一性,因此,对表达质粒pASK7-tfdBC直接进行BamHI/ClaI双酶切,即可获得TfdBC的大亚基表达基因与小亚基表达基因。但是在hpdBC和csdBC序列上,不存在这个特异的ClaI酶切位点,因此需要通过克隆与亚克隆技术将该酶切位点引入到相应的位置,即大亚基hpdB/csdB的终止子下游和小亚基hpdC/csdC的核糖体结合位点之间。克隆过程中所用到的引物列于表 1(表中黑体字部分为限制性酶切位点)。图 1为简化的基因克隆示意图。
| 表1 构建组合杂化酶所用的引物名称及序列 Table 1 the primer sequences used for the construction of combinatorial hybrid enzyme |
|
图1 获取ClaI/BamHI酶切片段及构建组合杂化酶表达体系的克隆与亚克隆示意图 Fig. 1 The cloning and subcloning strategy for obtaining ClaI/BamHI fragment and the construction of hybrid decarboxylase expression vector |
图 1仅以构建组合杂化酶体系pASK7-csdB/tfdC为例。在CsdBC体系中,大亚基B的DNA序列上有一个特异的BbsI酶切位点,对于hpdB来说,这个特异性位点是StuI。
1.2 基于大亚基基因csdB的嵌合杂化酶体系的构建主要是csdB大亚基基因片段与csdC和hpdC之间进行的2个嵌合杂化酶体系的构建。克隆过程中所用到的引物列于表 2(表中黑体字部分为限制性酶切位点)。经PCR扩增后,产生4个片段,分别为hpdC的N端片段(ClaI /Esp3I,Nhpd)和C端片段(Esp3I /BamHI,Chpd),csdC的N端片段(ClaI /Esp3I,Ncsd)和C端片段(Esp3I /BamHI,Ccsd),将表达质粒pASK7-csdBtfdC进行ClaI/BamHI双酶切后,与Nhpd/Ccsd和Ncsd/Chpd进行酶连,即获得终产物pASK7-CsdB-NcsdCChpdC和pASK7-CsdB-CcsdCNhpdC。
| 表2 构建嵌合杂化酶体系所用引物名称及序列 Table 2 The primer sequences used for the construction of chimeric hybrid enzyme |
采用比色法测定复合物中的Fe、S含量。酶活性测试溶液主要包括100 mM Tris-HCl pH 7.5,40 mM NaCl,5 mM MgCl2,5 mM (NH4)2 SO4,5 mM Cysteine,25 mM HPA,2 mM Na2SO3 and 5 mM DTT。详细操作参照文献[4, 5]进行。
2 结果与讨论 2.1 组合杂化酶体系的理化及酶活性检测与小亚基功能解析对构建的6个杂化酶及3个天然酶体系进行了初步的理化检测,获得的结果列于表 3(表中黑体字部分代表野生型的基因构建质粒所表达产物的性质)。同时,对所有的可溶性蛋白均进行菌液酶活性测试及纯化蛋白活性测试,并运用EPR检测甘氨酸自由基的生成信号。
| 表3 组合杂化酶体系的理化性质测试及酶活性测试结果 Table 3 Physio-chemical properties of the combinatorial hybrid enzyme system and enzyme activity test |
结果显示,6个新产生的杂化脱羧酶,有3种杂化方式产生的酶为不可溶性蛋白质,因此无法进行蛋白质的分离与纯化操作。对另外3种可溶性的蛋白质进行纯化后,检测其分子量、聚合状态及FeS簇的含量等,与野生型活性脱羧酶HpdBC及CsdBC相比(复合8聚体结构),三者显示了较低的分子聚合状态(4聚体或者2聚体)。酶活性检测试验没有检测到3种杂化酶的甘氨酸自由基生成信号,3种野生型脱羧酶产生了信号,但观察到的信号强度有很大区别,TfdBC酶给出的甘氨酸信号强度仅为HpdBC或CsdBC的10%左右,在进行HPLC分析时没有检测到相应的产物峰,因此认为当前催化条件下,4聚体状态的TfdBC酶处于无活性状态。上述结果证明,小亚基的正确结构直接影响着蛋白质的可溶性,同时通过直接介导蛋白质分子聚合态的形成影响酶分子的催化活性。该实验也同时证明了酶分子的聚合状态是一个重要的活性调控因子。
杂化酶体系的构建与实验结果表明,小亚基决定着蛋白质的溶解性以及聚合物的聚合状态。野生型CsdBC,HpdBC蛋白为可溶性的复合8聚体结构(β4γ4),具有催化活性,可以催化化合物对羟基乙酸的脱羧反应。而TfdBC为可溶性的复合4聚体结构(β2γ2),系列酶活性测试显示该复合物处于极为微弱的活性状态。把3个体系的小亚基进行相互替换与3个大亚基交互配对连接,获得6种可能的杂化脱羧酶体系,基因表达与蛋白质纯化结果显示,其中的3种杂化酶为不可溶蛋白质,另外3种尽管为可溶性的,但其聚合状态均比野生型蛋白低,相应的FeS簇的含量也降低,而且均未显示酶活性。该实验充分说明小亚基与脱羧酶的溶解性息息相关,同时也决定着聚合物的高级聚合状态以及其中所携带的FeS簇的含量,而正确的蛋白质复合结构才能发挥最终的酶活性。从这个意义上说,小亚基也间接决定着脱羧酶最终的催化活性。
2.2 嵌合体杂化酶体系的物化检测与小亚基功能解析为了进一步认识小亚基的功能,对3个脱羧酶体系的小亚基进行了氨基酸序列的对比(图 2),结果显示,在3个小亚基中存在2个相对保守的集群(cluster)片段(关键性氨基酸用加粗黑体字母标注),命名为C-terminal cluster(C-端 )和N-terminal cluster(N-端 ),3个小亚基序列中,C-端显示了高度保守性,但在N端,只有HpdC与CsdC的小亚基高度保守,而TfdC缺失这一保守片段。从对比数据中可以预测C-端,至少在TfdBC体系中,对可溶性复合物的形成具有关键性的作用,而N-端可能更多涉及氧化还原活性中心的形成。为此,实验设计了基于CsdBC大亚基的2个嵌合杂化体脱羧酶,用来验证上述推测的正确性。

|
图2 HPA脱羧酶体系3个不同来源小亚基的氨基酸序列对比 Fig. 2 The Amino acid sequence alignments of three small subunit from C. difficile, C. scatologenes and T. forsynthesis |
嵌合体杂化酶体系的物理及生化活性检测结果列于表 4。与野生型的复合物酶CsdBC相对比,当小亚基的N端被置换,C端保持不变的时候,可以获得可溶性的嵌合杂化酶CsdB-NhpdCCcsdC,其聚合状态为4聚体和8聚体的混合型,大小亚基比例为1∶1。纯化后的蛋白质溶液亦呈明显的褐色状,但测得的Fe含量值相对有些降低。以HPA为底物,利用CsdA激活酶体系进行酶活性测试后,该酶显示了一定的催化活性,但远远低于野生型复合酶。但是当小亚基的C端被置换,N端保持不变的时候,获得的嵌合杂化酶CsdB-ChpdCNcsdC绝大部分为不可溶的,少部分以可溶性的形式存在于上清液中的蛋白质经柱子后立即凝聚沉淀,因此无法进行蛋白质的纯化操作以及后续的基于纯化蛋白的活性测试实验。但在进行菌液活性测试时,该杂化酶显示了较好的活性,比CsdB-NhpdCCcsdC嵌合杂化酶的活性高出近5倍。
| 表4 嵌合杂化酶体系的理化性质检测及酶活性测试结果 Table 4 Physio-chemical properties of the chimeric hybrid enzyme system and enzyme activity test |
嵌合式杂化酶体系研究结果显示,小亚基的C端保守序列与复合酶的溶解性相关,实验获得的CsdB-ChpdCNcsdC产物仅有部分为可溶性蛋白,但经过色谱后蛋白质立即凝集沉淀,对未纯化的上清液进行活性测试,该溶液显示了较好的催化活性,尽管比野生型要低。而N端的保守序列则更趋向于调控着复合酶的催化性。这一点在野生型的TfdBC体系中更为明显,由于该体系缺少N端的保守片段,因此尽管它可以形成可溶性的蛋白质,但因为没有更高级的多聚体结构,不能形成严谨的电子传输通路,因此就不能产生催化活性。在进行酶催化活性测试中,酶分子可能会在所在的溶液中进行部分高级结构的形成,但由于生理条件等限制,很难达到最佳状态,因此即便有催化能力也只会观测到部分星号活性。
3 结论通过以上实验可以得出,小亚基的存在,不仅仅是该芳基脱羧酶体系在基因结构上区别于其他甘氨酸自由基酶体系的结构特殊性,它在整个酶体系发挥催化功能活性中起着决定性的作用,一方面它是复合酶的组成部分,决定着酶分子的溶解性及稳定性,并直接控制着酶分子的高级聚合状态;另一方面,由于其直接与参与催化反应的FeS簇相结合,从而决定着酶分子的催化活性与催化能力。进一步的实验将集中于小亚基的单点与多点突变体构建及EPR测试,同时构建以TfdB和HpdB为大亚基的其他几种嵌合杂化体酶,并进行相应的理化实验。
| [1] | 李杨.难辨梭状芽孢杆菌的感染现状-实验室检测及治疗[J].山西医药杂志,2014,43(13):1532-1534. LI Yang. The status of Clostridium difficile infection, Laboratory testing and treatment[J]. Shanxi medical journal, 2014, 43(13):1532-1534. (in Chinese)( 1) 1) |
| [2] | Muramatsuo T. Gut microflora and tissue protein turnover in vivo in animals[J]. The International Journal of Bioche-mistry, 1990, 22(8):793-800.( 1) 1) |
| [3] | Selmer T, Pierik A J, Heider J. New glycyl radical enzymes catalysing key metabolic steps in anaerobic bacteria[J]. Biological Chemistry, 2005, 386(10):981-988.( 1) 1) |
| [4] | Yu L, Blaser M, Andrei P I, et al. 4-hydroxyphenylacetate decarboxylases:properties of a novel subclass of glycyl radical enzyme systems[J]. Biochemistry, 2006, 45(31):9584-9592.( 3) 3) |
| [5] | Andrei P I, Pierik A J, Zauner S, et al. Subunit composition of the glycyl radical enzyme p-hydroxyphenylacetate decarboxylase. A small subunit, HpdC, is essential for catalytic activity[J]. European Journal of Biochemistry, 2004, 271(11):2225-2230.( 3) 3) |
| [6] | Peng Y, Veneziano S E, Gillispie G D, et al. Pyruvate formate-lyase, evidence for an open conformation favored in the presence of its activating enzyme[J]. Journal of Biological Chemistry, 2010, 285(35):27224-27231.( 1) 1) |
| [7] | Challand M R, Martins F T, Roach P L. Catalytic activity of the anaerobic tyrosine lyase required for thiamine biosynthesis in Escherichia coli[J]. The Journal of Biological Chemistry, 2010, 285(8):5240-5248.( 1) 1) |
| [8] | Buckel W, Golding B T. Radical enzymes in anaerobes[J]. Annual Review of Microbiology, 2006, 60:27-49.( 1) 1) |
| [9] | Driesener R C, Challand M R, McGlynn S E, et al.[FeFe]-hydrogenase cyanide ligands derived from S-adenosy-lmethionine-dependent cleavage of tyrosine[J]. Angewandte Chemie, 2010, 49(9):1687-1690.( 1) 1) |
| [10] | Zhang Y, Zhu X, Torelli A T, et al. Diphthamide biosynthesis requires an organic radical generated by an iron-sulphur enzyme[J]. Nature, 2010, 465(7300):891-896.( 1) 1) |
| [11] | Martins B M, Blaser M, Feliks M, et al. Structural basis for a Kolbe-type decarboxylation catalyzed by a glycyl radical enzyme[J]. Journal of the American Chemical Society, 2011, 133(37):14666-14674.( 1) 1) |
| [12] | Feliks M, Martins B M, Ullmann G M. Catalytic mechanism of the glycyl radical enzyme 4-hydroxyphenylacetate decarboxylase from continuum electrostatic and QC/MM calculations[J]. Journal of the American Chemical Society, 2013, 135(39):14574-14585.( 1) 1) |
 2016, Vol. 39
2016, Vol. 39

