2. 重庆大学 材料科学与工程学院, 重庆 400044
2. College of Materials Science and Engineering, Chongqing University, Chongqing 400044, China
骨缺损的治疗一直以来是骨科临床上的难题之一,近年来骨组织工程的迅速发展为人们解决骨缺损治疗提供了一种新的途径[1-2]。目前用作骨组织工程的支架主要有多孔生物陶瓷和聚合物。它们具有良好的生物相容性,可以促使骨组织在其孔内生长,修复骨损伤或骨缺损,极大地促进了骨组织工程的发展。但作为理想的骨组织工程支架材料,还需解决机械强度不足的问题,使其能用于承力部位[1, 3]。
镁及镁合金的比强度与比刚度高,其弹性模量约为45 GPa,接近人自然骨的弹性模量,具有极好的力学性能;镁是人体所必需的元素,在人体内正常含量为25 g,半数存在于骨骼中,具有多种特殊的生理功能和良好的生物相容性;镁具有较低的腐蚀电位,在体内可以被降解吸收;同时,镁资源丰富,价廉易得[4-7]。因此,镁合金材料作为骨组织工程支架具有诱人的应用前景。
骨组织工程包括3个基本要素:种子细胞、支架材料、信号因子。其中,支架材料作为骨组织再生的框架,是构建组织工程骨的主体,行使细胞外基质的功能,包括为组织细胞的修复活动提供适宜的微环境,抵挡来自周围组织的压力,用于承重部位暂时行使部分功能等[1]。支架材料的表面特性直接影响种子细胞的生物学特性,影响细胞的黏附、生存、迁移、增殖和代谢功能。细胞在种植材料表面的黏附作为细胞与种植材料相互作用的第一期、对于细胞后期的增殖、分化和骨基质形成以及最终形成良好的骨整合至关重要[8-9]。
笔者选择生物相容性好的有机大分子植酸对AZ31镁合金进行表面改性[10-12],采用间接接触法和直接接触法对比研究镁合金材料对成骨细胞生长增殖的影响,探讨植酸改性对镁合金表面细胞黏附性能的影响。
1 实验材料及方法 1.1 样品的制备将AZ31镁合金(购自重庆大学国家镁合金材料工程技术研究中心,其组成成分见表 1)线切割成直径为10 mm,厚度为5 mm的小圆盘,先后经过1 000#碳化硅砂纸打磨,抛光,丙酮中超声清洗30 min,去离子水清洗后,再用环氧乙烷消毒后干燥封存待用。
| 表 1 AZ31镁合金基体材料主要化学组成(质量分数) |
将制备好的样品置于10 mg/mL、pH为5的植酸溶液中浸泡10 min。取出样品先后用去离子水和无水乙醇清洗,再用环氧乙烷消毒后干燥封存待进一步检测或使用。实验所用植酸溶液由2.0 g的植酸(含量不低于50%,成都市科龙化工试剂厂)溶于适量的去离子水,用NaOH水溶液调节pH值到5,最终配成100 mL溶液。
用携带能谱仪(Thermo电子公司)的扫描电子显微镜(S-3400N,日本日立)对植酸改性前后的镁合金进行形貌观察和表面化学组成分析。
1.3 体外细胞实验 1.3.1 细胞体外培养在含10%胎牛血清(Gibco,USA)、1%双抗(10 000 U/mL青霉素和10 000 mg/mL链霉素)的DMEM培养基(HyClone,赛默飞世尔生物化学制品北京有限公司)中培养人骨肉瘤细胞MG-63细胞(中国科学院上海生科院细胞资源中心)。
1.3.2 间接法检测材料对细胞生长增殖的影响将植酸改性前后的AZ31镁合金样品以3 cm2/mL分别浸入DMEM培养基中,置于37 ℃的培养箱24 h获取提取液。实验分为3组:正常对照组、AZ31镁合金组、植酸改性AZ31镁合金组,每组设6个复孔,取生长融合后的细胞,用浸提液配成2.0×105/mL的细胞悬液,种植于96孔板,每孔100 μL,24 h后更换新的浸提液,正常对照组在DMEM培养基中培养。再孵育24 h后加入10 μL MTT溶液继续培养4 h,移去培养基后加入100 μL二甲基亚砜振荡10 min,于570 nm处比色测定各孔吸光值。材料浸提液对细胞存活率影响的评价方法参照GB/T16175—2008中对细胞毒性的评价[13-14]。细胞相对存活率的计算:各组浸提液培养细胞后用MTT法测得的A值,按下面公式计算出细胞相对存活率。
| $ 细胞相对存活率(\% ) = \frac{{实验组A平均值}}{{对照组A平均值}} \times 100\% $ |
实验分为2组:AZ31镁合金组、植酸改性AZ31镁合金组,每组设4个复孔。取生长融合后的细胞,以1.0×108 L-1浓度接种于植酸改性前、后的圆片状AZ31镁合金表面,置于24孔培养板内,在37 ℃、体积分数为5%的CO2培养箱内培养。接种细胞后培养48 h,随机取每组的3孔,用0.25%胰蛋白酶消化2 min,取出金属材料,再加入DMEM培养液200 μL,以1×105/mL的密度接种至96孔培养板,每组10孔,之后与间接法一样的步骤和条件测定各孔的吸光值。随机剩余的一空,用4%的多聚甲醛固定镁合金材料表面的细胞(20 min),用PBS(0.01mol/L,pH 7.4) 洗涤3次,2%正常羊血清室温封闭30 min,然后与α-Tubulin一抗(1:200;购自Santa Cruz公司,货号sc-5546) 4 ℃孵育过夜。PBS洗涤3次后,加入1:600稀释的羊抗兔二抗AlexaFluor 568室温孵育1 h,PBS洗涤后用Dapi复染细胞核,最后在奥林巴斯显微镜下观察、照相。
2 结果及讨论 2.1 AZ31镁合金表面植酸改性AZ31镁合金经过植酸处理前后的表面显微形貌及表面元素组成如图 1所示。经过植酸处理后,在AZ31镁合金的表面形成了一层有小裂纹的均匀涂层(图 1(a)),处理后的表面主要由元素Mg、Al、Zn、O、P和C组成(图 1(b))。与改性前的AZ31镁合金相比(图 1(c)和图 1(d)),表面形貌发生了明显的改变,组成元素在基体组成元素Mg、Al、Zn的基础上,增加了植酸分子的特征元素O、C和P[6],3种元素信号同时存在于AZ31镁合金的表面,表明了植酸涂层的形成。
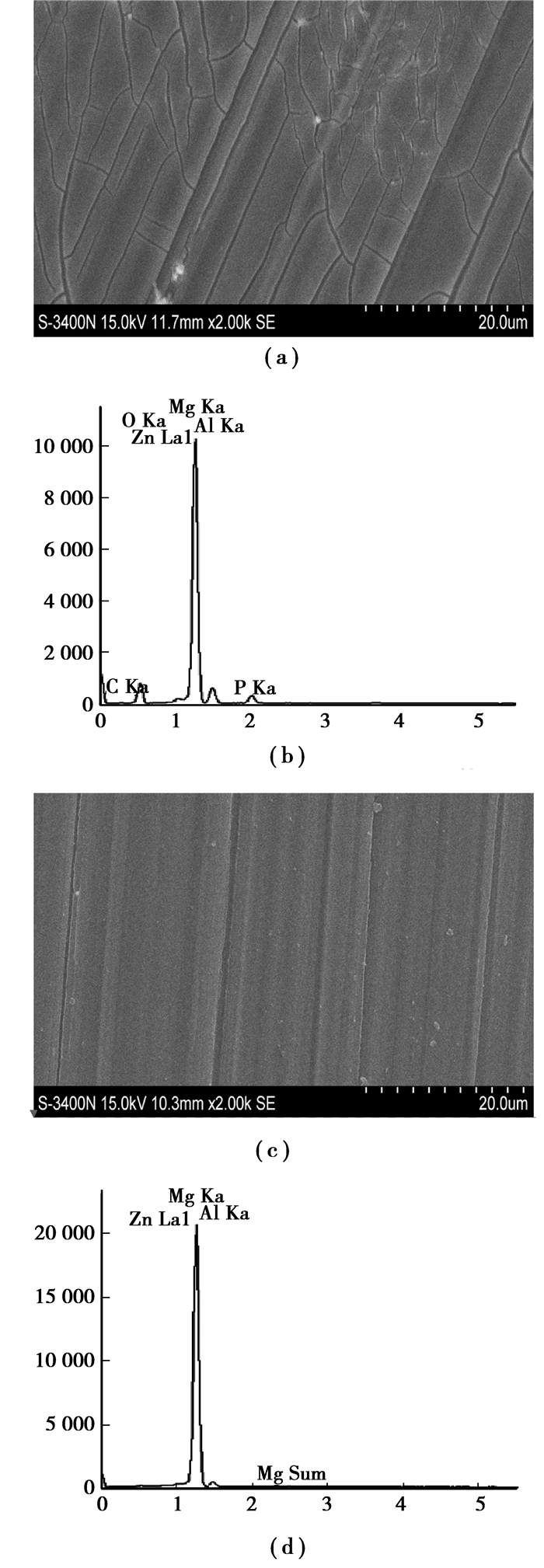
|
图 1 植酸改性前((a)和(b))后((c)和(d))的表面形貌((a)和(c))和元素组成((b)和(d)) |
植酸处理前后的AZ31镁合金提取液培养成骨细胞后的MTT测试结果如表 2所示。实验结果表明,在DMEM培养基中培养的正常对照组吸光度值为0.24,明显大于AZ31镁合金试样的吸光度值(0.10) 和植酸处理后的AZ31镁合金试样(0.11),植酸处理前后AZ31镁合金的吸光度值没有显著差异。以正常对照组为比较标准,得到未处理AZ31镁合金样品浸提液中细胞存活率为41.7%,植酸处理后样品浸提液中细胞存活率为45.8%,两者无显著差异,根据GB/T16175—2008,样品浸提液中细胞存活率均小于50%,细胞毒性均大于二级。实验同时还表明,植酸改性对AZ31镁合金的抗腐蚀性能影响不大,动电位极化实验得到相近的自腐蚀电位和腐蚀电流(在此不再赘述),在细胞培养液中的降解较快,在细胞培养液中浸提24h后,浸提液的pH值均已超过8,形成的碱性环境不利于细胞的生长,体现出细胞毒性。
| 表 2 材料浸提液对成骨细胞生长增殖的影响 |
体外直接接触细胞毒性实验结果如图 2所示。α-Tubulin免疫荧光染色及Dapi染色结果表明,接种到金属材料表面并经培育和多聚甲醛固定的细胞,在植酸改性前后的AZ31镁合金表面都可附着并生长,细胞形态无明显差别。但细胞在改性前的AZ31镁合金表面的存活量(对照组,(a)(b)(c)),明显低于改性后的AZ31镁合金表面的存活量(改性后,(d)(e)(f))。细胞接种到金属材料表面,经培育和洗脱后的MTT测试结果同时也表明,细胞在改性前的AZ31镁合金表面的存活量(对照组,改性前),低于改性后的AZ31镁合金表面的存活量(改性后),存在显著差异。
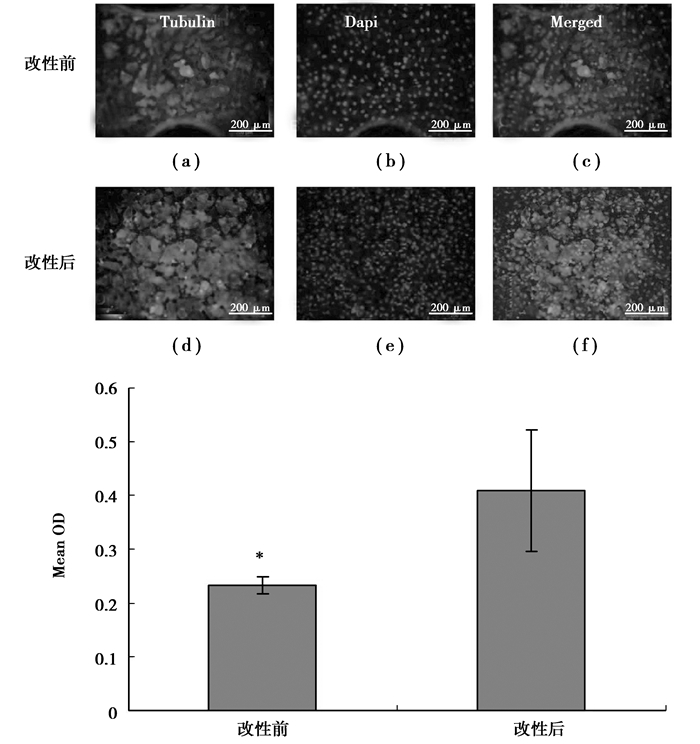
|
图 2 植酸改性前后AZ31镁合金在直接接触法中对MG-63细胞生长、繁殖的影响 |
体外培养的MG-63细胞属于贴壁生长的细胞,接种的MG-63成骨细胞未黏附前,悬浮于培养基中收缩呈球形,没有任何的生理功能,若不能及时进行黏附,将失去生存能力。成骨细胞需与材料如培养板壁、镁合金材料片等及时发生适当的黏附后才能发挥生长、增殖和分化等生理功能[15-16]。因此成骨细胞的早期黏附将影响接下来的成骨细胞分化、生长及成熟,影响最终的矿化过程及骨整合界面的形成。AZ31镁合金在植酸改性前后的浸提液对贴壁成骨细胞毒性相近,无明显差异,而直接接触培养却体现出细胞在不同表面上存活率的明显差异,这充分表明植酸改性前后的AZ31镁合金具有不同的表面特性,对MG-63细胞的黏附性能存在明显的差异,植酸改性后的AZ31镁合金更有利于MG-63细胞的黏附。
生理情况下,成骨细胞以特异性受体(整合素)识别细胞外基质蛋白而发生黏附。整合素由α和β两个亚基组成的跨膜糖蛋白受体,可以通过识别细胞外基质蛋白所含的细胞黏附序列[9]。早期的研究表明,AZ系镁合金植酸改性后在表面形成植酸转化膜,转化膜具有多个磷酸残基结构[12, 17],这些磷酸残基结构是否能诱导和促进细胞整合素的表达水平,以及植酸改性AZ31镁合金促进MG-63细胞黏附的机理,尚需进一步的研究。
3 结语采用浸没法通过植酸改性可以在AZ31镁合金表面形成植酸涂层,植酸改性涂层对AZ31镁合金的抗腐蚀降解性能影响不大,镁合金腐蚀降解快,导致碱性环境不利于细胞生长;但植酸改性后的镁合金表面具有与镁合金不同的表面特性,能显著改善细胞的黏附性能。植酸改性可以为生物医用金属材料改善表面细胞黏附性能提供一种有益的技术借鉴。
| [1] |
王韵晴, 卢婷利, 赵雯, 等.
骨组织工程支架材料的研究进展[J]. 材料导报:A, 2011, 25(2): 125–131.
WANG Yunqing, LU Tingli, ZHAO Wen, et al. Research progress of scaffold materials in bone tissue engineering[J]. Materials Review:A, 2011, 25(2): 125–131. (in Chinese) |
| [2] |
刘顺振, 侯玉东.
骨组织工程支架材料的研究进展及临床运用[J]. 中国组织工程研究与临床康复, 2011, 15(42): 7911–7914.
LIU Shunzhen, HOU Yudong. Research advancement and clinical application of bone tissue engineering scaffold materials[J]. Journal of Clinical Rehabilitative Tissue Engineering, 2011, 15(42): 7911–7914. DOI:10.3969/j.issn.1673-8225.2011.42.029 (in Chinese) |
| [3] |
俞猛.
骨组织工程支架材料修复骨缺损的特性[J]. 中国组织工程研究与临床康复, 2010, 14(47): 8869–8872.
YU Meng. Characteristics of bone tissue engineering scaffold materials for repair of bone defects[J]. Journal of Clinical Rehabilitative Tissue Engineering Research, 2010, 14(47): 8869–8872. DOI:10.3969/j.issn.1673-8225.2010.47.032 (in Chinese) |
| [4] | XIN Y, HU T, CHU P K. In vitro studies of biomedical magnesium alloys in a simulated physiological environment:A review[J]. Acta Biomaterialia, 2011, 7(4): 1452–1459. DOI:10.1016/j.actbio.2010.12.004 |
| [5] |
于琨, 陈良建, 雷路, 等.
镁合金作为生物医用植入材料的研究进展[J]. 金属功能材料, 2009, 16(4): 61–64.
YU Kun, CHEN Liangjian, LEI Lu, et al. Research on magnesium alloy as medical implant material[J]. Metallic Functional Materials, 2009, 16(4): 61–64. (in Chinese) |
| [6] | WITTE F, HORT N, VOGT C, et al. Degradable biomaterials based on magnesium corrosion[J]. Current Opinion in Solid State and Materials Science, 2008, 12(5/6): 63–72. |
| [7] | ZHANG S X, ZHANG X N, ZHAO C L, et al. Research on an Mg-Zn alloy as a degradable biomaterial[J]. Acta Biomaterialia, 2010, 6(2): 626–640. DOI:10.1016/j.actbio.2009.06.028 |
| [8] | ANSELME K. Osteoblast adhesion on biomaterials[J]. Biomaterials, 2000, 21(7): 667–681. DOI:10.1016/S0142-9612(99)00242-2 |
| [9] | ZHANG Y, TAO H R, HE Y H, et al. Effect of Mg-Zn alloy on integrin alpha-5 expression of osteoblasts[J]. Journal of Medical Forum, 2010, 31(10): 1–4. |
| [10] | TORRES J, DOMINGUEZ S, CERDA M F Solution behaviour of myo-inositol hexakisphosphate in the presence of multivalent cations. Prediction of a neutral pentamagnesium species under cytosolic/nuclear conditions[J]. Journal of Inorganic Biochemistry, 2005, 99(3): 828–840. DOI:10.1016/j.jinorgbio.2004.12.011 |
| [11] | CREA F, STEFANO C D, MILEA D, et al. Formation and stability of phytate complexes in solution[J]. Coordination Chemistry Reviews, 2008, 252(10/11): 1108–1120. |
| [12] | PAN F S, YANG X, ZHANG D F. Chemical nature of phytic acid conversion coating on AZ61 magnesium alloy[J]. Applied Surface Science, 2009, 255(20): 8363–8371. DOI:10.1016/j.apsusc.2009.05.089 |
| [13] |
李琦, 刘新杰, 王泽庆, 等.
AZ31B镁合金表面氟涂层的生物相容性和抗菌性能[J]. 材料研究学报, 2011, 25(2): 193–197.
LI Qi, LIU Xinjie, WANG Zeqing, et al. Biocompatibility and antibacterial property of a fluoride coating on AZ31B magnesium alloy[J]. Chinese Journal of Materials Research, 2011, 25(2): 193–197. (in Chinese) |
| [14] |
郭磊, 刘魁, 高晓宇, 等.
磷酸钙涂层的AZ31B镁合金材料对骨细胞功能的影响[J]. 中国现代医学杂志, 2009, 19(2): 161–163.
GUO Lei, LIU Kui, GAO Xiaoyu, et al. Effect of magnesium alloy AZ31B coating with calcium phosphate on cell function of osteoblasts[J]. China Journal of Modern Medicine, 2009, 19(2): 161–163. (in Chinese) |
| [15] | ZREIQAT H, HOWLETT C R, ZANNETTINO A, et al. Mechanisms of magnesium-stimulated adhesion of osteoblastic cells to commonly used orthopaedic implants[J]. Journal of Biomedical Materials Research, 2002, 62(2): 175–184. DOI:10.1002/(ISSN)1097-4636 |
| [16] | ANSELME K. Osteoblast adhesion on biomaterials[J]. Biomaterials, 2000, 21(7): 667–681. DOI:10.1016/S0142-9612(99)00242-2 |
| [17] | GUPTA R K, DARKWA K M, KUMAR D. Effect of post heat treatment on corrosion resistance of phytic acid conversion coated magnesium[J]. Journal of Materials Science & Technology, 2013, 29(2): 180–186. |
 2013, Vol. 36
2013, Vol. 36

