随着城市化进程的加快,大量工业拆迁场地改为商住或绿化用地,其中一些存在场地污染问题,在开发利用之前需要进行修复。对于被重金属铬污染场地,主要的土壤修复技术有:化学固定法、化学还原法、清洗法、生物修复法、电动修复法等[1]。电动修复技术中,起主导作用的是电迁移作用,电渗析和电泳的作用通常可以忽略[2-3]。
在土壤电动修复的阳极室和阴极室通常分别发生如下水电解反应。
| $ {\rm{阳极}}:2{{\rm{H}}_2}{\rm{O}} - 4{{\rm{e}}^ - } \to {{\rm{O}}_2} \uparrow + 4{{\rm{H}}^ + }\;\;\;\;{E_0} = 1.229。$ | (1) |
| $ {\rm{阴极}}:2{{\rm{H}}_2}{\rm{O}} + 2{{\rm{e}}^ - } \to {{\rm{H}}_2} \uparrow + 2{\rm{O}}{{\rm{H}}^ - }\;\;\;\;{E_0} = - 0.828。$ | (2) |
由于大部分重金属的氢氧化物不溶于水或溶解度非常低,因此,阴极室的电解液通常用酸中和或采用阳离子交换膜阻止OH-进入土壤[4]。而H+离子被认为可以促进土壤中的重金属溶解进入水中,从而提高修复效率,因此,阳极室的工作液一般不加中和[3-5]。为进一步提高重金属在水中的溶解度,不同的酸和络合剂,如:EDTA等被加入工作液中[6]。
此外,不同形式的电极排布形式、电源形式和通电方式也在各种规模的测试实验中被加以应用[7-15],证明了电动修复技术可以有效地去除土壤中的重金属。然而,美国1982—2005年期间实施的462个国家优先名录(National Priorities List)污染场地修复中,只有一个场地采用了电动修复技术[16],其主要原因之一是其电流效率低,导致处理费用比淋洗等技术高,本研究的中心目的就是针对铬(VI)污染土壤,尝试寻找一种电流效率较高的电动修复技术;其次利用CrO42-离子易溶于水的特性,进一步验证预浸泡处理对降低铬污染土壤整体修复费用的可能性。
1 材料和方法 1.1 实验材料及装置实验土样的制备和装置与参考文献[17]相同。用粘土和高锰酸钾混合后配制成总铬(TCr)理论质量分数为2 000 mg/kg的实验土样,实验前后检测的含水率分别为19.1%和20.9%,土样湿重2 865 g。
实验装置如图 1所示,装置中间为受试土壤,长×宽×高=20 cm×10 cm×8 cm。阴、阳两极室的工作液体积=17 cm×10 cm×8 cm=1 360 mL,极室与土壤之间采用中性滤纸隔开。进行电动修复实验时,阴极极板为铜片,工作液为0.5 mo/L的CuSO4溶液;阳极为8只打磨光亮的大铁钉,工作液为0.1 mol/L的KCl溶液。电源采用DYB-1型电泳仪(上海博通)的电源,电流(VICTOR 86D数字多用表)串联在线路中实施在线监测。温度计采用水银温度计分别插入两端的土壤中,距两电极室3 cm。

|
图 1 实验装置示意图 |
实验步骤同文献[17]分3步进行。1)实验准备:将实验土样分成5块4 cm厚的泥块,在每块的断面上按3×3的方式均匀布设9个检测点,满足统计分析对样本数量的要求,6个断面(从阳极到阴极依次编号①~⑥)共54个检测点,使用Inno-X Alpha4000分析仪对各点的TCr质量浓度进行无损检测,检测后将泥块放回反应器进行下一步实验。2)浸泡实验:将蒸馏水注入两极室,水面与土壤基本齐平但不漫过土壤,定时从2个极室中取水样分析水中TCr质量分数,当浸泡液中TCr质量分数基本不再随浸泡时间上升或上升缓慢时,说明本次浸泡除铬的效果已经达到最大,更换新的蒸馏水进行下一轮浸泡,如此反复进行7轮至TCr的浸出速率已非常缓慢(图 2、3),停止浸泡并自然风干一天,之后再对54个检测点进行无损检测,得到各断面浸泡后TCr质量分数的变化情况。3)电动修复实验:将浸泡后的土壤放回原位,阴、阳两极室的工作液换为电解质溶液,水量与浸泡实验的蒸馏水量相同,定期检测和记录工作溶液的pH值、土壤温度、电流强度和电压。实验中采用的电压梯度为1.15~11.5 V/cm,电压不可过高,否则阳极铁电极上可能发生水电解反应,产生气泡[18]。电压表只在测量时联入电路,避免电压表的分流。在电动修复实验进行到85.4 h和203 h时(此时的通电量分别与文献[17]中24 h和72 h的相等),对54个检测点进行无损检测。电动修复实验中,每隔8 h更换一次电极工作液,同时对电极进行清洗。电动修复中在阳极室可以看到Fe2(CrO4)3沉淀生成。阴极可以看到铜在阴极铜片上析出,实验中要及时补充CuSO4,以防Cu2+过低导致水的电解。
1.3 分析方法1) 工作液:TCr,高锰酸钾氧化+二苯碳酰二肼分光光度法GB/T 15555.5—1995;pH值,PB-10酸度计。
2) 土壤:TCr,X射线荧光分析仪(Inno-X Alpha4000, Inno-X system Inc. Woburn, MA. USA),监测时间30 s[17, 19-21];土壤温度,水银温度计;电压,VICTOR 890D多功能表;电流,VICTOR 86D万用表。
2 结果与讨论 2.1 浸泡实验7轮浸泡实验结果见图 2、3。从图中可以看出,TCr浸出质量浓度曲线斜率随浸泡次数而下降并达到一个稳定值。阳极室的TCr在第7轮浸泡中异常升高,是由于隔断滤纸因长期浸泡发生轻微松弛,少量土壤松垮进入阳极室,导致溶液TCr升高,修复后质量浓度未再显著上升。
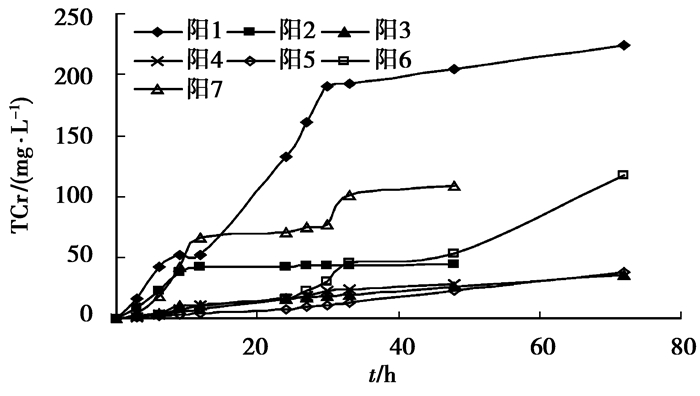
|
图 2 阳极室溶液中总铬质量浓度 |
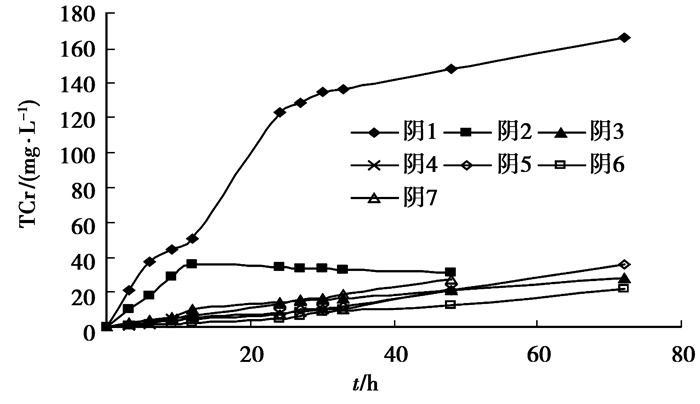
|
图 3 阴极室溶液中总铬质量浓度 |
土样各断面TCr质量分数检测结果见表 1。从表 1中可以看出,经过7轮浸泡后土壤中的TCr去除率达到45%,与文献[17]中6轮浸泡后TCr47%的去除率结果一致,说明预浸泡可以有效地去除土壤中的TCr,但过多增加浸泡次数并不能进一步提高TCr的去除率。中间几个断面的TCr去除率也达到30%以上,说明浸泡对10 cm深度的土壤TCr去除依然有显著效果。
| 表 1 实验中土壤各断面总铬质量分数变化情况 |
以浸泡前TCr质量浓度为基准,从表 1中可以看出,浸泡85.4 h和203 h电动修复处理后TCr的去除率分别为45%、67%和84%,浸泡的贡献率超过了电动修复,因此,对于TCr高的污染土壤,在进行电动修复前有必要考虑先进行浸泡处理。
2.2 电动修复实验
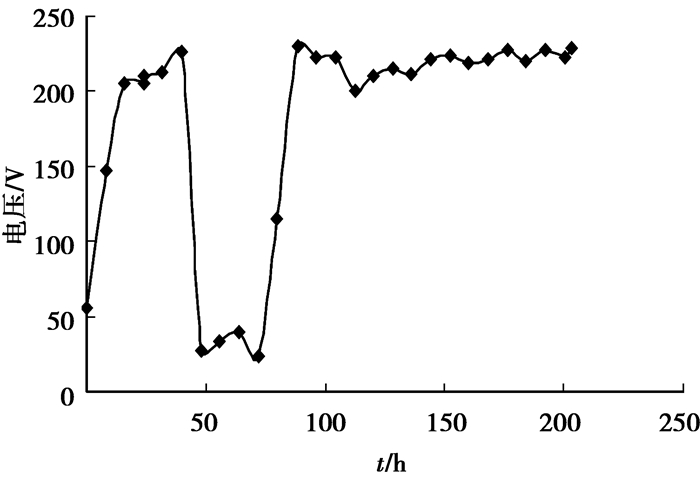
|
图 4 土壤两端电压变化情况 |
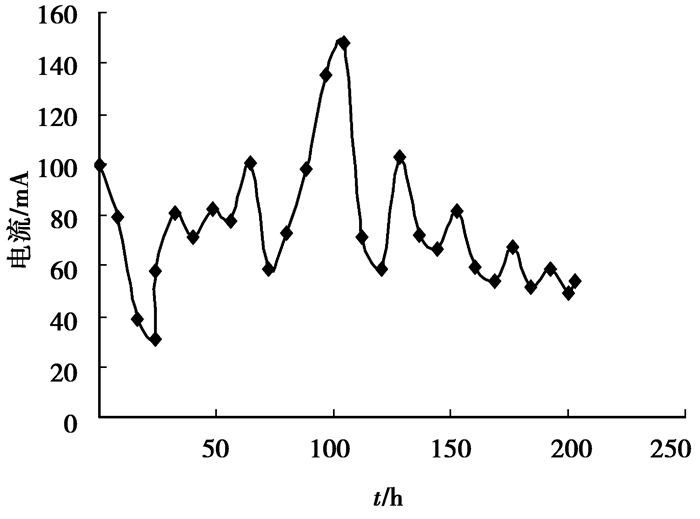
|
图 5 土壤电流变化情况 |
本实验中阳极采用铁电极[18],发生的反应为式(3),不再是式(1):
| $ {\rm{阳极}}:{\rm{Fe}} - 2{{\rm{e}}^ - } \to {\rm{F}}{{\rm{e}}^{2 + }},\;{E_0} = - 0.44。$ | (3) |
实验中可以观察到从土壤中迁移出来进入阳极室的CrO42-离子将Fe2+离子氧化成Fe3+离子以及棕色沉淀物的生成。该棕色沉淀为Fe2(CrO4)3、Cr(OH)3和CrxFe1-x(OH)3的混合物[23-24]。在工程应用中,本方法产生的沉淀污泥铁和铬的纯度较高,可以作为炼钢原料直接回用。
阴极采用铜电极,而工作液为CuSO4溶液,在阴极上发生还原反应为式(4),不再是式(2)。
| $ {\rm{阴极}}:{\rm{C}}{{\rm{u}}^{{\rm{2 + }}}} + 2{{\rm{e}}^ - } \to {\rm{Cu}} \downarrow ,\;{E_0} = 0.34。$ | (4) |
SO42-离子在土壤颗粒表面与CrO42-离子形成竞争吸附,SO42-离子的进入会促进CrO42-离子从土壤颗粒表面解吸,以提高修复效率[24]。
在工程应用中,阴极工作液可采用电子废物回收等行业产生的CuSO4废溶液,在修复污染土壤的同时回收金属铜,以废治废,降低修复成本。
图 6显示阳极池和阴极池的pH值在整个电动修复过程中基本维持不变,表明抑制水电解的目的得以实现。
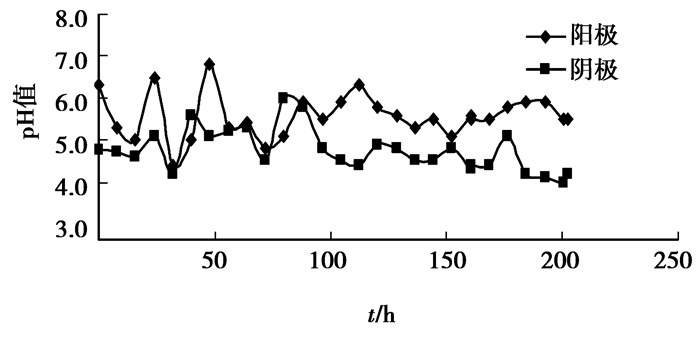
|
图 6 阴极池和阳极池pH变化情况 |
实验中流经土壤的电流由溶解在土壤含水中的带电离子在电场作用下定向移动构成。由于土壤中含有多种带电离子,因此,其电流为所有带电离子定向运动的总合,即:
| $ I = \sum\limits_i {{k_{\rm{i}}} \cdot {z_{\rm{i}}} \cdot {C_{\rm{i}}} \cdot {\mu _{\rm{i}}} \cdot E \cdot S} 。$ | (5) |
式中:I为电流强度,A;i为溶解在土壤含水中的各种带电离子;ki为系数,是离子在土壤溶液中的淌度与μi的比值;zi为离子所带电荷数,equiv;Ci为离子浓度,mol/L;μi为离子在无限稀水溶液中的当量电导率,m2·S·equiv-1[25];E为土壤两端的电压,V;S为土壤断面面积,m2。
从式(5)可以看出,在构成土壤电流的带电离子中,CrO42-只是其中的一部分,所占比例(电迁移数λ)为:
| $ \lambda = \frac{{{k_1} \cdot 2 \cdot {C_1} \cdot {\mu _1}}}{{\sum\limits_i {{k_{\rm{i}}} \cdot {z_{\rm{i}}} \cdot {C_{\rm{i}}} \cdot {\mu _{\rm{i}}}} }}。$ | (6) |
式中:μ1为CrO42-离子在无限稀水溶液中的电导率,m2·S·equiv-1[25];k1为系数,是CrO42-离子土壤溶液中的淌度与μ1的比值;C1为CrO42-浓度,mol/L。
表 1数据显示,与文献[17]中水电解反应相比,无水电解发生时CrO42-的电迁移数是前者的1.7倍,导致在消耗相同电量下,无水电解电动修复的TCr去除率提高了34.6%(23 043.63 C)和58.1%(57 139.5 C)。这由于当阳极室发生水电解反应,产生的H+离子在电场和浓度梯度双重作用下迁移进土壤,使土壤pH值下降,这虽可以促进Pb2+、Cu2+等阳离子由土壤转入水中,提高去除率,但对铬(VI)污染土壤的情况却不同。铬(VI)以CrO42-形式存在,土壤酸化带来唯一正面影响是:部分土壤颗粒可能在酸作用下溶解,从而导致吸附在其表面的CrO42-离子因失去吸附载体而溶入水中。但其负面影响却有4项:1)由于H+离子淌度远大于其他离子(见表 2),H+离子在土壤中浓度的增加会导致式(6)中的分母增大,降低CrO42-的电迁移数,电动修复的电流效率下降;2)土壤酸化导致的部分土壤溶解增加土壤中其他可移动离子(如:Ca2+、Mg2+、Al3+等)的供应量,导致式(6)中的分母增大,降低CrO42-的电迁移数[22];3)土壤pH值的下降会降低CrO42-离子从土壤颗粒表面解吸的能力[24];4)CrO42-离子在酸性还原条件下易被土壤中的还原性物质还原成Cr3+离子[24],而Cr3+离子的电迁移方向正好与CrO42-离子相反。阴极室水电解产生的OH-离子虽不会与CrO42-离子反应产生沉淀物,但其在水中的淌度也仍远大于SO42-、Cl-、NO3-等阴离子(见表 2),OH-离子进入土壤同样可能降低阴极端CrO42-的电迁移数及电流效率。但OH-离子也可能与阴极端土壤水中浓度较高的Fe2+/3+、Mn2+、Mg2+、Ca2+等阳离子反应生成氢氧化物沉淀,降低了土壤水中导电离子的数量,导致式(6)的分母变小,阴极端CrO42-的电迁移数升高,所以OH-离子的影响是双向不确定的。
本实验中无水电解发生时CrO42-离子电迁移数是有水电解时的1.7倍表明H+离子进入土壤带来的负面影响大于正面,因此,以低淌度离子替代高淌度H+离子和OH-离子进入土壤可以提高CrO42-离子的电迁移数。
| 表 2 部分离子在无限稀水溶液中的电导率[25] |
图 7显示,电动修复过程中阳极端土壤的温度高于阴极端,与文献[17]中阳极端土壤温度低于阴极端的情况正好相反。这是由于阳极端土壤和阴极端土壤属于串联关系,二者电流相等,因此,两端土壤温度(电功率)的高低关系间接反映了其电阻或电压降的大小。本实验中Fe2+离子替代H+离子进入阳极端土壤,SO42-离子替代OH-离子进入阴极端土壤。因Fe2+离子的淌度小于SO42-离子(表 2),这就导致了阳极端的土壤电阻大于阴极端。而文献[17]中,H+离子淌度大于OH-离子(表 2),而且H+离子还会导致阳极端土壤中部分氧化物溶解,增加土壤水中导电离子的浓度,进一步降低阳极端土壤电阻;相反地,如果土壤水中Fe2+/3+、Mn2+、Mg2+、Ca2+等阳离子浓度较高,OH-离子还可能与其在阴极端土壤中反应生成氢氧化物沉淀,降低了阴极端土壤水中导电离子的数量,导致了阴极端土壤电阻进一步升高,形成阴极端土壤温度高于阳极端土壤温度的情况,这最终导致了在有H+离子和OH-离子进入土壤的情形中,阳极端土壤温度低于阴极端。考虑到Fe2+离子与SO42-离子的淌度仅差26.2×10-4 m2·S·equiv-1(25 ℃)即引起了这么明显的宏观差异,而H+离子的淌度是Fe2+离子的6.5倍(25 ℃)(表 2),以Fe2+离子替代H+离子进入土壤导致CrO42-离子迁移数显著提高的宏观表现也就不奇怪了,这从另一个角度印证了表 1中的结论。
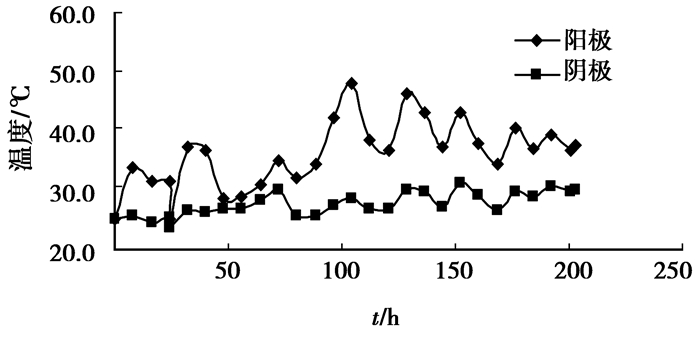
|
图 7 温度变化情况 |
1) 对于TCr质量分数高达2 312 mg/kg左右的铬污染土壤,电动修复前的浸泡可以有效地降低土壤中TCr,工程应用可以考虑预浸泡环节以降低总体修复费用;
2) 通过采用铁阳极和CuSO4阴极工作液,抑制水的电解,使Fe2+离子和SO42-离子分别替代H+离子和OH-离子进入土壤,可以提高铬(VI)的电迁移数,提高铬污染土壤电动修复的电流效率。
| [1] | EPA. Engineering bulletin:technology alternatives for the remediation of soils contaminated with As, Cd, Cr, Hg, and Pb[M]. Washington D C: United States Environmental Protection Agency, 1997. |
| [2] | Probstein R F, Hicks R E. Removal of contaminates from soils by electric fields[J]. Science, 1993, 260(5107): 498–503. DOI:10.1126/science.260.5107.498 |
| [3] | Buchireddy P R, Bricka R M, Gent D B. Electrokinetic remediation of wood preservative contaminated soil containing copper, chromium, and arsenic[J]. Journal of Hazardous Materials, 2009, 162(1): 490–497. DOI:10.1016/j.jhazmat.2008.05.092 |
| [4] | Li Z M, Yu J W, Neretnieks I. Electroremediation:removal of heavy metals from soil by using cation selective membrane[J]. Environmental Science & Technology, 1998, 32(3): 394–397. |
| [5] | Rojo A, Cubillos L. Electrodialytic remediation of copper mine tailings using bipolar electrodes[J]. Journal of Hazardous Materials, 2009, 168(2/3): 1177–1183. |
| [6] | Wong J S H, Hicks R E, Probstein R F. EDTA-enhanced electroremediation of metal-contaminated soils[J]. Journal of Hazardous Materials, 1997, 55(1/2/3): 61–79. |
| [7] | Ottosen L M, Lepkova K, Kubal M. Comparison of electrodialytic removal of Cu from spiked kaolinite, spiked soil and industrially polluted soil[J]. Journal of Hazardous Materials, 2006, 137(1): 113–120. DOI:10.1016/j.jhazmat.2005.04.044 |
| [8] | Pazos M, Sanromán M A, Cameselle C. Improvement in electrokinetic remediation of heavy metal spiked kaolin with the polarity exchange technique[J]. Chemosphere, 2006, 62(5): 817–822. DOI:10.1016/j.chemosphere.2005.04.071 |
| [9] | Wang C H, Lin Y T, Lin T Y, et al. Enhancement of electrokinetic remediation of hyper-Cr(VI) contaminated clay by zero-valent iron[J]. Journal of Hazardous Materials, 2007, 149(2): 292–302. DOI:10.1016/j.jhazmat.2007.03.076 |
| [10] | Shen Z M, Chen X J, Jia J P, et al. Comparison of electrokinetic soil remediation methods using one fixed anode and approaching anodes[J]. Environmental Pollution, 2007, 150(2): 193–199. DOI:10.1016/j.envpol.2007.02.004 |
| [11] | Hansen H K, Rojo A. Testing pulsed electric fields in electroremediation of copper mine tailings[J]. Electrochimica Acta, 2007, 52(10): 3399–3405. DOI:10.1016/j.electacta.2006.07.064 |
| [12] | Ribeiro A B, Rodríquez-Maroto J M, Mateus E P, et al. Modeling of electrodialytic and dialytic removal of Cr, Cu and As from CCA-treated wood chips[J]. Chemosphere, 2007, 66(9): 1716–1726. DOI:10.1016/j.chemosphere.2006.07.014 |
| [13] | Kim G N, Jung Y H, Lee J J, et al. An analysis of a flushing effect on the electrokinetic-flushing removal of cobalt and cesium from a soil around decommissioning site[J]. Separation and Purification Technology, 2008, 63(1): 116–121. DOI:10.1016/j.seppur.2008.04.006 |
| [14] | Yuan S H, Zheng Z H, Chen J, et al. Use of solar cell in electrokinetic remediation of cadmium-contaminated soil[J]. Journal of Hazardous Materials, 2009, 162(2/3): 1583–1587. |
| [15] | Yuan S H, Wu C, Wan J Z, et al. In situ removal of copper from sediments by a galvanic cell[J]. Journal of Environmental Management, 2009, 90(1): 421–427. DOI:10.1016/j.jenvman.2007.10.009 |
| [16] | United States Environmental Protection Agency. Treatment technologies for site cleanup:annual status report, twelfth edition[R]. Washington, D C:EPA, 2007. |
| [17] |
李东, 黄彦, 聂杨, 等.
高浓度铬污染土壤水浸泡与电动修复联合处理实验[J]. 环境工程学报, 2010, 4(11): 2579–2584.
LI Dong, HUANG Yan, NIE Yang, et al. Water dipping and electrokinetic jointed remediation of a heavily chromium-contaminated soil[J]. Techniques and Equipment for Environmental Pollution Control, 2010, 4(11): 2579–2584. (in Chinese) |
| [18] | Haran B S, Popov B N, Zheng G H, et al. Mathematical modeling of hexavalent chromium decontamination from low surface charged soils[J]. Journal of Hazardous Materials, 1997, 55(1/2/3): 93–107. |
| [19] | OSWER Directive. Representative sampling guidance[R]. Washington, D C:EPA, 1995. |
| [20] | Elless M P, Bray C A, Blaylock M J. Chemical behavior of residential lead in urban yards in the United States[J]. Environmental Pollution, 2007, 148(1): 291–300. DOI:10.1016/j.envpol.2006.10.024 |
| [21] | Block C N, Shibata T, Solo-Gabriele H M, et al. Use of handheld X-ray fluorescence spectrometry units for identification of arsenic in treated wood[J]. Environmental Pollution, 2007, 148(2): 627–633. DOI:10.1016/j.envpol.2006.11.013 |
| [22] | West L J, Stewart D I, Binley A M, et al. Resistivity imaging of soil during electrokinetic transport[J]. Engineering Geology, 1999, 53(2): 205–215. DOI:10.1016/S0013-7952(99)00034-4 |
| [23] | Lide D R. CRC handbook of chemistry and physics[M]. 85th ed.[S.l.]:CRC Press, 2004. |
| [24] | US EPA. In situ treatment of soil and groundwater contaminated with chromium[R]. Washington, D C:EPA, 2000. |
| [25] | Dean J A. Lange's handbook of chemistry[M]. 15th ed.[S.l.]:McGraw-Hill. |
 2013, Vol. 36
2013, Vol. 36


