针对微型动力装置内CH4难以着火的现状[1-3],不少学者提出掺入少量H2可以降低CH4的着火温度并实现其稳定燃烧[4-5]。相比于CH4,H2的价格过于昂贵,直接往CH4/空气混合燃气中掺入H2显然不太经济。但H2本身可以通过CH4的重整或裂解反应得到,将产生的H2混入后续燃烧的燃气可以改善微型动力装置内的燃烧特性。目前通过CH4的催化反应制取H2主要有以下几种方法[6]:CH4/H2O重整、CH4/CO2重整、CH4高温裂解、CH4自热重整以及CH4的部分氧化。前3种方法均为强吸热反应,需要较高的温度条件;CH4/O2/H2O自热重整是CH4部分氧化和CH4/H2O重整的耦合,CH4部分氧化是弱放热反应,与重整反应相耦合可以降低重整反应的外部供热需求。相比较而言,CH4部分氧化制氢最适合于微型动力装置,因为其反应起始温度最低、反应速率也较快,而且反应放热对后续燃料的燃烧也能起到促进作用。
CH4的催化部分氧化涉及CH4、O2、H2O、CO2、H2、CO间的相互反应,该过程十分复杂,在较早的研究中,对CH4的催化部分氧化有2种截然不同的观点:Vernon等[7]在试验中监测到温度最高点出现在反应器的入口处,认为CH4首先与O2发生完全氧化生成H2O、CO2,然后与H2O、CO2发生重整反应生成H2、CO;而Hickman等[8]观察到在极短的反应时间内O2与H2、CO并存于反应器出口,因此他们认为合成气是直接生成的。随着研究条件的提升和理论的完善,学者们发现CH4的催化部分氧化反应受多个条件的影响,如压力、温度、催化剂、载体等,而表现出不同的特性,或直接或间接生成合成气[9-12]。上述研究均有助于深入认识CH4的催化部分氧化过程,但还有些问题尚不甚明了,如CH4部分催化氧化反应具有怎样的反应特性,部分氧化产物的生成受哪些因素的影响,积碳对反应又会造成什么样的影响等。
文中通过数值方法研究了微尺度条件下Rh表面CH4的部分催化氧化,采用多步基元反应机理能够很好地分解、重现这一过程。通过对不同条件下反应物浓度分布曲线的分析可以确定CH4部分催化氧化反应的反应过程及特性,通过同样的方法也可以找出影响部分氧化产物生成的关键因素以及积碳对反应所造成的影响。
1 物理模型和数学模型在微尺度条件下,反应物在反应器内的停留时间与气体分子向催化剂扩散的时间相当,传质过程对反应特性有着重要的影响,因此文中的模拟包含了物质输运模型和反应动力学模型。二者的耦合是一个十分复杂的过程,研究中往往采用具有简单物理结构的反应器,选择内径0.5 mm、长10 mm、壁厚0.1 mm的微圆管作为反应器,其二维模型如图 1所示。
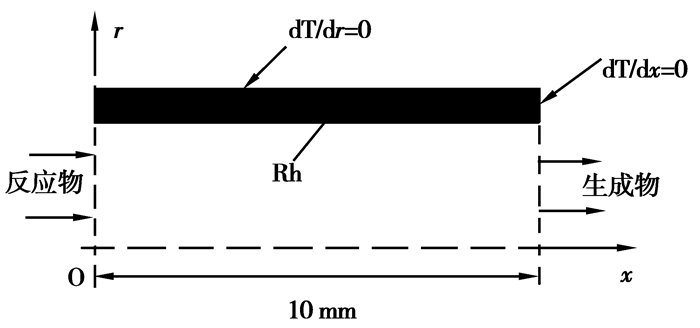
|
图 1 燃烧器物理模型图 |
在毫米级的反应器内,由于空间尺寸及低反应温度的限制,气相反应难以发生[13],因此在研究中只考虑壁面催化反应。混合气体的流动速度很低,为层流流动(Re<100)。计算中忽略了体积力、流动中的耗散作用以及辐射传热。反应器内传质与传热过程以及化学反应过程的数学描述见相关文献[14]。
2 表面反应机理CH4的部分氧化过程可能涉及以下反应[15]:
R1 CH4+2O2=CO2+2H2O+803 kJ/mol
R2 CH4+0.5O2=CO+2H2+36 kJ/mol
R3 CH4+H2O=CO+3H2-206 kJ/mol
R4 CO+H2O=CO2+H2+41 kJ/mol
R5 CH4+CO2=2CO+2H2-247 kJ/mol
R6 H2+0.5O2=H2O+240 kJ/mol
R7 CO+0.5O2=CO2+172 kJ/mol
在不同的条件下,主导体系进行的关键反应各不相同,CH4的部分氧化也就表现出不同的特性。因此模拟中采用Deutschmann等[16]提出的详细基元反应机理(见表 1),该机理包含了上述7个反应,其适用性已被Adrian Schneider[9]和R. Horn[17]所验证。
| 表 1 表面催化反应机理 |
文中以流体动力学软件FLUENT6.3为计算平台,基元反应机理以自定义程序导入。采用二阶精度的离散格式,以出口各组分质量分数稳定及进出口质量平衡为收敛条件。进口气体由CH4、O2以及N2组成,其中N2为惰性气体,不参与反应。经充分预混的气体被加热至一定温度后,以0.5 m/s的速度流入反应器,20 ms左右的停留时间能够保证各组分与催化壁面充分接触。进口压力为1个大气压;压力出口边界,出口压力也为1个大气压。反应器外壁面绝热,内壁面为流固耦合壁面,反应器材料为铜。
3.2 计算验证将文中所用的数学模型、反应机理和文献[18]所用的物理模型相结合,并对文献[18]中的实验工况进行数值模拟,模拟结果和实验结果如图 2所示。可以看出,采用文中数学模型和反应机理得到的结果与实验结果较为吻合,能够很好地反映出CH4部分催化氧化随温度升高的变化趋势,因此所用模型是合理的。
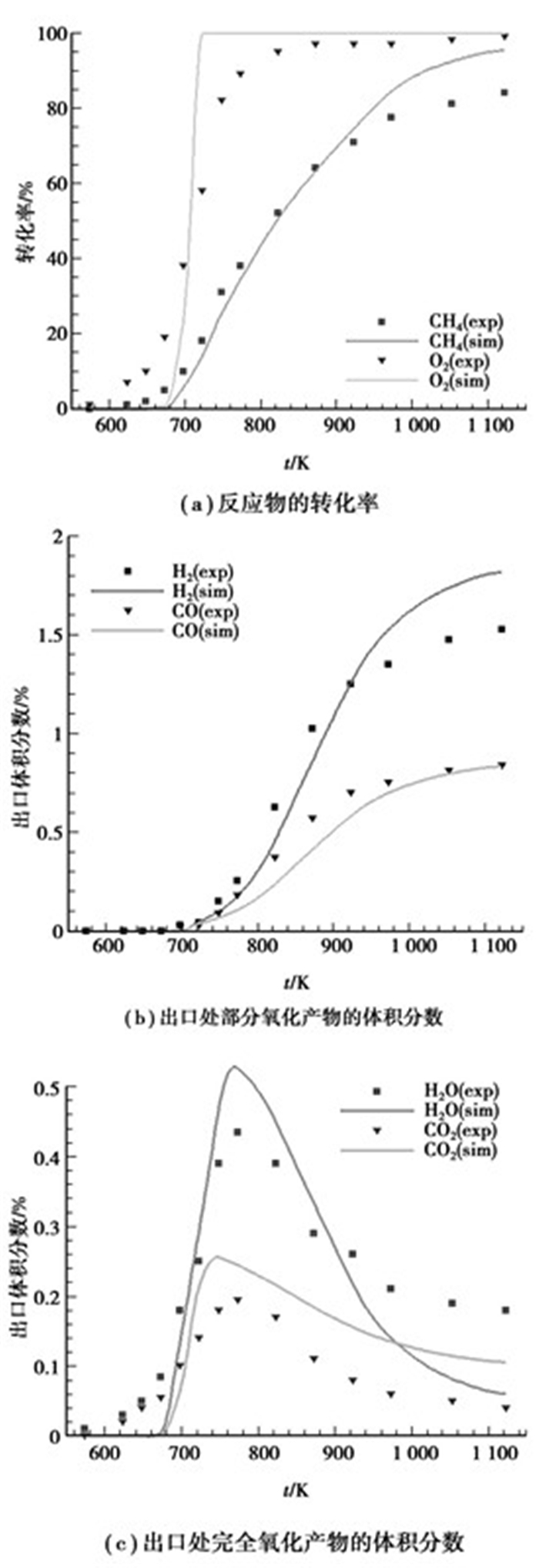
|
图 2 计算验证(GHSV=4.5×106Nl/kgcat/h,yCH4=1%,yO2=0.56%) |
考虑到催化剂所能承受的温度有限,因此模拟中给定的CH4和O2的量较低,CH4的体积分数为6%,O2的体积分数为3%。
从图 3(a)可以看出,在反应器入口1 mm段内,O2的消耗速率较CH4快得多,绝大部分O2被消耗,而只有部分CH4被消耗。这个区域内发生的反应主要是氧化反应,通常被称为氧化区。氧化区内的生成物为H2O、CO2以及CO、H2(相比较而言H2的生成较少),即发生的反应主要为CH4的完全氧化(R1)和部分氧化(R2),以及H2的氧化(R6)。1 mm段以后,CH4的质量分数持续降低,H2O的质量分数也由增大转为减小,H2O的重整反应(R3)开始发生,这个区域为重整区。重整区内CO2的质量分数保持不变,CO2的重整反应(R5)和水汽转换反应(R4)都没有发生。文中模拟所得到的各组分的反应过程与反应特性与R. Horn[12]及Brian C. Michael等的实验结果一致。
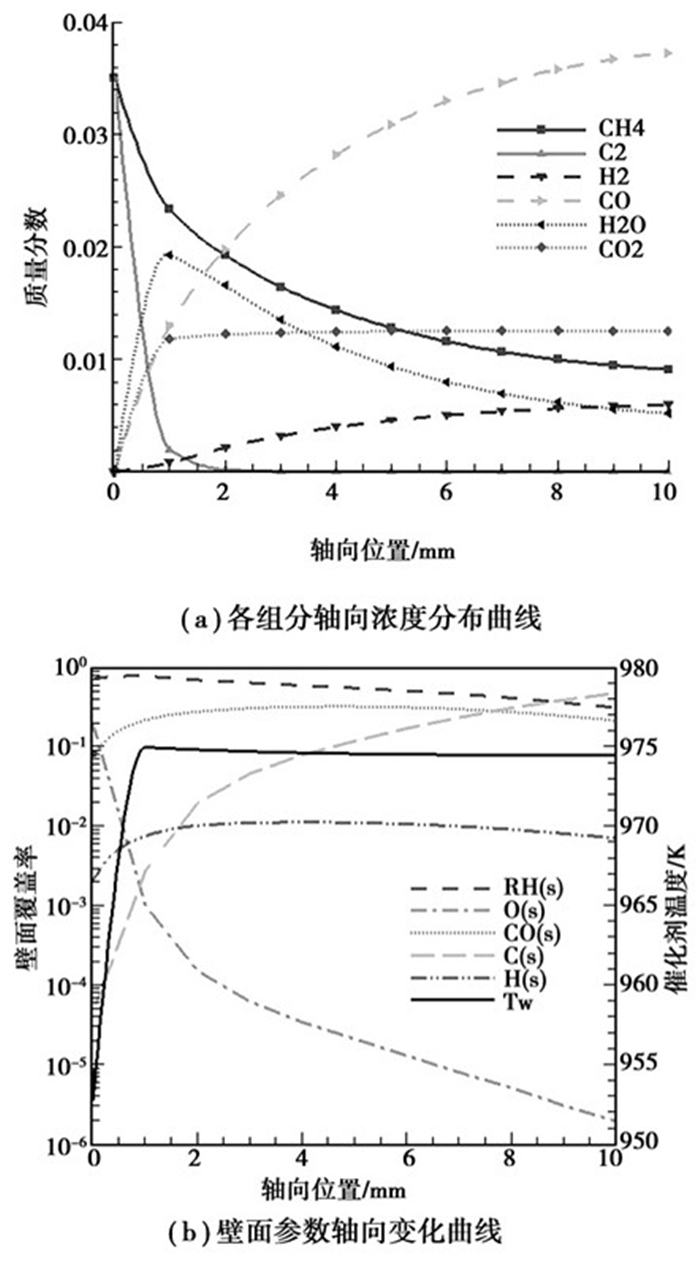
|
图 3 CH4的部分催化氧化过程及(yCH4=6%, yO2=3%,Tin=900 K,vin=0.5 m/s) |
在Rh催化剂表面,O2分解的活化能为0,而CH4的裂解或者氧化分解均需较高的能量(活化能分别为61.0 kJ/mol和80.3 kJ/mol[16]),因此O2的表面反应速率较CH4要快得多。在反应器的入口段,由于O2的高反应性,O(s)的壁面覆盖率非常高(见图 3(b)),氧化剂的量比较充足。在催化剂的作用下,H(s)极易与氧化剂反应生成H2O(活化能为33.5 kJ/mol[16]),而CO(s)与O(s)的反应较难发生(活化能为121.6 kJ/mol[16]),氧化区内生成物的生成选择性依次为H2O、CO、CO2以及H2。在重整区内,CH4的量还有剩余,有可能与H2O或CO2发生反应。但Rh催化剂对CO2的吸附选择性比H2O要弱得多(二者的吸附系数分别为10-5和0.1[16]),CO2很难被催化剂吸附,因此CO2的重整反应基本没有发生;同时H2O作为氧化剂与CH4反应,能够提供的O非常有限,仅能将CH4裂解生成的C氧化生成CO,而不能将CO继续氧化生成CO2,水汽转换反应(R4)难以发生。从图 3(b)还可以看出,CH4的部分催化氧化过程有大量积碳生成,而积碳主要产生于重整区,由CH4的裂解反应生成。
从上面的分析可以看出CH4部分催化氧化的反应过程为:在反应器入口段,CH4首先与O2发生氧化反应,生成H2O、CO2以及CO、H2;当绝大部分O2被消耗以后,CH4与H2O发生重整反应,但CO2的重整反应并不发生。
3.3.2 进口温度对CH4部分催化氧化的影响混合气体的组成为6%体积分数的CH4、3%体积分数的O2以及91%体积分数的N2,各工况下的进口温度分别为800、850、900、950、1 000 K。
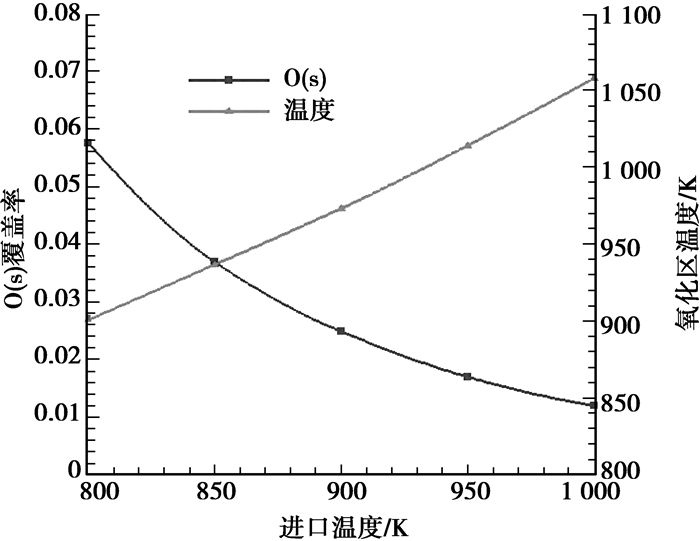
从图 4可以看出,随着进口温度的增加,CH4的消耗速率不断增大,但O2的消耗速率几乎没有变化,因此CH4的反应主要为表面动力学控制,而O2的反应为分子扩散控制。在氧化区(0~1 mm段)内,部分氧化产物的生成量随进口温度的增加而增大,完全氧化产物的生成量则减小。在重整区(1~10 mm段)内,CH4和H2O的重整反应随进口温度的升高而加剧,在1 000 K进口温度条件下,CH4和H2O的重整反应在反应器出口段达到平衡;而温度的升高并不会影响到CO2的相关反应的发生。氧化区的壁面温度随进口温度的增加而增大,而较高的壁面温度有利于组分的解吸附,因此O2的吸附/解吸附平衡随进口温度的增加逐渐偏向后者,导致了O(s)覆盖率的降低,如图 5所示。O(s)覆盖率越低即表示氧化剂的量越少,CH4的部分氧化程度就越高,于是部分氧化产物的生成量越多,相应完全氧化产物的生成量越少。
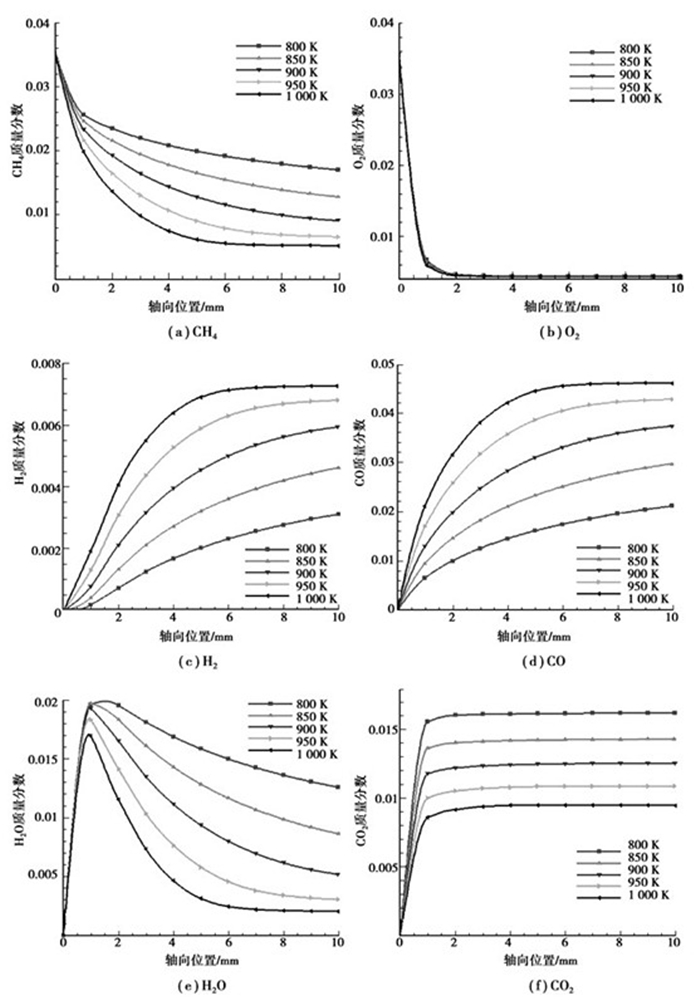
|
图 4 不同进口温度条件下各组分轴向浓度分布曲线(yCH4=6%,yO2=3%,vin=0.5 m/s) |
|
图 5 不同进口温度条件下氧化区壁面参数变化曲线(yCH4=6%,yO2=3%,vin=0.5 m/s) |
进口温度对于CH4部分催化氧化的影响在于:随着进口温度的升高,CH4的转化率增大,部分氧化产物的生成量增加,而完全氧化产物的生成量减少。
3.3.3 C/O体积比对CH4部分催化氧化的影响C/O体积比定义为:进口CH4体积分数与O2体积分数之比。设定进口N2的体积分数恒定为91%,进口温度为900 K,各计算工况下C/O体积比依次为1.5、1.75、2、2.25以及2.5。
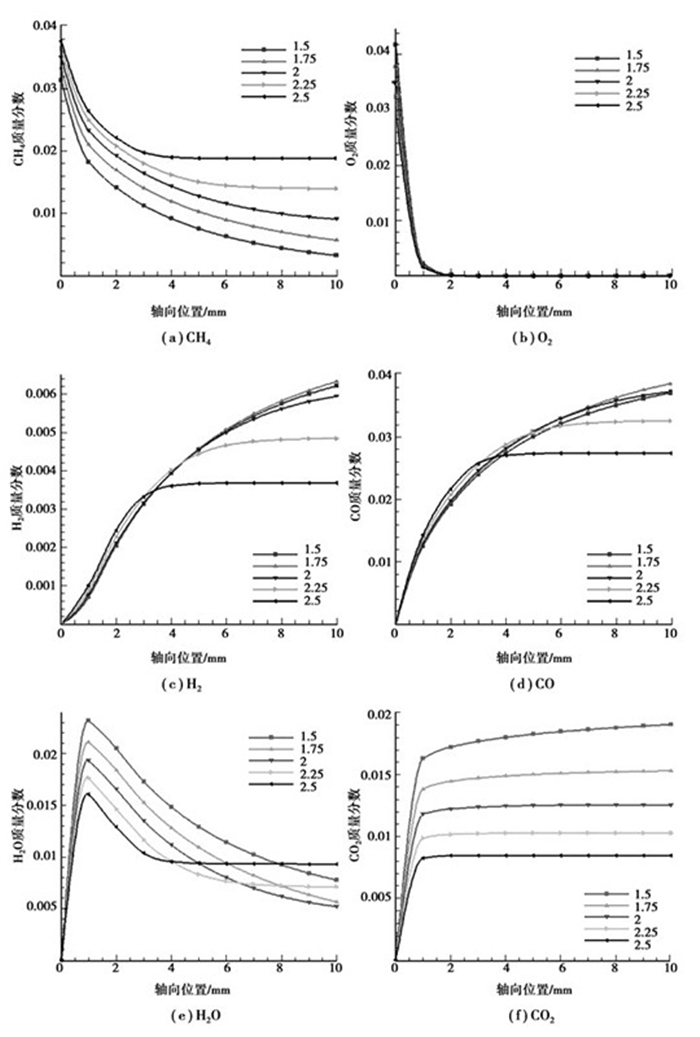
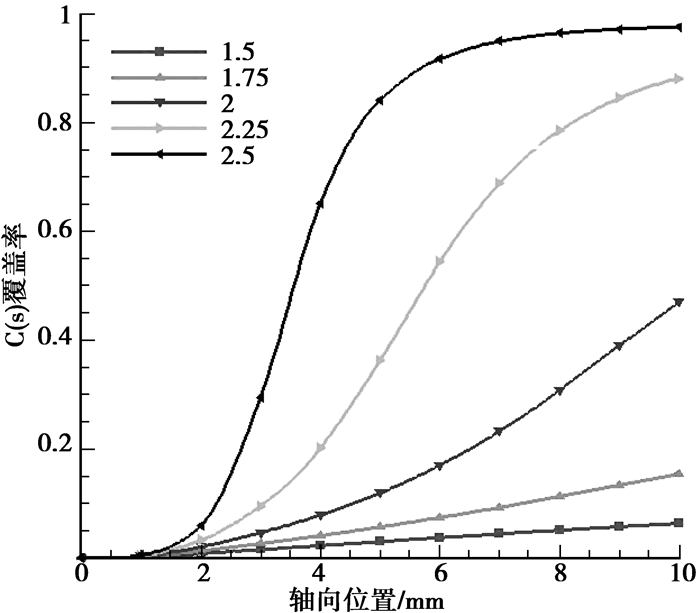
计算结果如图 6所示。随着C/O体积比的增大,CH4的转化率逐渐减小,尤其是在重整区减小的幅度非常明显;在C/O体积比为2.25和2.5工况下,CH4与H2O的重整反应都因积碳过多(见图 7)而停止。尽管各工况下进口质量分数各不相同,但O2均在进口段被完全消耗。从这一方面同样可以看出,CH4的反应主要为表面动力学控制,O2的反应为分子扩散控制。在氧化区内,H2和CO的生成量随C/O体积比的增大而增加,但在重整区内其生成量随C/O体积比的增大而降低。C/O体积比越大,重整区内催化壁面的积碳越多,导致CH4与H2O的重整反应程度降低甚至停止,特别是在C/O体积比大于2以后。H2O在氧化区内的生成量随C/O体积比的增大而减少,其消耗量在重整区内也是随着C/O体积比的增大而减少的。在氧化区内CO2的生成量随C/O体积比的增大而减少,在低C/O体积比的工况下CO2在重整区内仍有少量生成,即水汽转换反应(R4)发生在较低C/O体积比条件下。与文献[12]中的实验结果相比,反应器出口处各组分随C/O体积比增加的变化趋势是吻合的,但在氧化区末端,部分氧化产物的生成趋势有一定量的差别。
|
图 6 不同C/O体积比条件下各组分轴向浓度分布曲线(YN2=91%,Tin=900 K,vin=0.5 m/s) |
|
图 7 不同C/O体积比条件下催化壁面上的积碳曲线(YN2=91%,Tin=900 K,vin=0.5 m/s) |
从模拟结果可以看出,C/O体积比的增加导致了CH4转化率的降低,部分氧化产物的生成量随C/O体积比的增加呈先增大后减小的趋势,同时C/O体积比越大,积碳量越多。
3.3.4 H2O对CH4部分催化氧化的影响保持进口CH4的体积分数为6%,O2的体积分数为3%不变,各工况下的H2O的添加量依次为0、1%、2%、3%、4%,N2为平衡气体。
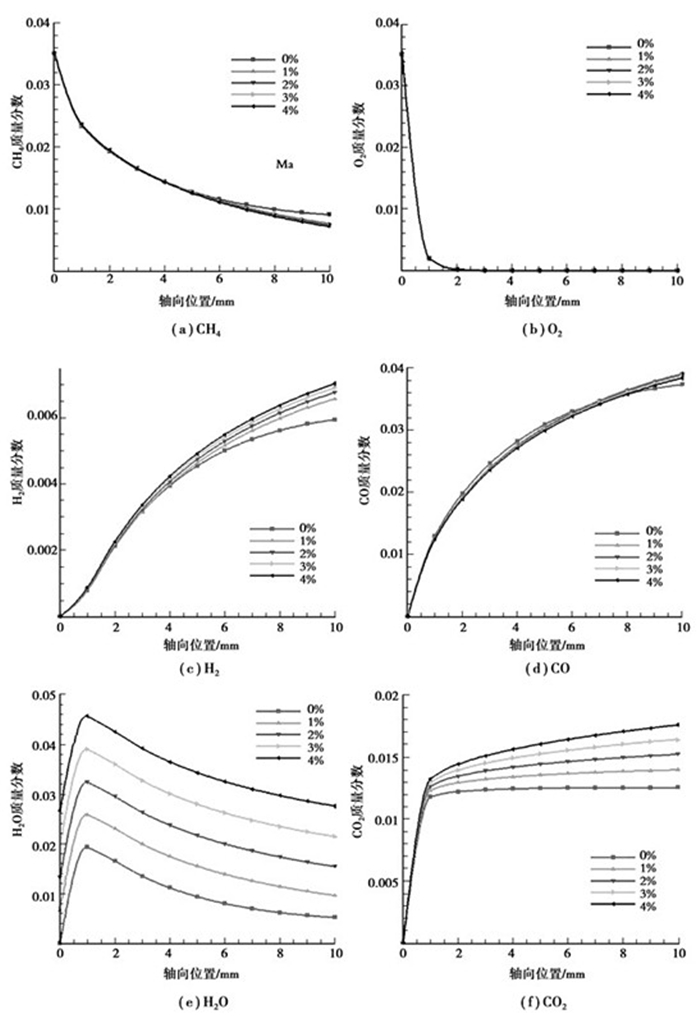
计算结果见图 8。添加H2O对氧化区内CH4和O2的转化基本不会产生影响,添加H2O对CH4转化的影响在重整区的后半段才有所体现,当混合气体有H2O掺入时,出口处CH4的转化率有一定程度的增加,但H2O添加量的多少对CH4的转化率增加的幅度没有太大的影响。其原因在于,当进口混合气体中没有H2O掺入时,重整区内CH4与H2O的反应会产生大量的积碳,对CH4的转化造成负面的影响。当进口混合气体中有H2O掺入时,H2O可以有效地抑制积碳的生成(见图 9),从而提高CH4的转化率。另外CH4与H2O的反应主要受温度的影响而受反应物浓度的影响不大,反应器内部的热量主要来自于氧化区,但氧化区内CH4和O2的氧化基本没有受到H2O的影响,因此反应器内部温度在后4工况下基本保持不变,所以H2O添加量的多少并不会对CH4的转化率造成太大的影响。在氧化区内,添加H2O会轻微地促进H2的生成而抑制CO的生成,并且添加量越多,促进或抑制效果越明显。在重整区内,H2的生成量随H2O添加量的增加而增加,有H2O添加时,CO的生成量高于没有H2O添加的工况,但随H2O添加量的增加而减少。氧化区内H2O的净生成量随H2O添加量的增加而降低,重整区内其净消耗量随H2O添加量的增加而增加。在整个反应器内,CO2的生成量随H2O添加量的增加而增加,尤其在重整区,其增加的幅度非常明显(R4)。
|
图 8 不同H2O添加量条件下各组分轴向浓度分布曲线(YCH4=6%,YO2=3%,Tin=900 K,vin=0.5 m/s) |
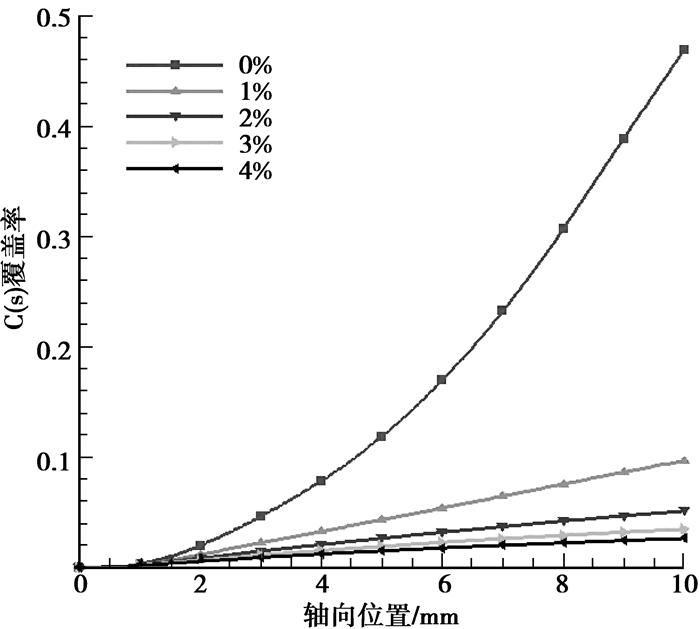
|
图 9 不同H2O添加量条件下催化壁面上的积碳曲线(YCH4=6%,YO2=3%,Tin=900 K,vin=0.5 m/s) |
添加H2O对CH4部分催化氧化的影响在于,H2O将重整区内的积碳氧化为CO2,从而抑制积碳并促进H2和CO2的生成,同时对CO有一定的抑制作用。
4 结论研究了微细通道内Rh催化剂表面CH4的部分催化氧化,重点考察了进口温度、C/O体积比以及添加H2O对CH4部分催化氧化的影响,主要得出以下结论:
1) 在Rh催化剂表面,CH4的反应主要为动力学控制,而O2的反应主要为扩散控制;由于O2的高反应性,CH4首先与O2发生氧化反应,生成H2O、CO2、CO以及H2,O2被消耗之后,CH4与H2O发生重整反应,CO2的相关反应并不发生;
2) 提高反应温度能够显著提高CH4的转化效率,并有利于部分氧化产物的生成,但同时会导致催化壁面积碳量的增加;
3) 随C/O体积比的增加,重整区内积碳量迅速增加,导致CH4的转化率降低,甚至重整反应的停止,同时部分氧化产物的生成量降低;
4) 添加H2O能够抑制重整区内积碳的生成,提高CH4的转化效率,但添加量的多少对CH4转化率增加的幅度没有太大影响;添加H2O可促进H2和CO2的生成并抑制CO的生成。
| [1] |
伍亨, 钟北京.
空间反应和入口速度对甲烷催化反应的影响[J]. 清华大学学报:自然科学版, 2005, 45(5): 670–672, 676.
WU Heng, ZHONG Beijing. Influence of the gas-phase reaction and the inlet velocity on the catalytic reaction of CH4[J]. Journal of Tsinghua University:Science and Technology, 2005, 45(5): 670–672, 676. (in Chinese) |
| [2] | Deutschmann O, Schmidt R, Behrendt F, et al. Numerical modeling of catalytic ignition[J]. Symposium(International) on Combustion, 1996, 26(1): 1747–1754. |
| [3] | Michael R, John M, Rolf S, et al. High-pressure catalytic combustion of methane over platinum:in situ experiments and detailed numerical predictions[J]. Combustion and Flame, 2004, 136(1/2): 217–240. |
| [4] | Deutschmann O, Maier L I, Riedel U, et al. Hydrogen assisted catalytic combustion of methane on platinum[J]. Catalysis Today, 2000, 59(1/2): 141–150. |
| [5] | Zhang Y, Zhou J, Yang W, et al. Effects of hydrogen addition on methane catalytic combustion in a microtube[J]. International Journal of Hydrogen Energy, 2007, 32(9): 1286–1293. DOI:10.1016/j.ijhydene.2006.07.023 |
| [6] |
吴川, 张华民, 衣宝廉.
化学制氢技术研究进展[J]. 化学进展, 2005, 17(3): 423–429.
WU Chuan, ZHANG Huamin, YI Baolian. Recent advances in hydrogen generation with chemical methods[J]. Progress in Chemistry, 2005, 17(3): 423–429. (in Chinese) |
| [7] | Vernon P D F, Green M L H, Cheetham A K, et al. Partial oxidation of methane to synthesis gas[J]. Catalysis Letters, 1990, 6(2): 181–186. DOI:10.1007/BF00774718 |
| [8] | Hickman D A, Schmidt L D. Syngas formation by direct catalytic oxidation of methane[J]. Science, 1993, 259: 343–346. DOI:10.1126/science.259.5093.343 |
| [9] | Schneider A, Mantzaras J, Jansohn P. Experimental and numerical investigation of the catalytic partial oxidation of CH4/O2 mixtures diluted with H2O and CO2 in a short contact time reactor[J]. Chemical Engineering Science, 2006, 61(14): 4634–4649. DOI:10.1016/j.ces.2006.02.038 |
| [10] | Appel C, Mantzaras J, Schaeren R, et al. Partial catalytic oxidation of methane to synthesis gas over rhodium:in situ Raman experiments and detailed simulations[J]. Proceedings of the Combustion Institute, 2005, 30(2): 2509–2517. DOI:10.1016/j.proci.2004.08.055 |
| [11] | Schwiedernoch R, Tischer S, Correa C, et al. Experimental and numerical study on the transient behavior of partial oxidation of methane in a catalytic monolith[J]. Chemical Engineering Science, 2003, 58(3): 633–642. |
| [12] | Horn R, Williams K A, Degenstein N J, et al. Methane catalytic partial oxidation on autothermal Rh and Pt foam catalysts:oxidation and reforming zones, transport effects, and approach to thermodynamic equilibrium[J]. Journal of Catalysis, 2007, 249(2): 380–393. DOI:10.1016/j.jcat.2007.05.011 |
| [13] | Davis M B, Pawson M D, Veser G, et al. Methane oxidation over noble metal gauzes:an LIF study[J]. Combustion and Flame, 2000, 123(1/2): 159–174. |
| [14] | Ding S, Wu C N, Cheng Y H, et al. Analysis of catalytic partial oxidation of methane on rhodium-coated foam monolith using CFD with detailed chemistry[J]. Chemical Engineering Science, 2010, 65(6): 1989–1999. DOI:10.1016/j.ces.2009.11.033 |
| [15] | Fukada S, Nakamura N, Monden J. Effects of temperature, oxygen-to-methane molar ratio and superficial gas velocity on partial oxidation of methane for hydrogen production[J]. International Journal of Hydrogen Energy, 2004, 29(6): 619–625. DOI:10.1016/j.ijhydene.2003.08.002 |
| [16] | Deutschmann O, Schwiedernoch R, Maier L I, et al. Natural gas conversion in monolithic catalysts:interaction of chemical reactions and transport phenomena[J]. Studies in Surface Science and Catalysis, 2001, 136: 251–258. DOI:10.1016/S0167-2991(01)80312-8 |
| [17] | Horn R, Williams K A, Degenstein N J, et al. Syngas by catalytic partial oxidation of methane on rhodium:mechanistic conclusions from spatially resolved measurements and numerical simulations[J]. Journal of Catalysis, 2006, 242(1): 92–102. DOI:10.1016/j.jcat.2006.05.008 |
| [18] | Donazzi A, Beretta A, Groppi G, et al. Catalytic partial oxidation of methane over a 4% Rh/(-Al2O3 catalyst part Ⅰ:kinetic study in annular reactor[J]. Journal of Catalysis, 2008, 255(2): 241–258. DOI:10.1016/j.jcat.2008.02.009 |
| [19] | Michael B C, Donazzi A, Schmidt D L, et al. Effects of H2O and CO2 addition in catalytic partial oxidation of methane on Rh[J]. Journal of Catalysis, 2009, 265: 117–120. DOI:10.1016/j.jcat.2009.04.015 |
 2013, Vol. 36
2013, Vol. 36


