随着中国经济的高速发展,燃煤排放的二氧化硫也不断增加,导致中国酸雨和二氧化硫污染日趋严重[1]。燃煤电厂等以二氧化硫为主要污染源的企业广泛采用了钠法脱硫的烟气处理技术。所谓钠法脱硫是指利用氢氧化钠溶液作为启动脱硫剂,将配制好的氢氧化钠溶液直接打入脱硫塔洗涤脱除烟气中的SO2来达到烟气脱硫的目的,然后脱硫产物经脱硫剂再生池还原成氢氧化钠再打回脱硫塔内循环使用。它的优点是钠盐来源丰富,对SO2的亲和力相当高;以Na2SO3-NaHSO3为体系的化学机制适应于吸收与再生循环操作;有将所有化合物保持在溶液内的能力,从而可避免洗涤器内结垢或淤塞[2]。而缺点在于脱硫工艺中所产生的废水水质非常特殊:含盐量极高,含有高浓度的悬浮物和部分还原性无机盐类[3]以及各种重金属,对环境有很强的污染性,处理难度较大,且其排放量呈急剧增长的趋势,给生态环境带来巨大的压力。
降低COD含量是处理钠法脱硫废水所面临的最主要的难题。钠法脱硫废水的组分特点是[4-5]:悬浮物含量高,颗粒细小,主要是二氧化硅以及铁、铝的氢氧化物;阳离子主要为钠、镁等离子,含量极高;铁、铝含量也较高,其他重金属离子含量不高,部分超过了GB8978—1996《污水综合排放标准》中规定的排放指标;阴离子主要有Cl-、F-以及还原性硫的含氧无机盐等。而钠法脱硫废水高COD的主要来源恰恰是SO32-和S2O32-等还原性硫的含氧无机盐,要氧化它们较为困难。所以国内大多处理工艺对其采用曝气氧化法,COD去除率仅为8%~10%,处理效果有一定的局限性[6]。也有国外处理工艺使用合成吸附剂吸附废水中的COD,并用药品再生使其脱附,但再生废液需要再次对COD进行处理[7],这些方法对COD的处理都不够彻底。因此研究一种经济的、能彻底氧化高COD物质的钠法烟气脱硫废水处理工艺对实际工程有很大的指导意义。
生化方法相比之下不论在节约投资还是环保效益方面都有相当积极的作用,而亚硫酸盐的氧化反应又广泛存在于自然界中化能型硫氧化菌内[8],因此生物氧化法受到了广泛的重视。然而,由于钠法脱硫废水中的高浓度盐分会造成细胞外渗透压高于细胞内渗透压,使细胞脱水,并破坏离子间平衡;同时,废水中SO32-若不被快速转化而积累在体内,就会对细胞产生毒害作用[9],故生物氧化在目前实际的污水处理工程中应用较少,没有成熟经验可以借鉴[10]。因此无论从技术应用还是环境保护角度出发,对既耐高盐又能高效氧化还原性无机硫化合物的菌种选育进行深入研究是十分必要的。筛选出能够应用于工程设施的种群并深入研究其代谢机理用以优化现有的技术措施,对扩大经济效益和环境可持续发展有着相当积极的意义。
本研究从某热电厂钠法脱硫废水出水口处的污泥中进行菌种的筛选,并通过对菌种耐盐性和氧化活性的梯度驯化,最终得到了一株在高盐条件下对SO32-、S2O32-有较高生物氧化能力的菌株Z-2,并对影响该菌株生物氧化过程的因素进行了分析。
1 材料与方法 1.1 试剂及培养基1) 试剂。试验所用试剂Na2SO3、Na2S2O3均为分析纯。
2) 培养基。
基本富集培养基[11]:(NH4)2SO4 2.5 g/L,K2HPO4 1.4 g/L,KH2PO4 0.6 g/L,MgSO4 0.1 g/L,CaCl2 0.1 g/L,NaCl 5 g/L,Na2SO3 10 g/L。
选择性培养基:(NH4)2SO4 2.5 g/L,K2HPO4 1.4 g/L,KH2PO4 0.6 g/L,MgSO4 0.1 g/L,CaCl2 0.1 g/L,NaCl 10 g/L,Na2S2O3 10 g/L,Na2SO3分别取21、28、35、42、49、56、63和70 g/L。若为固体平板,则加入2%的琼脂。
种子培养基:在基本富集培养基的基础上,为了提供更高盐的环境,将NaCl质量浓度提高至10 g/L。
驯化培养基:(NH4)2SO4 2.5 g/L,K2HPO4 1.4 g/L,KH2PO4 0.6 g/L,MgSO4 0.1 g/L,CaCl2 0.1 g/L,NaCl 10 g/L,Na2S2O3 10 g/L,Na2SO3分别为49、56、63和70 g/L(根据初筛结果),pH 7.2。
1.2 试验方法1)模拟废水的配制。
采用密闭消解法[12],根据从热电厂取回的实际废水水质特性(COD 18 000 mg/L,含盐量100 g/L),对不同组分不同浓度配比的模拟废水进行COD的测定,绘制出模拟废水组分配比与COD关系的标准曲线。并得出实际废水的还原性硫组分应为Na2SO3 70 g/L,Na2S2O3 10 g/L。
2)菌种筛选。
采样:本试验采用的污泥样品取自于某热电厂钠法脱硫废水出水口处。
筛选培养:将所采集的污泥在无菌水中震荡后,取上清液进行富集培养,之后在21、28、35、42、49、56、63和70 g/L Na2SO3质量浓度的选择性平板上分别涂布以分离纯化,并得出具有高效氧化还原性硫化合物潜力的纯种菌株,转入到基本富集培养基中进行培养。将得出的若干株菌接入到35 g/L Na2SO3的选择性培养基中,培养4 d,测定接种后的还原性硫氧化率,得到目标菌株。采用逐级连续传代法对初筛得出的目标菌株进行生物氧化能力的驯化复筛。驯化开始,Na2SO3的浓度取42 g/L,以7 g/L为梯度向上递增,直至将Na2SO3的浓度提高到70 g/L,得到最优菌株。
3) 菌株耐盐性驯化试验。
对最优菌株进行耐盐性驯化时依然采用逐级传代法,NaCl质量浓度取10、20、30和40 g/L。
4) 菌株培养条件的单因素优化试验。
在Na2SO3 70 g/L,Na2S2O3 10 g/L,NaCl 20 g/L的废水培养基中,规定条件:氮源,培养基初始pH7.2,温度30 ℃,摇床转速120 r/min,接种量10%,培养时间5 d。
1.3 分析方法生物量:采用分光光度计进行菌液OD600的测定,绘制生长曲线。
脱硫废水中还原性无机硫化合物的氧化,可通过试验中化合物浓度的减少或转化产物的增加来表征[13-14]。本试验则采用还原性硫的氧化率进行表征。
氧化率:以r(%)表示,r=ρ1/ρ0。式中,ρ1表示测样时的SO42-质量浓度,ρ0表示接种之前培养基中可被氧化为SO42-的理论质量浓度。
SO42-质量浓度:采用铬酸钡光度法测定,
| $ \rho \left( {硫酸盐} \right) = m \times 1000/{V^{[11]}}。$ | (1) |
式中:m为根据硫酸盐质量浓度标准曲线查得的SO42-量,mg;V为取水样体积,mL。
2 结果和讨论 2.1 SO42-离子的标准曲线根据铬酸钡光度法[15],用分光光度计测定样品中的铬酸根离子含量,其最大吸收波长为420 nm处。在此波长测定多批不同质量浓度的硫酸钠单品标准溶液,以及不同质量浓度的硫酸钠无机盐培养基标准溶液,绘制吸光度(OD420)-硫酸根质量浓度曲线(图 1)。可以得出,无机盐培养基中其他成分对溶液中铬酸根吸光度值的测定不构成影响。
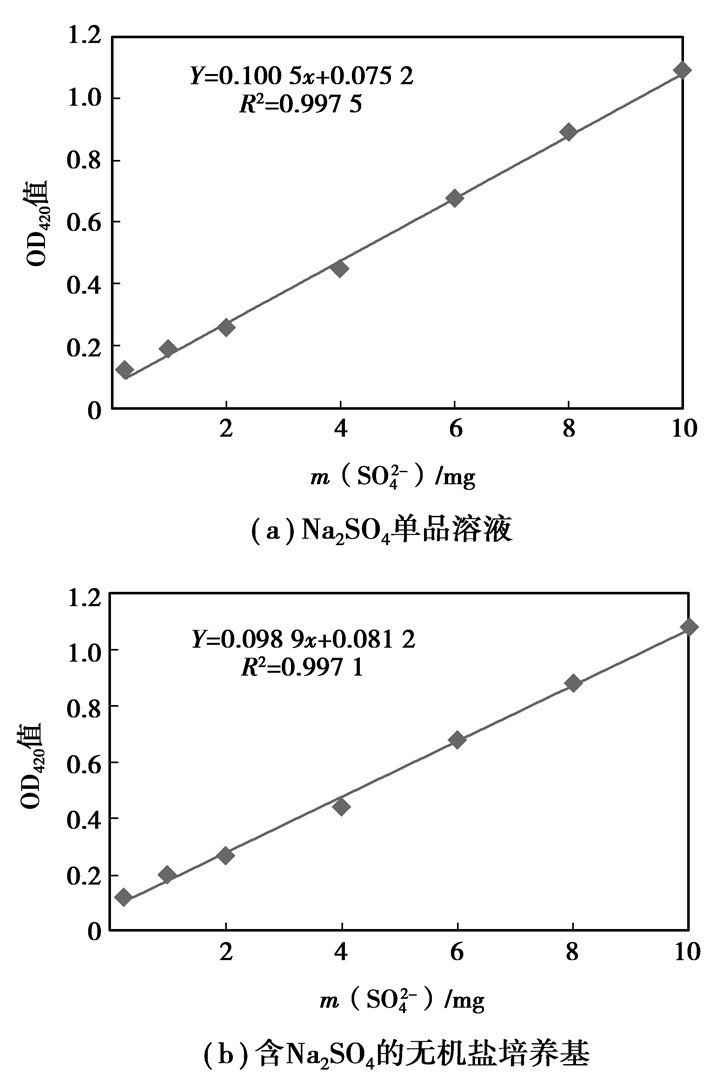
|
图 1 硫酸盐质量浓度标准曲线 |
制备21、28、35、42、49、56、63和70 g/L Na2SO3的选择性平板培养基,将富集培养液按不同稀释度涂布在不同Na2SO3浓度的平板上以分离纯化。经过一段时间的观察发现(见图 2),在21 g/L(310个菌落)和28 g/L Na2SO3的选择性平板中长出大量的菌落;35 g/L Na2SO3的选择性平板中生长的菌落明显减少(161个);当Na2SO3质量浓度大于35 g/L以后,菌落数随着Na2SO3质量浓度的增加而减少;而当Na2SO3质量浓度达到63和70 g/L时,选择性平板中几乎不存在菌落。
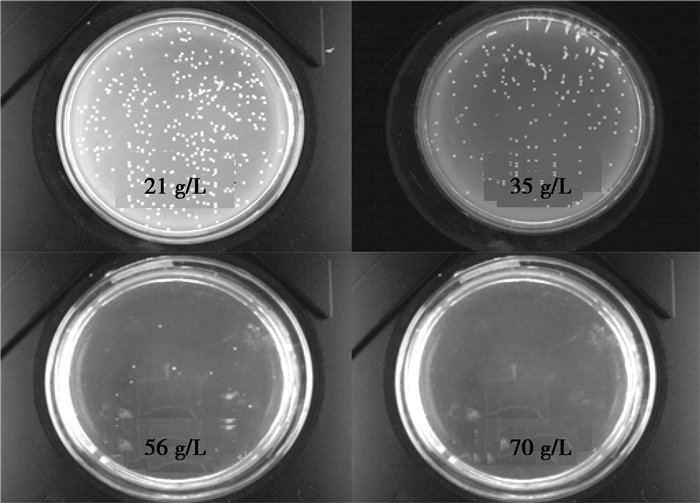
|
图 2 不同亚硫酸钠质量浓度废水平板上初筛后的菌落情况 |
菌株对底物的代谢能力越强就越容易存活于该底物环境中,故高浓度废水平板上存活的菌株应具备高效氧化能力潜质。将42、49、56 g/L Na2SO3的废水平板中的菌落挑出,取得6种菌落形态各不相同的纯菌株,分别转入到基本富集培养基中培养。再以10%的接种量分别接种到35 g/L Na2SO3的液体培养基中,培养4 d,通过测定氧化率发现其中2株菌氧化率较高(氧化率分别为62.1%和58.4%),定为目标菌株。
2.3 菌种的驯化复筛通过不同质量浓度Na2SO3的废水培养基的逐级驯化,考察2株目标菌株对还原性硫化合物的耐受和生物氧化能力。平行培养条件,由Na2SO3的质量浓度为42 g/L开始,以7 g/L为质量浓度梯度向上递增,每批次菌液传代接种量为10%,直至Na2SO3为70 g/L,通过种子培养基的传代得到一株最优菌株,命名为Z-2,其生长周期为8 d左右。经过2次传代后,Z-2对还原性硫化合物的氧化率能达到92%(见图 3),接近国内已研究的较高水平氧化率(95%)[16-17]。
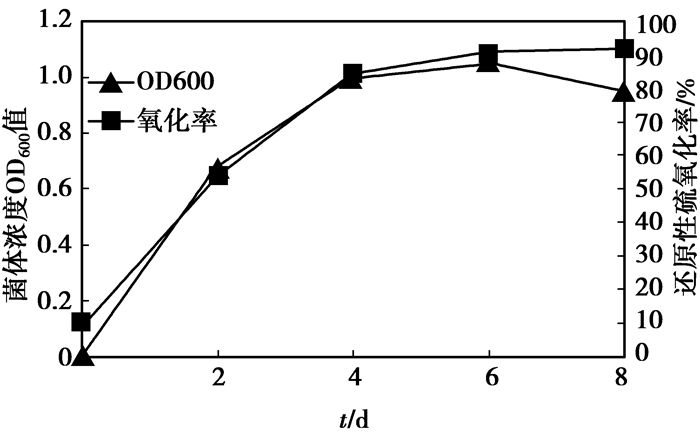
|
图 3 最优菌株Z-2驯化后的生长及氧化率情况 |
菌株Z-2培养14 d后的菌落特征见图 4,可以看出在超出生长周期后随着时间增长,菌落逐渐不规则。相比之前的淡白色圆形,菌落依然为淡白色但边缘不再整齐,而是呈现放射状的菌落边缘,由此可以推断Z-2菌可能带有鞭毛,并有一定运动能力[18]。
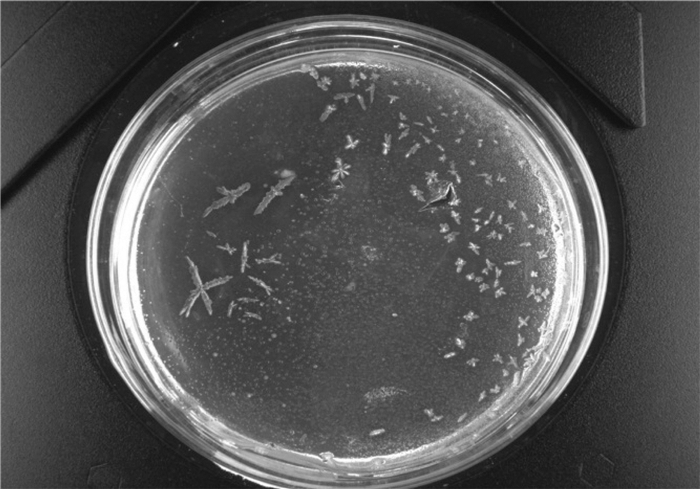
|
图 4 最优菌株Z-2培养14 d后的菌落特征 |
对复筛得到的最优菌株Z-2进行耐盐性试验,于不同NaCl质量浓度的驯化培养基中,在不同时间测定菌体的生长量和还原性硫的氧化率,结果如图 5所示。结果表明,NaCl质量浓度为20、30以及40 g/L时,菌种进入平衡期分别延迟1、2、3 d,且整个生长过程延缓。这说明,当NaCl的质量浓度提高时,Z-2菌需要一个适应期来调整自身代谢以适应外界环境。另外,NaCl质量浓度为10和20 g/L时,对菌株氧化能力没有影响,氧化率均达到90%左右;在NaCl质量浓度为30 g/L时,菌株也有一定耐受能力,氧化率达到70%;NaCl质量浓度达40 g/L时,菌株的生长和还原性硫的氧化完全受到抑制,菌体浓度和氧化率都很低。可以看出若NaCl质量浓度高过一定程度就会对还原性硫的氧化产生抑制作用。国内有研究表明,无色硫细菌耐盐20 g/L同时去除(氧化)率为80%左右[19],相比之下Z-2效果更好。说明本研究选育的菌株Z-2已具有很好的耐盐性和高盐环境下的高氧化活性,且在工业上具备应用前景(实际废水NaCl质量浓度即为20 g/L)。
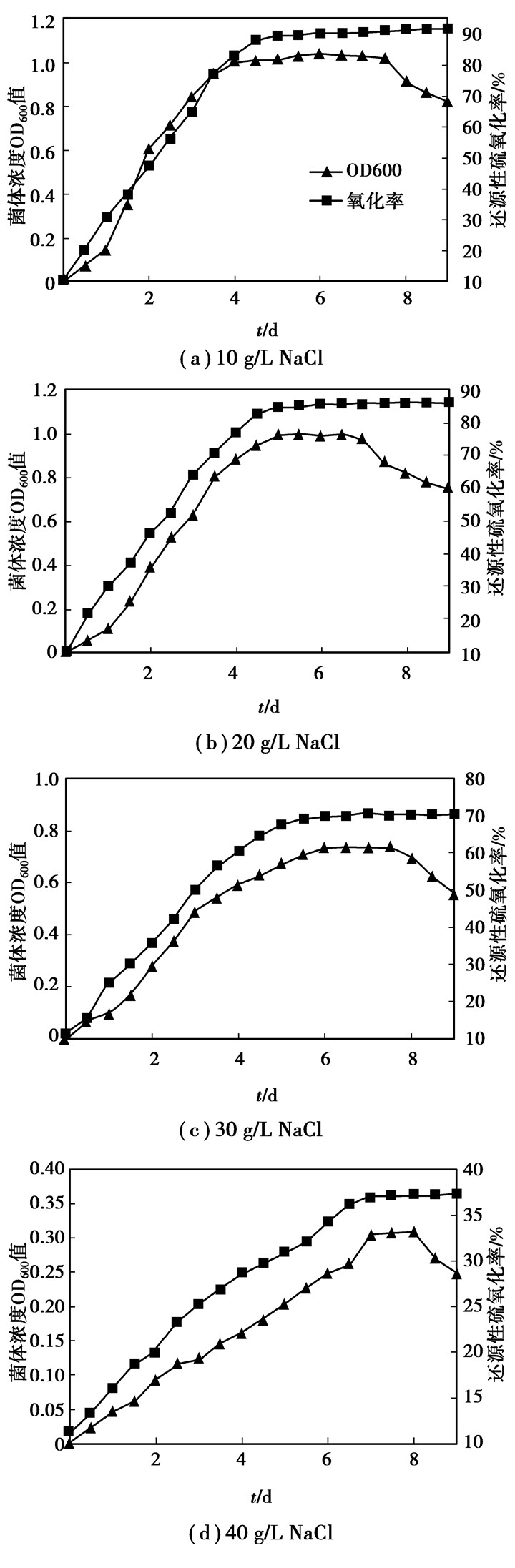
|
图 5 不同质量浓度NaCl对驯化后的菌株Z-2的生长及氧化率的影响 |
1) 氮源种类。氮是微生物必不可少的营养元素之一,微生物对底物中的氮、磷等营养元素的利用具有一定的选择性。分别在含无机盐以及70 g/L Na2SO3、10 g/L Na2S2O3、20 g/L NaCl的废水培养基中加入相同氮量的NaNO3、NaNO2、NH4Cl、(NH4)2SO4、尿素,培养5 d。不同氮源种类对菌株氧化活性的影响如图 6所示。可以看出,菌株可以吸收和利用多种氮源完成对还原性无机硫化合物的氧化。其中,氯化铵和硫酸铵最易被菌体利用并完成生物氧化过程,但从氧化率来看使用硫酸铵作为氮源对生物氧化更为有利;硝酸钠和亚硝酸钠不易被吸收且氧化率会因此降低;以尿素为氮源会在一定程度上影响菌株的生物氧化。因此,硫酸铵为本试验的最佳氮源。
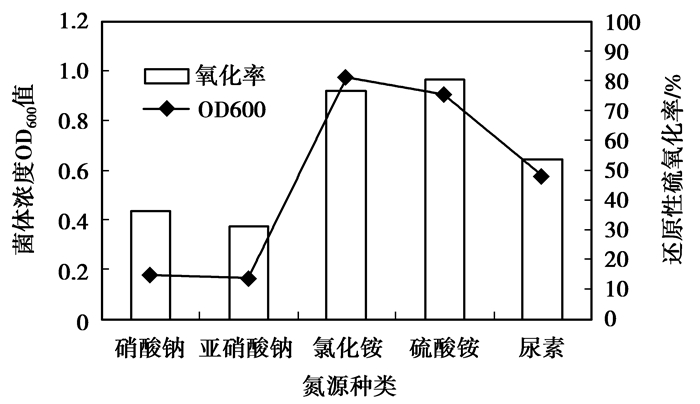
|
图 6 氮源种类对菌株Z-2生物氧化作用的影响 |
2) 氮源用量。考察硫酸铵用量对菌株生物氧化过程的影响,结果见图 7。由图 7可以看出,随着硫酸铵用量的增加,不论是菌体质量浓度还是还原性硫化合物的氧化率都有所增加,但从2 g/L开始,增加不再明显,此时氧化率近90%。因此硫酸铵的最佳用量应该为2 g/L。
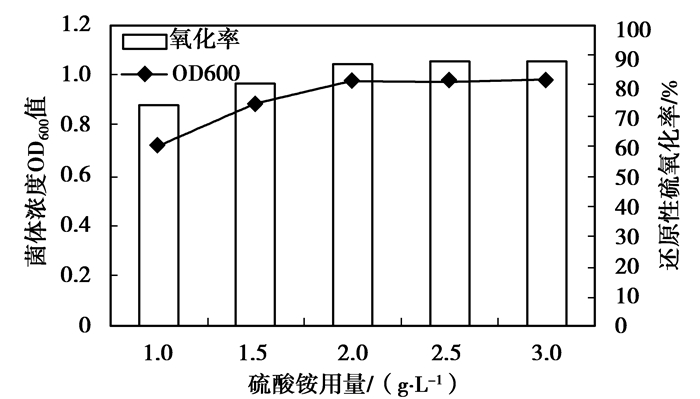
|
图 7 硫酸铵质量浓度对菌株Z-2生物氧化作用的影响 |
通过调节不同的培养基初始pH(图 8),得出的试验结果表明菌株Z-2生物氧化过程的最佳pH为7.5(实际污水的pH为8)。如果pH呈酸性,菌株的生长及还原性硫化合物的氧化过程都会受到较大影响。而pH超过7.5以后的碱性环境中,菌株的生长及氧化率会受到较小影响,较酸性环境效果要好很多。这说明培养基初始pH对菌株的氧化能力影响很明显,在培养过程中采用一个稳定而适当的pH值范围(如加入极少量硫酸进行调配)尤其重要,其中碱性环境比酸性环境更利于菌株生长,这与Buisman等研究的利用无色硫细菌进行废水脱硫所得出的碱性最适pH结论相似[20]。
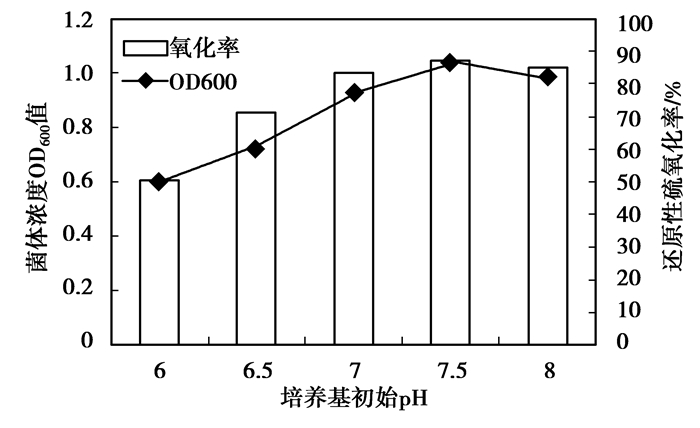
|
图 8 培养基初始pH对菌株Z-2生物氧化作用的影响 |
温度是影响微生物生长和代谢的环境条件中最为明显的一个因素,当温度在某一特定的范围内上升时,微生物的生长和代谢会逐渐上升到某一极限,超过此极限,细胞机能就会急剧下降。通过温度调节,得到了菌株Z-2不同温度下的生长及生物氧化状况,结果见图 9。从图中可以看出,在25~35 ℃时,随着温度的增加菌体质量浓度与氧化率都有所提高,而超过35 ℃后,随着温度上升菌体质量浓度与氧化率迅速下降,因此可以得出培养菌株Z-2的最适温度为35℃。
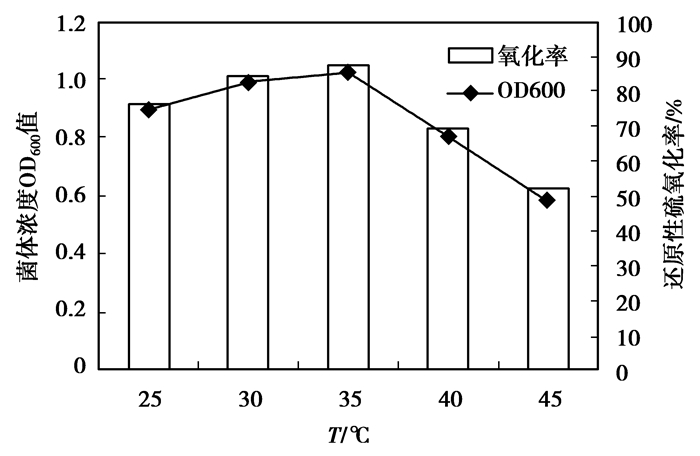
|
图 9 温度对菌株Z-2生物氧化作用的影响 |
综合上述优化后的最佳培养条件,配置高质量浓度模拟废水(NaCl 20 g/L,Na2SO3 70 g/L,Na2S2O3 10 g/L,(NH4)2SO4 2 g/L作唯一氮源)的无机盐培养基,在35 ℃下绘制菌株的生长曲线以及生物氧化率随时间变化的曲线,如图 10所示。在最优条件下,菌体生长良好,其OD600值最大可达1.069,5 d后生长趋于平缓,氧化率达到85%以上;之后增长缓和,最终达到95%左右。从而表明菌株Z-2具有较强的耐高盐性和氧化活性。通过模拟污水最终的COD测定,经菌株Z-2氧化后的废水COD从18 176 mg/L降到3 064 mg/L,去除率为85%。可见相比于传统的处理方法而言,Z-2可以氧化高浓度还原性硫化合物,且其最适pH以及温度均与实际污水(分别为pH8,温度38 ℃)贴近,符合工业应用的要求。
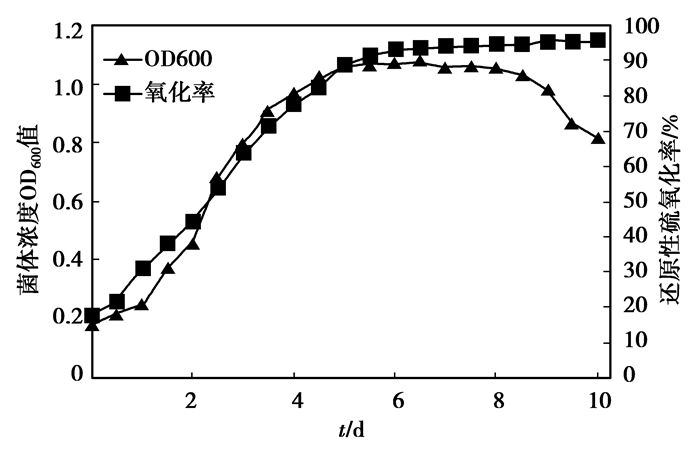
|
图 10 最优培养条件下Z-2的生长曲线及氧化率变化曲线 |
1) 由某热电厂钠法脱硫废水出水口处取得的污泥中,经过筛选、分离以及对以亚硫酸钠为主的还原性硫氧化和耐受高质量浓度NaCl的驯化后,得到一株能够在高盐环境下无需有机碳源且能高效氧化还原性硫化合物的菌株Z-2。
2) 菌株Z-2对NaCl有一定的耐受性,当NaCl质量浓度高达20 g/L时,对菌株的生长以及生物氧化过程仍没有影响,氧化率达到90%以上。
3) 菌株Z-2的生物氧化还原性硫的最优培养条件为以质量浓度2 g/L的(NH4)2SO4作唯一氮源,调节初始pH 7.5,温度35℃,NaCl质量浓度20 g/L,在此条件下对菌株完成生物氧化过程最为有利。同时得出Z-2具备工业应用水平的结论(实际废水NaCl质量浓度为20 g/L,pH值为8,温度为38 ℃)。
4) 经培养基组成和培养条件的优化,菌株Z-2的生物氧化性能得到了一定程度的提升。最终在组分为NaCl 20 g/L,Na2SO370 g/L,Na2S2O310 g/L的模拟废水培养基中,还原性硫化物的氧化率达到95%左右,COD去除率达85%。
| [1] |
石斌.
关于燃煤燃煤工业锅炉节能减排技术的研究[J]. 科技风, 2011(12): 36–36.
SHI Bin. Research on coal-fired coal-fired industrial boiler energy conservation and emission reduction technology[J]. Technology Trend, 2011(12): 36–36. DOI:10.3969/j.issn.1671-7341.2011.12.026 (in Chinese) |
| [2] |
王治安, 林卫, 李冰.
脱硫废水零排放处理工艺[J]. 电力科技与环保, 2012, 28(6): 37–38.
WANG Zhian, LIN Wei, LI Bing. Discussion on process of desulfurization waste water's zero-draining disposal[J]. Electric Power Environmental Protection, 2012, 28(6): 37–38. (in Chinese) |
| [3] |
杨发祥.
浅谈电厂脱硫废水及其处理工艺[J]. 中国高新技术企业, 2010(4): 105–107.
YANG Faxiang. Introduction to power plant desulfurization wastewater and its treatment process[J]. China Hi-Tech Enterprises, 2010(4): 105–107. (in Chinese) |
| [4] |
周艳娟, 闻学宇.
火力发电厂废水处理与回用的研究[J]. 中小企业管理与科技, 2011(21): 217–218.
ZHOU Yanjuan, WEN Xueyu. Research on thermal power plant wastewater treatment and reuse[J]. Management & Technology of SME, 2011(21): 217–218. DOI:10.3969/j.issn.1673-1069.2011.21.202 (in Chinese) |
| [5] |
侯金山.
火电厂脱硫废水处理工艺的改进和新工艺的探讨[J]. 节能环保技术, 2008, 1(1): 29–31.
HOU Jinshan. Coal-fired power plant desulfurization wastewater treatment process improvements and new process[J]. Energy Conservation & Environment Protection, 2008, 1(1): 29–31. (in Chinese) |
| [6] |
盘思伟, 姚唯健, 程诺伟.
F-Ca二阶段沉淀法处理湿法脱硫废水的应用分析[J]. 节能与环保, 2008(8): 38–40.
PAN Siwei, YAO Weijian, CHENG Nuowei. Analysis of "F-Ca two stage deposition" method applied in the treatments of wet desulphurization wastewater[J]. Energy Conservation and Environment Protection, 2008(8): 38–40. (in Chinese) |
| [7] |
周栩, 周鹏.
火电厂脱硫废水处理设计与运行[J]. 安全.健康和环境, 2011, 11(2): 23–26.
ZHOU Xu, ZHOU Peng. Design and operation of desulfurization wastewater treatment device in thermal power plant[J]. Safety Environment Health, 2011, 11(2): 23–26. (in Chinese) |
| [8] | Jong G A H, Tang J A, Bos P, et al. Purification and characterization of a sulfite:cytochrome c oxidoreductase from Thiobacillus acidophilus[J]. Journal of Molecular Catalysis B:Enzymatic, 2000, 8(1): 61–67. |
| [9] | Tsuyoshi S, Ami A. Sulfite oxidation catalyzed by aa3-type cytochrome c oxidase in acidithiobacillus ferrooxidans[J]. Bioscience Biotechnology, and Biochemistry, 2010, 11(2): 2242–2247. |
| [10] | Wang L D, Zhao Y, Li Q W, et al. Intrinsic oxidation kinetics of sulfite catalyzed by peracetic acid under different water quality and light conditions[J]. Science in China Series B:Chemistry, 2009, 52(1): 109–116. DOI:10.1007/s11426-008-0154-9 |
| [11] | 喻晖. 高盐度下菌群的驯化及其对染料废水脱色的实验研究[D]. 辽宁: 大连理工大学硕士学位论文, 2005. |
| [12] |
于娟, 吕秀蓉, 陈永立, 等.
密闭消解法用于快速测定炼厂废水COD[J]. 新疆石油科技, 2009, 19(1): 45–48.
YU Juan, Lü Xiurong, CHEN Yongli, et al. Sealed digestion method for rapid determination of refinery wastewater COD[J]. Xinjiang Petroleum Science & Technology, 2009, 19(1): 45–48. (in Chinese) |
| [13] | Qiu J A, Wilson H L, Rajagopalan K V. Structure-based alteration of substrate specificity and catalytic activity of sulfite oxidase from sulfite oxidation to nitrate reduction[J]. Biochemistry, 2012, 51(6): 1134–1147. DOI:10.1021/bi201206v |
| [14] | Kletzin A. Oxidation of sulfur and inorganic sulfur compounds in Acidianus ambivalens[J]. Microbial Sulfur Metabolism, 2008, 8(4): 184–201. |
| [15] | 魏复盛. 水和废水监测分析方法[M]. 3版. 北京: 中国环境科学出版社, 1989. |
| [16] |
曹媛, 王娟, 钟秦.
微生物烟气脱硫工艺中硫化物生物氧化与回收单质硫的研究[J]. 中国电机工程学报, 2011, 31(29): 48–54.
CAO Yuan, WANG Juan, ZHONG Qin. Study on the sulfide biological oxidation and recycle elementary sulfur in biological flue gas desulphurization process[J]. Proceedings of the CSEE, 2011, 31(29): 48–54. (in Chinese) |
| [17] |
王惠祥, 姜理英, 吴晓薇, 等.
硫氧化细菌的分离鉴定及降解特性[J]. 应用与环境生物学报, 2011, 17(5): 706–710.
WANG Huixiang, JIANG Liying, WU Xiaowei, et al. Isolation, identification and degradation characteristics of a sulfide-oxidizing bacterium[J]. Chinese Journal of Applied and Environmental Biology, 2011, 17(5): 706–710. (in Chinese) |
| [18] |
祝德义, 李彦春, 靳丽强, 等.
一株嗜盐菌的筛选及异噻銼啉酮对其抑制作用[J]. 中国皮革, 2009, 38(21): 12–15, 25.
ZHU Deyi, LI Yanchun, JIN Liqiang, et al. Isolation of a halophilic bacterial and bacteriostasis of isothiazolone[J]. China Leather, 2009, 38(21): 12–15, 25. (in Chinese) |
| [19] |
郭昌梓, 薛少青, 高军锋.
无色硫细菌的培养及其生长环境条件研究[J]. 陕西科技大学学报:自然科学版, 2008, 26(1): 66–70.
GUO Changzi, XUE Shaoqing, GAO Junfeng. Cultivation of colorless sulfur bacteria and study on the growth conditions[J]. Journal of Shaanxi University of Science and Technology:Natural Science Edition, 2008, 26(1): 66–70. (in Chinese) |
| [20] | Buisman C J N, Lettinga G, Paasschens C W M, et al. Biotechnological sulfide removal from effluent[J]. Water Science & Technology, 1991, 24(3/4): 347–356. |
 2013, Vol. 36
2013, Vol. 36


