2. 四川大学 皮革化学与工程教育部重点实验室, 成都 610065
2. The Key Laboratory of Leather Chemistry and Engineering, Ministry of Education, Sichuan University, Chengdu 610065, China
研究表明,稀土(La,Ce)和铁等多价金属氧化物及其盐类因对水中的F-,H2AsO4-,H2AsO42-,H2PO4-,H2PO42-等阴离子具有较强的亲和力成为研究热点[1],但这些稀土和金属盐因成本高[2]、稳定性差[3]和再生困难不能被直接利用。因此,将某些稀土和金属氧化物负载在不同的基质上可以制得集基质自身特点与对有害阴离子的高吸附容量和高选择性于一体的新型吸附剂,同时可以改善材料的表面结构和性质,提高其处理阴离子的能力、增强材料的重复使用性[4]。例如,碳纳米管负载氧化铝(Al2O3/CNT)的除氟能力是活性炭、AlC-300活性炭和α-氧化铝的15~25倍[5],稀土复合铁氧化物(CFA)的除砷能力是活性氧化铝的2倍,同时其微晶体结构提高了吸附剂的稳定性[6],虽然这类吸附剂的吸附效果较常规材料大有提高,但仍存在金属离子易脱落而降低其吸附性能等问题。
胶原纤维是结构性蛋白质,不溶于水,但具有亲水性,主要存在于动物的皮中,传统用作制革原材料。由于它是动物机体的重要功能组成物质,具有良好的生物相容性和降解性,在医药、食品、化妆品等非制革领域也有广泛的用途[7]。笔者利用胶原纤维富含羧基、氨基、羟基等多种官能团可以与金属离子形成稳定配合物的特性[8],将锆、铝、铁等对水中氟离子具有较强亲和力的金属氧化物负载在胶原纤维上,制备了一种高效新型除氟吸附剂(MICF),探讨该材料的制备条件,并采用X射线衍射(XRD)、红外光谱(IR)和X射线光电子能谱(XPS)等方法对其吸附性质和吸附机理进行了研究。
1 试验部分 1.1 试验试剂NaF、Al2(SO4)3·18H2O、Fe2(SO4)3、NaCl、NaNO3、Na2SO4等试剂为分析纯;Zr(SO4)2为工业品,ZrO2含量为31.48%。
1.2 实验材料 1.2.1 胶原纤维胶原纤维的制备方法与文献方法相同[9],以牛皮为原料,主要包含原料皮的清洗、碱处理、剖皮、脱碱、缓冲液处理、脱水、干燥和研磨等工序。
1.2.2 MICF材料的制备和类型取15 g胶原纤维在400 mL蒸馏水中浸泡约4 h, 用H2SO4和HCOOH将其pH值调到1.5~2.0,加入一系列不同摩尔比的锆(Zr(Ⅳ)),铝(Al(Ⅲ))和铁(Fe(Ⅲ))的金属盐,室温下反应8 h,用质量分数为10%的碳酸氢钠将溶液的pH缓慢调至3.8~4.2,再在45 ℃反应6 h。反应物经蒸馏水多次冲洗过滤后,于50 ℃下真空干燥12 h,分别得到锆(ZrCF)、铝(AlCF)和铁(FeCF)的吸附材料。
1.3 试验方法 1.3.1 静态吸附性能评价吸附容量比较(等温吸附实验):将0.100 g吸附材料置于滤纸袋中,用蒸馏水浸泡12 h后挤去水分,各放入100 mL氟离子质量浓度为38 mg/L的溶液中;于303 K下振荡吸附24 h,用氟离子选择电极法(电极Q/YXLG128)测定吸附后溶液中氟离子的质量浓度,由吸附前后质量浓度的变化计算平衡吸附量,以每g吸附剂吸附氟离子的mg数表示(mg/g)。
1.3.2 离子强度和共存无机阴离子对吸附的影响方法与1.3.1相同,考察离子强度影响时,氟离子的初始质量浓度分别为19、38、57、76、95 mg/L;溶液的离子强度用NaNO3调节(NaNO3的浓度分别为0.5、1 mol/L);考察共存无机阴离子的影响时,氟离子的初始质量浓度为19 mg/L,共存无机阴离子Cl-、NO3-、SO42-(所加盐分别为NaCl、NaNO3、Na2SO4)的质量浓度分别为10、20、40、60、80 mg/L。
1.3.3 材料特征的表征采用JSM-5900LV型扫描电子显微镜(SEM)表征ZrCF的形貌特征;用Perkin Elmer公司的型FTIR光度计进行红外光谱(IR)的测试。
1.3.4 等电点的测定材料的等电点采用固相分布法[10]测定。称取0.1 g样品置于100 mL蒸馏水中,用HCl和KOH使溶液的pH分布在适当的范围,并于25 ℃振荡72 h,然后测定各三角瓶中溶液的pH,记为pH1,再向各瓶中加入0.5 mL浓度为2 mol/L的KCl溶液,振荡3 h后测定其pH,记为pH2,计算△pH(△pH= pH2-pH1),△pH对pH作图,曲线与△pH=0的交点即为样品的电荷零点。
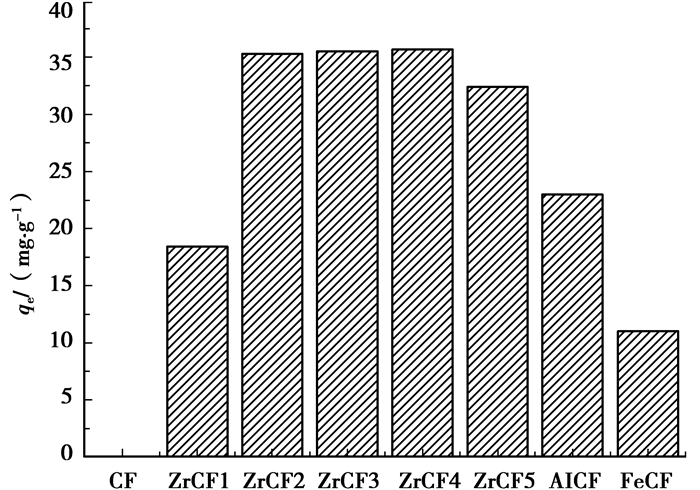
2 结果与讨论 2.1 吸附剂的制备对除氟的影响 2.1.1 几种MICF吸附剂的除氟性能比较在氟离子初始质量浓度38 mg/L,自然pH,吸附剂用量0.1 g,吸附24 h,303 K的条件下,胶原纤维(CF),ZrCF(负载量分别为0.05、0.1、0.15、0.20 mol的吸附材料ZrCF1,ZrCF2,ZrCF3,ZrCF4)氧化锆(ZrCF5),AlCF,FeCF的除氟效果见图 1。结果表明胶原纤维负载锆(ZrCF)的除氟效果最好,其平衡吸附量远远高于载体胶原纤维(CF),氧化锆(ZrCF5),胶原纤维负载铝(AlCF)和胶原纤维负载铁(FeCF)。随着材料中Zr(Ⅳ)含量的增加,ZrCF除氟能力也逐渐增强。但当Zr(Ⅳ)的负载量大于0.1 mol后,材料对氟的吸附量增加不明显。用等离子体发射光谱(ICP PerKinElmer OPTIMA2100DV)分析制备反应溶液中Zr(Ⅳ)的残余量,发现负载量为0.20 mol的制备液中Zr(Ⅳ)的含量较高,即0.2 mol Zr4+中有很多未被负载,说明胶原纤维对Zr(Ⅳ)的负载能力已达到饱和。因此后续实验中确定Zr(Ⅳ)的负载量为0.1 mol。因此,后续的实验中选定负载量为0.1 mol ZrCF为主要的研究对象。
|
图 1 不同制备材料的除氟效果比较 |
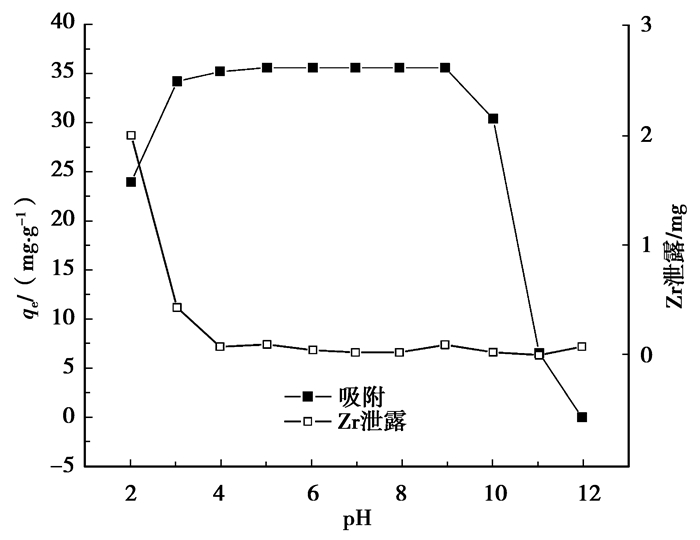
pH值对氟离子平衡吸附量的影响如图 2所示。由图 2可知, 在pH4~9范围内,材料对氟离子均有较显著的吸附效果,吸附容量的变化不明显。在pH < 4.0和pH(9.0时,平衡吸附量都降低。这是因为当pH值较低时,H+浓度高,氟离子的存在形态主要是未离解的HF(KHF=1.5×103)或HF2-(KHF2-=3.9),降低了溶液中游离氟离子的浓度,氟的吸附量减小;而当溶液的pH值较高时,OH-浓度也较高,OH-与氟离子竞争吸附材料上有限的吸附位点,从而造成氟的吸附量下降[11]。同时,对溶液中Zr4+的泄露浓度进行了测定,由图 2可知,在pH为4~9范围内,溶液中Zr4+在0.2 mg以下,pH值对材料吸附氟离子的影响非常小,ZrCF材料在使用时金属离子基本不脱落。本研究浓度范围内,氟离子溶液的自然pH为5.6~5.8,因此后续的研究均在自然pH条件下进行。
|
图 2 溶液pH对ZrCF的影响 |
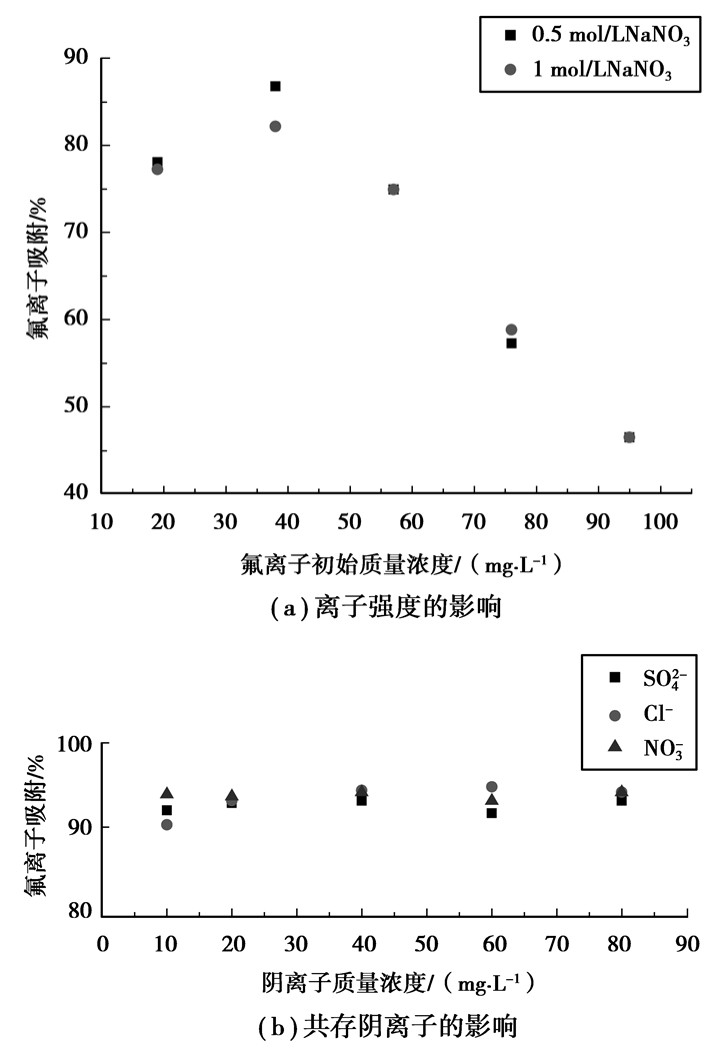
离子强度对ZrCF吸附效果的影响如图 3(a)所示。由图可知,离子强度在0.5~1 mol/L范围内材料对氟离子的吸附影响不大。而由图 3(b)所示的试验结果来看,自然pH条件下,水中常见的无机阴离子(Cl-,NO3-,SO42-)均未显示出ZrCF材料对吸附氟离子的干扰效应。
|
图 3 离子强度和共存阴离子对平衡吸附量的影响 |
图 4为ZrCF材料的SEM图像。由负载前CF的SEM图像(图 4(a))可以看出载体纤维表面光滑,纤维间隙清晰可见;而负载Zr后材料的SEM图像(图 4(b))则表明Zr均匀地分散在胶原纤维上,没有明显的金属沉积物。载体纤维表面变得粗糙不平,纤维被Zr氧化物覆盖、包裹以致难以发现纤维间隙。

|
图 4 ZrCF的SEM图像 |
通过固相分布法计算的CF和ZrCF的等电点(pHPZC)可知,CF的等电点约为6.0,与文献报道相符[9],而ZrCF的等电点位于9.0附近,说明负载金属离子后,胶原纤维表面带正电荷,等电点升高。溶液的pH值低于9.0时,吸附剂趋于形成正电表面(-M-OH2+),有利于氟离子的吸附;而高于此值时吸附剂表面带负电,与溶液中的F-发生排斥作用,造成F-的吸附量下降,这与2.1.2所得的结果一致。可见非特性吸附是ZrCF除氟的机制之一,因为非特性吸附涉及Coulomb作用力,主要由低于pHPZC的与pH相关的吸附位点决定[12]。但由2.1.4结论可知这种吸附与溶液的离子强度和共存阴离子的浓度基本无关,说明非特性吸附不是ZrCF最主要的除氟机理[3]。
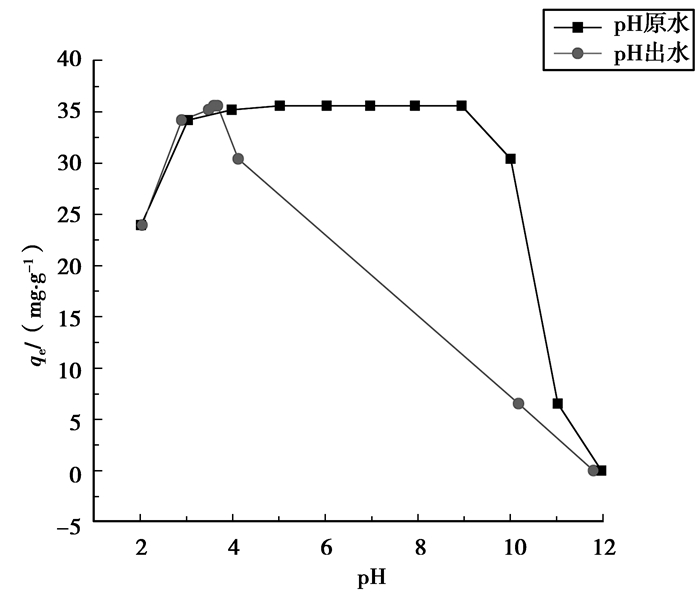
2.2.2 ZrCF材料除氟的作用机理由图 5看出,吸附后原溶液的pH均降低,尤其在4~9之间原溶液的pH值明显降低,而在pH <3和pH>10时,pH值变化不大。这恰与2.1.2中ZrCF在不同pH溶液中对氟的吸附容量变化趋势相同,反映了吸附剂表面羟基数和电荷数的改变。吸附后pH降低说明溶液中的H+含量增加,即吸附时有H+被释放出来,因此,与许多除氟材料类似,氟的吸附机理可能主要属于离子交换和/或配位络合作用,但由于溶液pH值的变化趋势相反,因此被交换的基团并不是OH-[13-14]而是H+。反应机理推测如下[14-19]:
| $ \begin{array}{l} \equiv {\rm{Zr}} - {\rm{OH}} + {{\rm{H}}^ + } \leftrightarrow \equiv {\rm{Zr}} - {\rm{O}}{{\rm{H}}_2}^ + , \\ \equiv {\rm{Zr}} - {\rm{O}}{{\rm{H}}_{\rm{2}}}^{\rm{ + }} + {{\rm{F}}^ - } \leftrightarrow \equiv {\left[{{\rm{Zr}}-\left( {{\rm{OH}}} \right){\rm{F}}} \right]^ - } + {{\rm{H}}^ + }。\end{array} $ | (1) |
|
图 5 ZrCF吸附氟离子前后溶液pH值 |
金属水合氧化物无机吸附材料的表面金属配位羟基对阴离子的吸附机制起着重要作用,其吸附机理可以通过IR光谱中的表面振动结构得到比较合理的阐述[20]。吸附氟离子前后ZrCF的IR光谱图如图 6所示。材料中羧基上的羟基表现为3 330~3 600 cm-1的OH的伸缩振动;由于参于了与金属离子的配位[21]使COO的伸缩频率由1 658 cm-1(CF中COO-的伸缩谱带)位移至1 648 cm-1。1 547、1 451、1 335 cm-1是反映氨基酸类物质于1 700~1 250 cm-1有精细结构的大范围吸收的特征谱带[22];金属表面羟基通常出现在1 200 cm-1以下,在1 600 cm-1没有弯曲振动模式,这是金属表面羟基与H—OH的不同之处。图中吸附前的IR光谱表明材料在1 130 cm-1处出现了M—OH的伸缩振动模式强峰[23]。
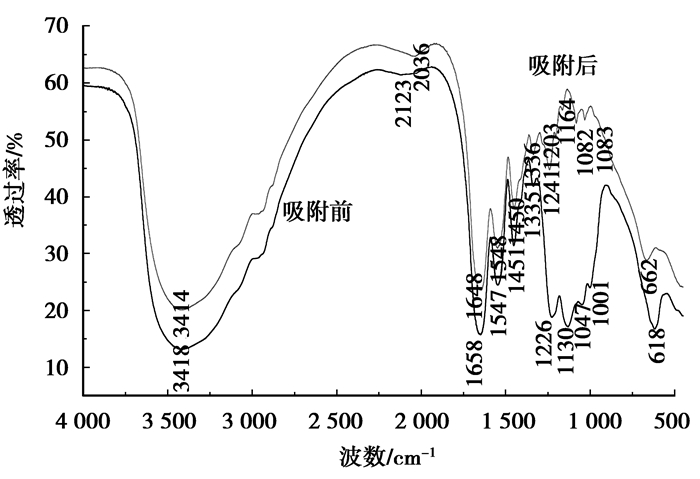
|
图 6 ZrCF的FTIR图 |
ZrCF吸附氟后,1 130 cm-1处的峰完全消失,但在662 cm-1处出现一新的吸收峰,为M—F键的伸缩振动产生[21-22],并且用NaOH解吸后该峰消失。可见ZrCF材料中的表面活性羟基在氟离子吸附过程中起重要作用。吸附剂对阴离子的吸附包括特性吸附和非特性吸附,特性吸附涉及阴离子与吸附剂表面羟基的配位体交换反应[24];Stunn等[25]提出的表面络合理论认为,以羟基化的氧化物为主的吸附材料其表面羟基参与各种氧化物水界面的配体交换和络合反应,是决定材料对阴离子吸附和离子交换能力的主要因素之一。张昱等[26]的研究表明铈铁金属氧化物表面羟基可以与阴离子形成表面络合物,吸附过程中伴随溶液pH的变化;Akio等[19]的研究表明氟离子在固载锆(Ⅳ)凝胶表面的吸附属于配位交换机理,即氟离子与锆(Ⅳ)表面的水合羟基发生配位交换作用;结合前面有关2.2.1中等电点和2.2.2中吸附前后溶液pH的变化的表述,可以推测氟离子在吸附过程中与锆的表面羟基发生配位络合作用,释放出H+,导致溶液pH值降低;因此,ZrCF除氟的作用机制是以配位交换的特性吸附为主,以静电吸附的非特性吸附为辅的吸附。
3 结论胶原纤维负载金属离子的制备实验表明,负载0.1 mol的锆的吸附材料的除氟效果最好;吸附实验表明,ZrCF材料适宜的除氟pH范围是4.0~9.0,吸附过程中被负载的Zr4+基本不脱落;与一般吸附剂如活性氧化铝q=0.96 mg/g[27]、活性炭q=0.075 mg/g[27]、聚合树脂q=3.62 mg/g[27]、骨煤q=0.75 mg/g[28]、氧化铁q=3.0 mg/g[29]相比,ZrCF具有吸附容量高(q=57.94 mg/g),pH适用范围广(pH4~9)的优点。离子强度和水中常见的阴离子对ZrCF材料除氟基本无影响;材料表征结果表明负载Zr4+使胶原纤维的等电点上升,有利于氟离子这种阴离子的吸附去除,红外光谱和吸附前后溶液中pH值的变化表明,ZrCF除氟的作用机制是以配位交换的特性吸附为主,以静电吸附的非特性吸附为辅的吸附作用。
| [1] | Tokunage S, Wasay S A, Park S W. Removal of arsenic(Ⅴ) ion from aqueous solutions by lanthanum compounds[J]. Water Science and Technology, 1997, 35(7): 71–78. |
| [2] | Tokunaga S, Harron M J. Removal of fluoride ion from aqueous soltion by multival mental compounds[J]. International Journal of Environmental Studies, 1995, 48: 17–28. DOI:10.1080/00207239508710973 |
| [3] | Pierce M L, Moore C B. Adsorption of arsenite and arsenate on amorphous iron hydroxide[J]. Water Research, 1982, 16(7): 1247–1253. DOI:10.1016/0043-1354(82)90143-9 |
| [4] | Wasay S A., Haron M J, Tokunaga S. Adsorption of fluoride, phosphate, and arsenate ions on lanthanum-impregnated silica gel[J]. Water Environment Research, 1996, 68(3): 295–300. DOI:10.2175/106143096X127730 |
| [5] | Li Y H, Wang S G, Cao A Y, et al. Adsorption of fluoride from water by amorphous alumina supported on carbon nanotubes[J]. Chemical Physics Letters, 2001, 350(5/6): 412–416. |
| [6] | Zhang Y, Yang M, Huang X. Arsenic(Ⅴ) removal with a Ce(Ⅳ)-doped iron oxide adsorbent[J]. Chemosphere, 2003, 51(9): 945–952. DOI:10.1016/S0045-6535(02)00850-0 |
| [7] | Lee C H, Singla A, Lee Y Y. Biomedical applications of collagen[J]. International Journal of pharmaceutics, 2001, 221(1/2): 1–22. |
| [8] | Evans N A, Milligan B, Montgomery K C. Collagen crosslinking:new binding sites for mineral tannage[J]. Journal of the American Leather Chemists Association, 1987, 82(4): 86–95. |
| [9] |
吕绪庸.
略论分析单宁用皮粉的生产[J]. 林产化学与工业, 2000, 20(1): 71–74.
LYU Xuyong. A brief discussion on manufacture of hide powder for tannin analysis[J]. Chemistry and Industry of Forest Products, 2000, 20(1): 71–74. (in Chinese) |
| [10] | Tripathy S S, Kanungo S B. Adsorption of Co2+, Ni2+, Cu2+ and Zn2+ from 0.5 M NaCl and major ion sea water on a mixture of δ-MnO2 and amorphous FeOOH[J]. Journal of Colloid Interface Science, 2005, 284: 30–38. DOI:10.1016/j.jcis.2004.09.054 |
| [11] |
王曙光, 李延辉, 赵丹, 等.
碳纳米管负载氧化铝材料的制备及其吸附水中氟离子的研究[J]. 高等学校化学学报, 2003, 24(1): 95–99.
WANG Shuguang, LI Yanhui, ZHOU Dan, et al. Studies on the preparation of alumina supported on carbon nanotubes and defluorination from absorbed water[J]. Chemical Journal of Chinese University, 2003, 24(1): 95–99. (in Chinese) |
| [12] | Hingston F J, Atkinson R J, Posner A M, et al. Specific adsorption of anions[J]. Nature, 1967, 215: 1459–1461. DOI:10.1038/2151459a0 |
| [13] | Ning A R, Xu Y M, Zhao J. Preparation and defluorination performance of activated Cerium(Ⅳ) oxide/SiMCM-41 adsorbent in water[J]. Journal of Collide and Interface Science, 2001, 235(1): 66–69. DOI:10.1006/jcis.2000.7344 |
| [14] | Liao X P, Ding Y, Wang B, et al. Adsorption behavior of Phosphate on metal-ions-loaded collagen fiber[J]. Industry & Engineering Chemistry research, 2006, 45(11): 3896–3901. |
| [15] |
黄彦杰, 廖学品, 石碧.
胶原纤维固载铁对砷As(Ⅴ)的吸附特性[J]. 皮革科学与工程, 2007, 17(2): 10–14.
HUANG Yanjie, LIAO Xuepin, SHI Bi. Adsorption of As(Ⅴ) by ferric immobilized collagen fiber[J]. Leather Science and Engineering, 2007, 17(2): 10–14. (in Chinese) |
| [16] |
焦中志, 陈忠林, 杨敏, 等.
无机铈基吸附剂的合成及对氟的吸附研究[J]. 南京理工大学学报:自然科学版, 2004, 28(5): 542–546.
JIAO Zhongzhi, CHEN Zhonglin, YANG Min. Synthesization of inorganic cerium ferrous adsorbent and its adsorption of fluoride ion[J]. Journal of Nanjing University of Science and Technology:Nature Science, 2004, 28(5): 542–546. (in Chinese) |
| [17] | Tor A, Danaoglu N, Arslan G, et al. Removal of fluoride from water by using granylar red mud:batch and column studies[J]. Journal of Harzardous Materials, 2009, 164(1): 271–278. DOI:10.1016/j.jhazmat.2008.08.011 |
| [18] | Eskandarpour A, Onyango M S, Ochieng A, et al. Removal of fluoride ions from aqueous solution at low pH using schwertmannite[J]. Journal of Hazardous Materials, 2008, 152(2): 571–579. DOI:10.1016/j.jhazmat.2007.07.020 |
| [19] | Yuchi A, Matsuo K. Adsorption of anions to zirconium(Ⅳ) and titanium(Ⅳ) chemically immobilized on gel-phase[J]. Journal of Chromatography A, 2005, 1082(2): 208–213. DOI:10.1016/j.chroma.2005.05.049 |
| [20] | Atkinson R J, Parfitt R L, Smart R S C. Infra-red study of phosphate adsorption on goethite[J]. Journal of the Chemical Society, Faraday Transactions 1:Physical Chemistry in Condensed Phases, 1974, 70: 1472–1479. |
| [21] | 中本一雄. 无机和配位化合物的红外和拉曼光谱[M]. 黄德如, 汪仁庆, 译. 北京: 化学工业出版社, 1986. |
| [22] | 卢瀼泉, 邓振华. 实用红外光谱解析[M]. 北京: 电子工业出版社, 1989. |
| [23] | Nakamoto K. Infrared and roman spectra of inorganic and coordination compounds[M]. 3rd ed. New York: John Wiley, 1978. |
| [24] | Nriagu J O. Arsenic in the environment[M]. New York: John Wiley, 1994. |
| [25] |
杨敏, 豆小敏, 张昱.
固液界面吸附机制与模型:"环境水质学前言专栏"序言[J]. 环境科学学报, 2006, 26(10): 1581–1585.
YANG min, DOU Xiaomin, ZHANG Yu. Mechanism and models of adsorption process on solid/water interface[J]. Acta Scientiae Circumstantiae, 2006, 26(10): 1581–1585. DOI:10.3321/j.issn:0253-2468.2006.10.001 (in Chinese) |
| [26] |
张昱, 豆小敏, 杨敏, 等.
砷在金属氧化物/水界面上的吸附机制Ⅰ.金属表面羟基的表征和作用[J]. 环境科学学报, 2006, 26(10): 1586–1591.
ZHANG Yu, DOU Xiaomin, YANG min, et al. Adsorption mechanism of arsenic on metal oxide adsorbent Ⅰ.characterization and the role of metal surface hydroxyl group[J]. Acta Scientiae Circumstantiae, 2006, 26(10): 1586–1591. DOI:10.3321/j.issn:0253-2468.2006.10.002 (in Chinese) |
| [27] | Medellin-Castillo N A, Leyva-Ramos R, Ocampo-Perez R, et al. Adsorption of fluoride from water solution on bone char[J]. Industry and Engineering Chemistry Research, 2007, 46(26): 9205–9212. DOI:10.1021/ie070023n |
| [28] | Kaseva M E. Optimization of regenerated bone char for fluoride removal in drinking water:a case study in Tanzania[J]. Journal of Water Health, 2006, 4(1): 139–147. |
| [29] | Kumar E, Bhatnagar A, Ji M, et al. Defluoridation from aqueous solutions by granular ferric hydroxide (GFH)[J]. Water Research, 2009, 43(2): 490–498. DOI:10.1016/j.watres.2008.10.031 |
 2013, Vol. 36
2013, Vol. 36

