镁及镁合金在生物医用材料领域的潜在应用前景近年来引起了研究者们的兴趣[1-3]。主要缘于镁及镁合金与常用金属生物材料相比,与人体骨组织有更为相近的力学性能和优良的生物相容性;且镁与人体健康密切相关,能够加强骨骼强度[4]。另外,利用镁及合金的易腐蚀性,将其发展成为可降解金属植入材料,可免除金属惰性生物材料长期存留体内所导致炎症和二次手术的烦恼,使镁基生物材料具有诱人的发展前景。
由于镁基材料腐蚀速率过快,而新骨长成速度慢,康复期较长,即降解速度需要控制,另外镁基材料的生物活性也不理想尚需改善[5-6]。有机物质形成的自组装单分子膜改性技术(SAMs)是近年来发展的材料表面生化改性的新方法:SAMs成膜分子的头基与基材表面通过化学键链接,形成紧密而有序的二维单分子膜层,末端基团如-CH3,-NH2,-OH,-PO4H2,-COOH等,能使膜层具有特殊的物理化学性质和功能[7-9]。笔者利用硬脂酸对纯镁表面进行有机自组装单分子膜改性处理,探讨改性的工艺以及改性层对材料腐蚀行为和生物活性的影响,为改善镁金属在生理环境中的腐蚀行为和生物活性提供借鉴。
1 试验材料及方法 1.1 试样前处理将纯度为99.99%的铸态纯镁(4N-Mg)切割成20 mm×10 mm×5mm的长方体,以水砂纸打磨至800#,试样分别于乙醇和蒸馏水中超声清洗,将试样分成3组,分别进行3种预处理:①酸蚀碱液预处理(HCL-NaOH),即在3%的盐酸中清洗10s后放入1mol/L的NaOH水溶液中浸泡1h,取出后用蒸馏水清洗。②碱热预处理(Alkali-heat)[10],即试样浸泡于过饱和NaHCO3-MgCO3混合溶液中24h,干燥后在773K保温10h。③热预处理(Heat),即试样放在773K保温10h,然后用蒸馏水清洗干燥。
1.2 正交试验以预处理方式,硬脂酸乙醇溶液浓度和试样浸泡时间为因素进行L9(33)正交试验。硬脂酸溶液浓度分别为0.01,0.10,0.50mol/L;浸泡时间分别为1,1.5,2 h。
将SAMs处理后的试样在SBF溶液中浸泡3d,根据溶液的pH值变化进行评分,优选工艺方案。SBF溶液中离子的种类和浓度见表 1。
| 表 1 仿生体液中离子的种类和浓度 |
1) 动电位扫描测试。对试样进行动电位扫描以评价硬脂酸改性试样的腐蚀抗力。设备为LKII98B(Tianjin Lanlike chemical and electron high technology Co., LTD)电化学测试工作站。测试是在SBF溶液中由传统的三电极系统进行,辅助电极和参比电极分别为铂电极和饱合甘汞(SCE)。
2) 静态水接触角的测量。用滴液测量SAM处理前后试样表面的水接触角(Future Digital Sicetific Ascia Inc)。滴液法为30 s内测定的表面膜层液滴接触角,反映了SAM膜层-空气界面的亲水性。试验用精度为0.1 μL的微量注射器吸取5μL蒸馏水滴于试样表面,在显微镜(10×)下读数并拍照观察液滴轮廓。每个样品表面重复5次测试并计算平均值。
3) 仿生溶液浸泡试验。根据正交试验优选出的工艺进行改性处理,并将改性前后的试样放入SBF中浸泡,以10 mm2/mL的试样表面积和溶液体积比进行,测量SBF溶液pH值的变化,每隔2 d换液。用原子吸收光谱分析浸泡未处理和热有机处理试样SBF溶液中7 d后的镁离子浓度(此2组未换溶液)。采用扫描电子显微镜SEM-EDS(Amray-X2000, 20 kV;XL30-TMP, 20 kV)对SBF溶液浸泡试样的表面形貌和元素组成进行观察分析。
2 试验结果与分析 2.1 正交试验结果和分析以pH值变化为标准,对正交实验组进行分析。pH变化越小评分越低,其抗腐蚀性能越好。图 1为各因素水平值对因数水平性能的影响。从3种预处理的效果来看,经过热处理的最佳,HCL-NaOH处理的最差;硬脂酸溶液的浓度越高,试样的抗腐蚀性就越好,表明浓度越高越有利于吸附成膜;膜层形成的时间1.5h最优,不同处理时间结果差别较小。各影响因素的极差分析表明,影响因素的重要性排序为:硬脂酸的浓度>预处理方法>硬脂酸溶液中浸泡时间。根据以上分析,可以得出本实验的最优处理工艺是:以热处理为预处理方式、在0.5 mol/L硬脂酸溶液中浸泡1.5 h。
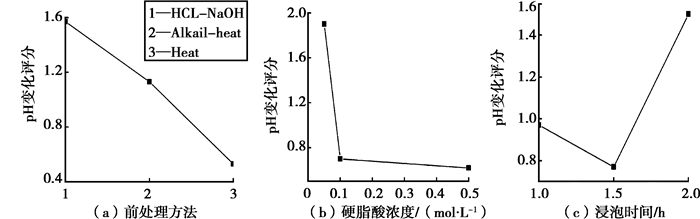
|
图 1 各因素水平对抗腐蚀性能的影响 |
就不同的前处理方法而言,在热处理和碱热处理后,试样表面均由MgO组成[10],但热处理后的试样表面较光滑;在HCl-NaOH处理后试样表面是光亮而整洁的Mg。根据已有的报道[11],脂肪酸和金属组装时可以由金属离子与-COO-之间形成离子键合,由此,硬脂酸能够由Mg2+和-COO-之间的离子键合而结合在基体表面,而羧酸电离产生的H+则可能与镁表面的O或-OH结合;而HCl-NaOH-SAM与基底弱的键连接导致了较弱的腐蚀抗力。
2.2 动电位扫描结果由动电位极化方法测得的试样在SBF溶液中腐蚀电流密度见表 2。结果表明,SAMs处理明显提高了试样在SBF中的腐蚀抗力。其中,腐蚀电流密度最大的是未经处理的纯镁(0.12 mA/cm2),而腐蚀电流密度最低的是热-有机处理试样(0.026 mA/cm2),约为纯镁的1/5;HCl-NaOH-SAM处理的试样在自组装处理组中最高,表明对于硬脂酸自组装膜,HCl-NaOH前处理对于形成耐蚀性的有机膜层效果不佳。
| 表 2 试样电化学腐蚀速率表 |
为了衡量该自组装膜的缓蚀效果,通过式(1)来计算有机改性处理的缓蚀效率η[12]:
| $ \eta = \left( {I_{{\rm{corr}}}^0 - {I_{{\rm{corr}}}}} \right)/I_{{\rm{corr}}}^0, $ | (1) |
式中:Icorr0、Icorr分别为未处理和组装了SAMs的试样的腐蚀电流密度。
经过热自组装改性的试样缓蚀效率可达78.3%。
2.3 接触角测量结果接触角的测量结果如图 2和表 3所示,从表中数据可以看出,热处理后试样表面接触角略有减小,在热-有机处理后试样的接触角增大明显,说明此硬脂酸膜明显改变了材料的表面状态,使其具有疏水性能。

|
图 2 材料的静态水接触角 |
| 表 3 试样的静态水接触角 |
由前述分析,硬脂酸通过Mg2+和-COO-的离子键合在基体表面结合,那么SAM的尾基即为疏水的烷链,它改变了试样表面的润湿性,形成了疏水的表面状态,从而提高了材料的耐腐蚀性。
2.4 仿生溶液浸泡结果和分析 2.4.1 浸泡试样的SBF溶液pH变化浸泡试样的SBF溶液pH变化如图 3所示,在浸泡的最初2d,SAMs处理的试样所在的SBF溶液pH变化较未经有机处理组的试样变化缓慢,显示出较好耐蚀性;SBF换液以后各组试样的腐蚀速率相比前2d均变缓慢,这可能是由于试样表面腐蚀物的沉积和阻隔作用,各组差异减小。
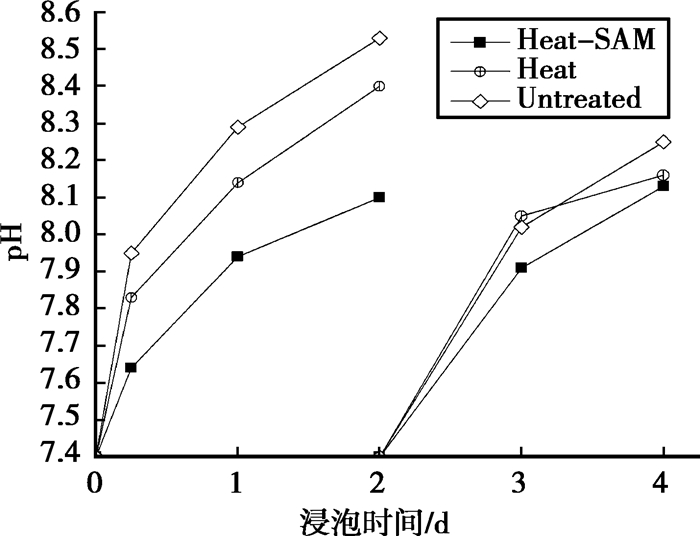
|
图 3 SBF溶液pH值随时间的变化 |
原子吸收光谱方法测得的SBF溶液中Mg2+浓度如表 4所示,经过热有机改性试样的SBF溶液Mg2+浓度最低,仅为66 mg/L,而未经处理的SBF溶液Mg2+浓度达到92 mg/L,这与前面pH变化和电化学腐蚀速率结果一致,显示出SAMs有利于材料耐蚀性提高。
| 表 4 SBF溶液中的镁离子浓度变化及腐蚀速率 |
对于相对均匀的腐蚀形式,可以根据镁离子浓度变化采用腐蚀的深度指标来计算腐蚀速度。将金属失重腐蚀速度换算为腐蚀深度的公式,每年的腐蚀深度(CR,mm/y)就可按下式计算[13]:
| $ \mathit{CR = }{\rm{8}}{\rm{.76}} \times {\rm{1}}{{\rm{0}}^4}W/StD, $ | (2) |
| $ \mathit{W} = \left( {{K_{\rm{n}}} - {K_{{\rm{n}} - 1}}} \right)V \times {\rm{1}}{{\rm{0}}^{ - 3}}, $ | (3) |
式中:W为腐蚀失重,g;S为试样原始表面积,cm2;t为两次测量镁离子浓度间隔时间,h;D为试样密度,1.738 g/cm3;V为SBF体积,L;K为溶液中镁离子浓度,mg/L。
根据离子浓度变化,由公式(4)可计算单位面积每天镁的腐蚀质量M(mg/(cm2·d))。
| $ \mathit{M} = \left( {{K_{\rm{n}}} - {K_{{\rm{n}} - 1}}} \right)V/St, $ | (4) |
式中:t为两次测量镁离子浓度间隔时间,d。
从表 4可以看出,4N-Mg的耐腐蚀性能已经在较高的水平上,热有机处理后能使其腐蚀速度明显降低,腐蚀深度由0.17 mm/y降至0.09 mm/y。
2.4.3 SBF浸泡后试样表面的形貌和成分分析将未处理纯镁浸泡于SBF中,立刻有少量气泡析出,在扫描电镜下观察到7d时表面已形成大小不等的腐蚀坑,也有不均匀的白色粒状物分布(见图 4(a)),在放大的形貌照片(见图 4(b))下还可以看到深浅不同的网状分布的裂纹。与未处理的纯镁不同,由于自组装膜提高了试样的抗腐蚀性,试样显示了较慢的腐蚀速度,Heat-SAM试样浸泡初期只有极少气泡慢慢产生,吸附在试样表面。在扫描电镜下观察到7d时试样显示出较为均匀的腐蚀形貌,表面有微小的点蚀痕迹和白色半球状物,以及由于Heat-SAM处理后形成的网状裂纹(见图 4(b))。总体来说,4N-Mg显示了相对较均匀的腐蚀过程,表明其具有较高的抗腐蚀能力,而SAMs处理进一步提高了材料的腐蚀抗力。

|
图 4 试样在SBF浸泡7d后的SEM表面形貌 |
试样在SBF溶液中浸泡7d后表面成分的EDS分析结果如表 5所示。由于通过区域分析各区间成分差别不大,因此将区域分析的表面成分结果平均后列于表 5。可以看出,试样改性处理前后的表面成分均主要由C、O、Mg、P、Ca组成,改性试样上还有少量的Na和Cl元素;但各元素所占的百分比差别明显,尤其是P、Ca元素的含量,SAMs改性试样表面P、Ca元素含量更高,质量百分比分别约为10%和12%,而未改性试样基体上还未达到3%。从EDS分析结果来看,SAMs处理试样在SBF浸泡过程中Ca、P元素增加速度比未改性纯镁明显更高,显示出更好的生物活性。
| 表 5 在SBF中浸泡7d的试样表面成分 |
自组装膜对试样的生物活性的影响,目前已有报道-COOH,-PO4H2等官能团能诱导钙磷盐的形成,但-CH3对生物活性影响不明显[14-15]。根据前述分析,本方法获得的自组装膜尾基应为-CH3,试验结果所显示的促进碳酸盐或磷酸盐的沉积作用,考虑可能是由于SAMs提高了材料的腐蚀抗力,从而降低了环境中的Mg2+浓度。根据Mg2+对钙磷盐沉积影响的报道[16-17],认为过高浓度的镁会阻碍或者延迟Ca-P相的形核和长大,即SAMs抑制了镁离子的析出,从而有利于碳酸盐或磷酸钙盐的沉积,具体还需要更进一步的研究。
3 结论1) 正交试验表明,本实验条件下最佳处理工艺为:以热处理为预处理方式,在0.5 mol/L硬脂酸溶液中浸泡1.5h。影响性能的主要因素为硬脂酸的浓度和预处理方法,在镁表面形成光滑的MgO层有利于硬脂酸自组装膜的形成。
2) 硬脂酸自组装膜对试样的抗腐蚀行为有较大的影响,尤其是热-有机处理试样显示了较好的抗腐蚀行为,其电流密度最低(26 μA/cm2), 缓蚀效率可达78.3%,腐蚀速度由0.17 mm/y降为0.09 mm/y。
3) 经硬脂酸自组装改性处理的试样呈现了更为均匀的腐蚀,并且较快地使P、Ca元素沉积在试样表面,显示出改性处理有利于材料生物活性的改善。
| [1] | Staigera M P, Pietak A M, Huadmai J, et al. Magnesium and its alloys as orthopedic biomaterials:A review[J]. Biomaterials, 2006, 27(9): 1728–1734. DOI:10.1016/j.biomaterials.2005.10.003 |
| [2] | Witte F. The history of biodegradable magnesium implants:a review[J]. Acta Biomaterialia, 2010(6): 1680–1692. |
| [3] | Xin Y, Hu T, Chu P K. In vitro studies of biomedical magnesium alloys in a simulated physiological environment:a review[J]. Acta Biomaterialia, 2011, 7(4): 1452–1459. DOI:10.1016/j.actbio.2010.12.004 |
| [4] | Okuma T. Magnesium and bone strength[J]. Nutrition, 2001, 17: 679–680. DOI:10.1016/S0899-9007(01)00551-2 |
| [5] | Kirkland N T, Lespagnol J, Birbilis N, et al. A survey of bio-corrosion rates of magnesium alloys[J]. Corrosion Science, 2010, 52(2): 287–291. DOI:10.1016/j.corsci.2009.09.033 |
| [6] | Liu G Y, Hu J, Ding Z K, et al. Bioactive calcium phosphate coating formed on micro-arc oxidized magnesium by chemical deposition[J]. Applied Surface Science, 2011, 257(6): 2051–2057. DOI:10.1016/j.apsusc.2010.09.050 |
| [7] | Abraham U. Formation and structure of self-assembled monolayer[J]. Chemical Reviews, 1996, 96(4): 1533–1554. DOI:10.1021/cr9502357 |
| [8] | Majewski P J, Allidi G. Synthesis of hydroxyapatite on titanium coated with organic self-assembled monolayers[J]. Materials Science and Engineering:A, 2006, 420(1/2): 13–20. |
| [9] | Ferretti S, Paynter S, Russell D A, et al. Self-assembled monolayers:a versatile tool for the formulation of bio-surfaces[J]. TrAC Trends in Analytical Chemistry, 2000, 19(9): 530–540. DOI:10.1016/S0165-9936(00)00032-7 |
| [10] | Li L C, Gao J C, Wang Y. Evaluation of cyto-toxicity and corrosion behavior of alkali-heat-treated magnesium in simulated body fluid[J]. Surface and Coating Technology, 2004, 185(1): 92–98. DOI:10.1016/j.surfcoat.2004.01.004 |
| [11] | Oberg K, Persson P, Shchukarey A, et al. Comparison of monolayer films of stearic acid and methyl stearate on an Al2O3 surface[J]. Thin Solid Films, 2001, 397(1/2): 102–108. |
| [12] | Vracar L M, Drazi D M. Adsorption and corrosion inhibitive properties of some organic molecules on iron electrode in sulfuric acid[J]. Corrosion Science, 2002, 44(8): 1669–1680. DOI:10.1016/S0010-938X(01)00166-4 |
| [13] | 李久青, 杜翠薇. 腐蚀试验方法及监测技术[M]. 北京: 中国石化出版社, 2007. |
| [14] | Ma C L, Lu H B, Wang R Z, et al. Comparison of controlled crystallization of calcium phosphates under three kinds of monolayers[J]. Journal of Crystal Growth, 1997, 173(1/2): 141–149. |
| [15] | Tanahashi M, Matsuda T. Surface functional group dependence on apatite formation on self-assembled monolayers in a simulated body fluid[J]. Journal of Biomedical Materials Research, 1997, 34(3): 305–315. DOI:10.1002/(ISSN)1097-4636 |
| [16] | Kibalczyc W, Christoffersen J, Christoffersen M R, et al. The effect of magnesium ions on the precipitation of calcium phosphates[J]. Journal of Crystal Growth, 1990, 106(2/3): 355–366. |
| [17] | TenHuisen K S, Brown P W. Effects of magnesium on the formation of calcium-deficient hydroxyapatite from CaHPO4·2H2O and Ca4(PO4)2O[J]. Journal of Biomedical Materials Research, 1997, 36(3): 306–314. DOI:10.1002/(ISSN)1097-4636 |
 2013, Vol. 36
2013, Vol. 36

