2. 重庆科技学院 化学化工学院, 重庆 401331
2. School of Oil and Gas Engineering, Chongqing University of Science and Technology, Chongqing 401331, China
金属腐蚀是社会生活与工业发展中的常见现象。金属腐蚀后会使其许多性能大大降低,更重要的是金属结构的破坏所产生的巨大经济损失和环境危害。在众多防腐措施中,向腐蚀介质添加有机化合物作为缓蚀剂是一种简单有效、经济实用的方法。随着人们环保意识的提高,一些无毒、易降解、生物相容性好的药品作为缓蚀剂被开发应用于金属防腐领域[1]。研究发现喹诺酮类[2]、磺胺类[3]头孢唑类[4]药物在酸性介质中对碳钢有较好的缓蚀效果,磺胺甲恶唑(Sulfamethoxazole)[5]和替硝唑(Tinidazole)[5]在3%HCl溶液中对45#钢有较好的缓蚀性能。
等温吸附模型是用于研究有机缓蚀剂分子与金属表面作用机制最简单有效的手段。通过拟合不同浓度下的实验数据可以得到,特定介质中某一缓蚀剂在某种金属表面的吸附作用规律,进而求得吸附平衡常数(kads)、吸附反应吉布斯自由能(ΔGadso)等,但是在前期研究中发现,磺胺甲恶唑和替硝唑的缓蚀性能随着有机分子浓度的增加先增大到某一极大值,随后缓蚀剂浓度的增加会造成缓蚀性能的降低。Ksenija[5]在研究4-硝基吡唑在HCl中对铁的缓蚀性能,以及Tavakoli[6]研究硫酸介质中十二烷基苯磺酸钠对铜的腐蚀抑制行为时也发现了类似现象。对于这种现象,还需进行深入研究。
由于一个恒定参数的等温吸附方程并不能有效说明整个实验浓度范围内缓蚀剂分子在金属表面的吸附行为,现尝试利用分段拟合的方法,分别得到缓蚀效率极值前后有机分子在金属表面的等温吸附方程,进一步阐明有机缓蚀剂与金属基体的作用规律。
1 吸附理论与实验数据 1.1 吸附方程在水相腐蚀体系中,溶剂水分子会优先吸附在金属表面上。所以水相中有机缓蚀剂分子[Org(sol)]在金属表面的吸附就是一个取代金属表面水分子[H2O(ads)]的过程:
| $ {\rm{Org}}\left( {{\rm{ads}}} \right) + \mathit{x}{{\rm{H}}_2}{\rm{O}}\left( {{\rm{ads}}} \right) \leftrightarrow {\rm{Org}}\left( {{\rm{ads}}} \right) + \mathit{x}{{\rm{H}}_2}{\rm{O}}\left( {{\rm{sol}}} \right), $ |
式中x称为体积因数,表示一个有机缓蚀剂分子取代水分子的个数。根据不同的吸附模型与理论假设可以建立不同的等温吸附方程,但所有的等温吸附方程可以表示成统一的形式:
| $ f\left( {\theta, x} \right){\rm{exp}}\left( { - 2\alpha {\rm{ }}\theta } \right) = kc, $ |
式中:f(θ, x)是由吸附物理模型及其理论假设确定的结构因子;θ是金属表面覆盖率;c是缓蚀剂质量浓度,mol/L;x是体积因数;α是有机分子作用参数;k是吸附反应平衡常数。
腐蚀体系中,研究缓蚀剂分子在金属表面的吸附过程中普遍使用的等温吸附方程是Langmuir、Frumkin和Temkin 3种:
| $ {\rm{Langmuir}}:\;\frac{\theta }{{1 - \theta }} = {k_{{\rm{ads}}}}\cdot c, $ |
| $ {\rm{Frumkin}}:\;\frac{\theta }{{1 - \theta }} \cdot {\rm{exp}}\left( { - 2\alpha \cdot \theta } \right) = {k_{{\rm{ads}}}}\cdot c, $ |
| $ {\rm{Temkin}}:\;{\rm{exp}}\left( { - 2\alpha \cdot \theta } \right) = {k_{{\rm{ads}}}}\cdot c, $ |
式中:分子间作用参数α,当其为正值时,表示吸附在金属表面的有机分子之间存在相互作用的引力,为负值时,其之间为斥力。
1.2 数据来源在前期研究工作中,利用45#钢挂片在室温静态环境下失重实验、极化曲线、交流阻抗研究了293 K温度下,在3%HCl溶液中磺胺甲恶唑和替硝唑对45#钢的吸附缓蚀行为,得到的缓蚀效率(IE)分别用IEw(%)、IEP(%)、IEi(%)表示(如表 1~2所示)。磺胺甲恶唑和替硝唑优化后的几何结构如图 1所示。此外,为增强所得吸附方程的准确性,利用失重实验增加了部分实验数据。所有数据如表 1、2所示。
| 表 1 磺胺甲恶唑在3%HCl溶液中对45#钢的缓蚀效率 |
| 表 2 替硝唑在3%HCl溶液中对45#钢的缓蚀效率 |
|
图 1 优化后的几何结构 |
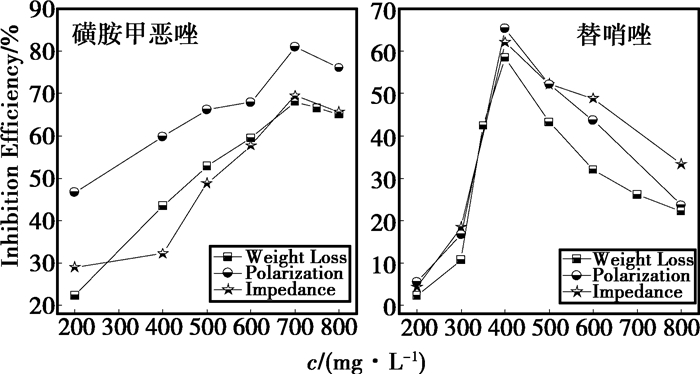
利用失重实验、极化曲线和交流阻抗得到的3%HCl溶液中磺胺甲恶唑和替硝唑对45#钢缓蚀效率IEw(%)、IEP(%)、IEi(%)如图 2所示。从图 2可以看出,虽然不同的实验方法得到的IE结果有一定的差别,但是3种实验方法得到IE随着缓蚀剂质量浓度的变化趋势是一致的。首先,IE随着缓蚀剂质量浓度的增加而增大,达到一个极值之后,随着缓蚀剂质量浓度的增加,IE持续降低。
|
图 2 在3%HCl溶液中,磺胺甲恶唑和替硝唑的缓蚀效率随其质量浓度的变化 |
在水相腐蚀体系中,缓蚀剂分子取代部分水分子覆盖了金属表面的部分活性点。一般假设腐蚀反应只发生在未被缓蚀剂分子覆盖的活性点处,所以可用失重实验得到的IE(%)计算金属表面的覆盖率:
| $ \theta = {\rm{IE}}\left( \% \right)/100。$ |
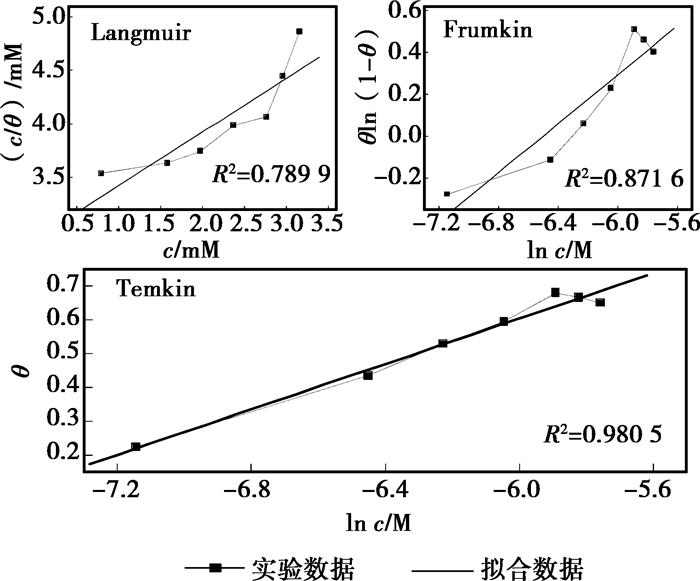
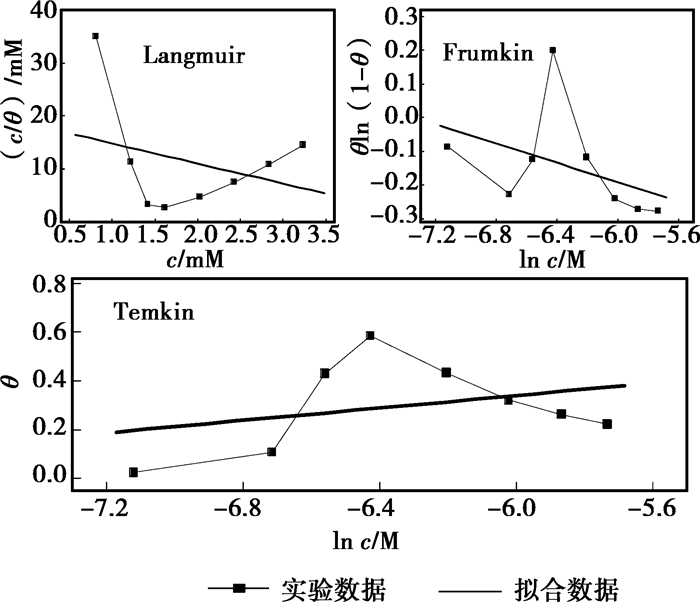
使用上述Langmuir、Frumkin、Temkin 3种等温吸附方程拟合磺胺甲恶唑和替硝唑在3%HCl溶液中对45#钢的IE实验结果,分别如图 3和图 4所示。由图 3可以看出,恒定参数的Langmuir和Frumkin等温吸附方程并不能解释3%HCl溶液中磺胺甲恶唑在45#钢的吸附规律。Temkin方程在低浓度(200~700 mg/L)时与实验数据相吻合,但是高浓度范围(700~800 mg/L)的拟合效果不好。而对于图 4中替硝唑在45#钢表面的吸附规律,3种吸附方程在整个浓度范围内均不适用。但是在磺胺甲恶唑的Temkin等温吸附图中,可以观察到θνsln c曲线有两段不同的线性区,并且替硝唑的Temkin图中,也有类似现象。
|
图 3 Langmuir、Frumkin和Temkin等温吸附方程对于磺胺甲恶唑IE的拟合结果 |
|
图 4 Langmuir, Frumkin和Temkin等温吸附方程对于替硝唑IE的拟合结果 |
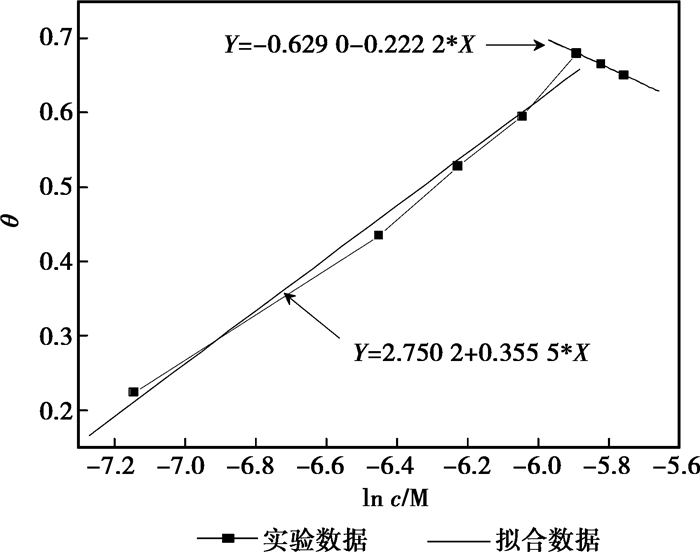
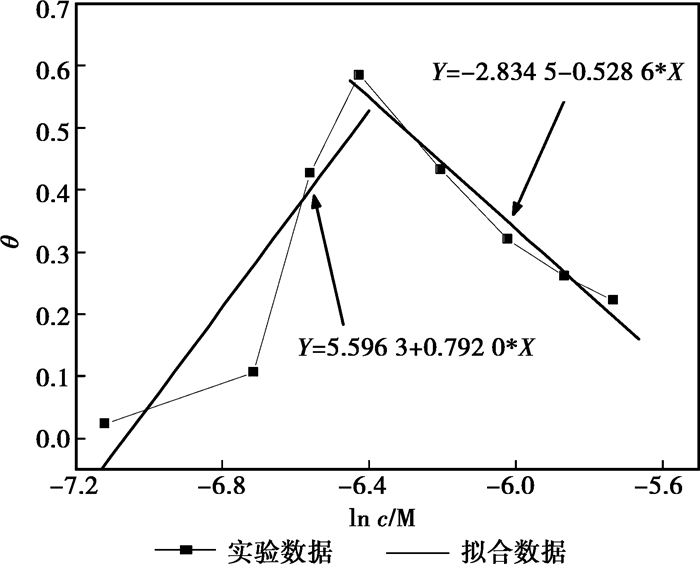
为了更好地阐明缓蚀剂分子在整个浓度范围内与金属表面的作用规律,采用分段拟合的方法得到不同浓度范围内磺胺甲恶唑和替硝唑在45#钢表面的Temkin吸附模型(磺胺甲恶唑和替硝唑分别以其IE极值点对应的质量浓度700 mg/L和400 mg/L为浓度范围分界点)。拟合结果如图 5和图 6所示。
|
图 5 3%HCl溶液中磺胺甲恶唑在45#钢表面的分段Temkin吸附模型 |
|
图 6 3%HCl溶液中替硝唑在45#钢表面的分段Temkin吸附模型 |
根据Temkin等温吸附方程的θνsln c曲线,可以从该曲线的斜率和θ轴的截距得到被吸附分子之间的作用参数α和吸附反应平衡常数kads。由kads可以进一步计算吸附反应标准吉布斯自由能(ΔGadso):
| $ (\Delta G_{{\rm{ads}}}^o) = - RT{\rm{ln}}(55.5{k_{{\rm{ads}}}}), $ |
式中55.5表示水分子的摩尔浓度,即腐蚀介质中水为55.5 mol/L。根据Temkin等温方程计算所得磺胺甲恶唑和替硝唑在不同浓度范围内吸附反应参数如表 3所示。
| 表 3 不同浓度范围内Temkin吸附反应参数 |
比较3%HCl溶液中,磺胺甲恶唑或替硝唑在不同质量浓度范围内的Temkin吸附反应参数,分子间作用参数α均由低浓度范围内(磺胺甲恶唑:200~700 mg/L,替硝唑:200~400 mg/L)的负值变为高质量浓度范围内(磺胺甲恶唑:700~800 mg/L,替硝唑:400~800 mg/L)的正值。前面已经提到,在Temkin吸附模型中,α为正值,表示被吸附的分子之间存在相互作用的引力,为负值时,则被吸附分子之间存在斥力。不同质量浓度范围内α值的变化说明随着缓蚀剂浓度的升高,缓蚀剂分子之间的相互作用由斥力变成引力。吸附平衡常数kads表示吸附质在金属表面的吸附/脱附倾向。一般来说kads的值越大,缓蚀剂分子在金属表面的吸附反应速率与脱附速率之差越大,缓蚀剂分子更易于吸附在金属表面。磺胺甲恶唑或替硝唑在不同质量浓度范围内kads的差异说明在低浓度范围内缓蚀剂分子更易在金属表面形成稳定吸附膜。
此外,磺胺甲恶唑或替硝唑在金属界面吸附反应的标准吉布斯自由能ΔGadso均为负值,说明在各种情况下缓蚀剂分子在金属界面的吸附反应均是自发进行的。一般认为ΔGadso的值大于-20 kJ/mol,吸附反应是静电引力作用下的物理吸附;其值小于-40 kJ/mol,缓蚀剂分子与金属表面之间的相互作用是发生了电子转移的化学吸附;在两值之间,物理吸附和化学吸附都参与缓蚀剂分子与金属表面的相互作用。由此可以看出,除了磺胺甲恶唑在高质量浓度范围内只发生物理吸附以外,其余情况缓蚀剂分子在金属表面的吸附行为均是由物理吸附与化学吸附共同参与的。还有,吸附反应ΔGadso值也反映了缓蚀剂分子在金属表面的吸附性能,其值越小,表示该情况下缓蚀剂分子越易吸附在金属表面,本文中由ΔGadso值的变化得出的结果与kads说明的问题也是相一致的。
上述现象可以由质量浓度变化造成溶液内缓蚀剂结构的改变进行解释。在酸液中缓蚀剂分子会发生质子化从而带正电荷,带同种正电荷的缓蚀剂分子之间存在相互作用的斥力,而磺胺甲恶唑和替硝唑在水相中随着质量浓度的升高其疏水聚集的倾向也越来越大, 吸附在金属表面的缓蚀剂分子呈增多趋势。在低质量浓度范围内,带正电的缓蚀剂分子由于静电排斥彼此独立,既可以与吸附在金属表面的Cl-发生物理吸附作用,又可以通过S、N中的孤对电子以及苯环、唑环的离域π电子等活性吸附基团和金属表面Fe的d空轨道发生化学作用[7]。而随着缓蚀剂质量浓度的升高,疏水引力在缓蚀剂分子之间起主导作用,导致缓蚀剂分子发生团聚,形成缓蚀剂分子缔合胶体,掩埋了部分活性吸附基团,造成其吸附性能的下降。此外,在高质量浓度范围时,缓蚀剂分子在溶液中的疏水聚集与其在金属表面的吸附会发生竞争关系[8-9],进一步降低缓蚀剂分子在金属表面的吸附性能。而磺胺甲恶唑在高质量浓度范围内由于其较强的疏水引力,使其团聚现象比替硝唑更加严重,几乎掩埋了所有的活性基团,故只发生物理吸附作用。
3 结论由于恒定参数的Langmuir、Frumkin和Temkin等温吸附方程均不能有效解释3%HCl溶液中磺胺甲恶唑和替硝唑于整个质量浓度范围内在45#钢表面的吸附行为,采用分段拟合的方法,建立了基于Temkin等温方程的分段吸附模型。
由该模型计算所得的吸附反应参数说明磺胺甲恶唑和替硝唑在较高质量浓度范围内的吸附性能均不如其在低浓度范围内的吸附性能。这是因为在低质量浓度范围内,缓蚀剂分子由于静电斥力的作用保持相对独立,缓蚀剂分子既可以通过物理作用也可以通过化学作用吸附在金属表面。而随着缓蚀剂质量浓度的升高,疏水引力使缓蚀剂分子发生团聚,造成其吸附性能下降。
| [1] |
陶志华, 张胜涛, 李伟华, 等.
酸介质中三氮唑苯胺化合物在Q235钢表面的吸附及其缓蚀作用[J]. 重庆大学学报, 2010, 33(11): 89–95.
TAO Zhihua, ZHANG Shengtao, LI Weihua, et al. Adsorption and corrosion inhibition behavior of mild steel by one derivative of triazole-phenylamide in acid solution[J]. Journal of Chongqing University, 2010, 33(11): 89–95. DOI:10.11835/j.issn.1000-582X.2010.11.015 (in Chinese) |
| [2] | Pang X H, Ran X B, Kuang F, et al. Inhibiting effect of ciprofloxacin, norfloxacin and ofloxacin on corrosion of mild steel in hydrochloric acid[J]. Chinese Journal of Chemical Engineering, 2010, 18(2): 337–345. DOI:10.1016/S1004-9541(08)60362-6 |
| [3] | Arslan T, Kandemirli F, Ebenso E E, et al. Quantum chemical studies on the corrosion inhibition of some sulphonamides on mild steel in acidic medium[J]. Corrosion Science, 2009, 51(1): 35–47. DOI:10.1016/j.corsci.2008.10.016 |
| [4] | Morad M S. Inhibition of iron corrosion in acid solutions by Cefatrexyl:behaviour near and at the corrosion potential[J]. Corrosion Science, 2008, 50(2): 436–448. DOI:10.1016/j.corsci.2007.08.018 |
| [5] | Zhang G H, Yin L L, Zhang S T, et al. Adsorption behavior of sulfamethoxazole as inhibitor for mild steel in 3%HCI solution[J]. Advanced Materials Research, 2011, 194/195/196: 8–15. |
| [6] | Tavakoli H, Shahrabi T, Hosseini M G. Synergistic effect on corrosion inhibition of copper by sodium dodecylbenzenesulphonate(SDBS)and 2-mercaptoben-zoxazole[J]. Materials Chemistry and Physics, 2008, 109(2/3): 281–286. |
| [7] | Tavakoli H, Shahrabi T, Hosseini M G. Synergistic effect on corrosion inhibition of copper by sodium dodecylbenzene-sulphonate(SDBS)and 2-mercaptobenzoxazole[J]. Materials Chemistry and Physics, 2008, 109(2/3): 281–286. |
| [8] | Yadav D K, Maiti B, Quraishi M A. Electrochemical and quantum chemical studies of 3, 4-dihydropyrimidin-2(1H)-ones as corrosion inhibitors for mild steel in hydrochloric acid solution[J]. Corrosion Science, 2010, 52(11): 3586–3598. DOI:10.1016/j.corsci.2010.06.030 |
| [9] |
唐光临, 白晨光, 欧阳奇.
酸性介质中的钢铁有机缓蚀剂[J]. 重庆大学学报, 2001, 24(1): 144–147.
TANG Guanglin, BAI Chengguang, OU Yangqi. Steel organic corrosion inhibitor in acid medium[J]. Journal of Chongqing University:Natural Science Edition, 2001, 24(1): 144–147. DOI:10.11835/j.issn.1000-582X.2001.01.036 (in Chinese) |
 2013, Vol. 36
2013, Vol. 36



