2. 江西师范大学 鄢阳湖湿地与流域研究教育部重点实验室, 南昌 330022;
3. 水资源高效利用与工程安全国家工程中心, 南京 210098
2. Key Laboratory of Poyang Lake Wetland and Watershed Research, Ministry of Education, Nanchang 330022, China;
3. National Engineering Research Center of Water Resources Efficient Utilization and Engineering Safety, Nanjing 210098, China
在天然水体中,不同阶段优势藻不同,而整个过程中微囊藻成为优势种的时间较长。蓝藻生长的过程可分为下沉越冬、复苏、生物量增加(生长)、上浮及聚集4个阶段。春季的蓝藻复苏是水华形成的关键阶段[1],受到光照、温度、营养盐浓度、扰动等多种因素的影响,随着春季水温的逐步回暖,水体中绿藻、硅藻等藻类也开始复苏[2]。蓝藻是在与绿藻等相互竞争后逐渐成为优势藻种的。为了揭示这种优势藻种的变化机理,现有文献主要从以下几个方面进行了研究。万蕾等[3]和Bucka[4]发现营养盐的不同将影响蓝藻与绿藻之间的相互竞争;郑忠明等[5]和晁建颖等[6]发现温度将影响藻类优势藻种的确立;Hu等[7]得到在营养盐限制条件下,初始藻密度将影响淡水浮游植物优势藻种的确立;光照条件的改变也将影响优势藻种的确立[8-10];水体中铁元素[11-12]、水体中的碱度[13]和氧化还原电位[14]都将影响优势藻种的种类。以上研究都表明优势藻种的确立受环境因子的影响。
一些学者通过野外调查发现水流对藻类的生长具有重要的作用[15-16],而水流对微囊藻优势藻种的确立是否产生影响,且将产生怎样的影响还鲜见报道。因此,本实验选取了蓝藻水华常见的优势种铜绿微囊藻和绿藻水华常见的四尾栅藻,并在控温控光无菌条件下,使用有机玻璃环形槽模拟不同流速进行竞争实验,观测竞争条件下四尾栅藻和铜绿微囊藻的生长,明确水流对优势藻种确立的影响,为进一步控制蓝藻水华提供科学依据。
1 材料及方法 1.1 实验材料实验所用的铜绿微囊藻(Microcystis aeruginosa)和四尾栅藻(Scendesmus quadricauda)均来自中国科学院水生生物研究所。使用BG11培养基[17]将这2种藻培养到对数生长期备用。实验所用的培养基均为:改良后的人工培养基BG11(培养基中NaNO3·4H2O和K2HPO4·3H2O含量,得到TN和TP质量浓度(D)分别为2 mg/L和0.2 mg/L)。
1.2 实验方法将扩大培养的纯藻液接种到高压灭菌的培养基中,微囊藻和四尾栅藻初始接种藻密度分别为20.0× 104 cells/mL和5.0×104 cells/mL(微囊藻密度与四尾栅藻密度比为4:1),光强为40 μmol/m2·s1、25±0.5 ℃,光暗比为14:10 h。每天上午8:45取2 mL培养基移至试管中,振荡摇匀后吸取0.1 mL到0.1 mL微藻计数板上,在双目光学显微镜下进行细胞计数,计数3次取平均值;用灭菌蒸馏水补充蒸发和取样的水。直到实验结束,每个试验水体中累积取出的水量约为25 mL,为总体积的2%,对试验的影响可忽略不计。
1.3 实验装置室内培养模拟实验在小型有机玻璃环形槽中进行,如图 1所示。模拟流速范围为0~50 cm/s,最大容纳培养基1 800 mL,工作体积为1 500 mL。工作原理:叶片在可调电动机的驱动下,推动槽内水体流动产生水流,通过调节电动机转速控制槽内水体的流速。根据太湖水流特征[18],实验设置了5个流速梯度,0、5、15、25、35 cm/s(依次为静止对照、1至4号实验组)。
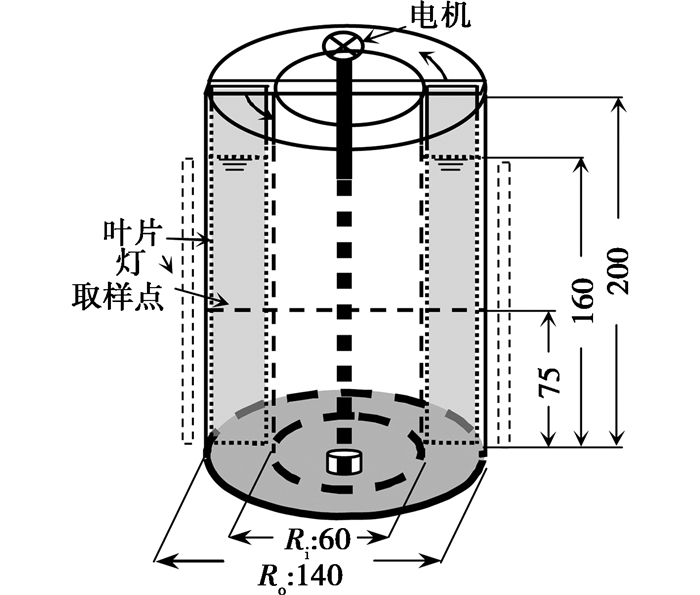
|
图 1 小型有机玻璃环形槽。所有尺寸为毫米 |
实验在光照培养箱中进行,实现了控温、控光,同时避免细菌等的影响,在实验进行前装置采用30 W紫外灯杀菌2~4 h,实验过程中严格无菌操作。实验过程每组设置2个平行样。
1.4 分析方法利用由Lotka[19]在美国和Volterra[20]在意大利各自推导出来Lotka-Volterra竞争模型,计算共培养条件下铜绿微囊藻与四尾栅藻的相互抑制参数。
比增殖速率μ是在某一时间间隔内藻类生长的速率,d-1。其计算公式为:
| $ \mu = {\rm{ln}}\left( {{\mathit{X}_2}/{\mathit{X}_1}} \right)/\left( {{\mathit{t}_2} - {\mathit{t}_1}} \right)。$ | (1) |
式中:X1为某一时间间隔开始时的藻类现存量,cell/mL;X2为某一时间间隔结束时的藻类现存量,cell/mL;t2-t1为某一时间间隔,d。先按式(1)计算每组试验的比增殖速率,再选出每组试验的最大比增殖速率。
2 实验结果 2.1 微囊藻和四尾栅藻生长曲线将不同流速下单独培养和混合培养中微囊藻和四尾栅藻密度随时间的变化曲线,分别作图,如图 2、3所示。从图 2可以看出,在富营养水平下单培养和竞争混合培养微囊藻生长周期分别为10 d和13 d;单独培养下水体流动促进了微囊藻的生长,并随流速的增加而增加,在35 cm/s时达到最大值;混合培养条件下,水流对微囊藻生长的影响发生改变,流速在5 cm/s时微囊藻生长最好,随流速的增加对微囊藻生长抑制作用就越大,静止对照组中微囊藻的生长仅低于5 cm/s下微囊藻的生长。单培养和混合培养条件下微囊藻都经历了适应期和对数生长期;单独培养条件下微囊藻经历了明显衰败期,而混合培养条件下微囊藻经历了明显的稳定期。
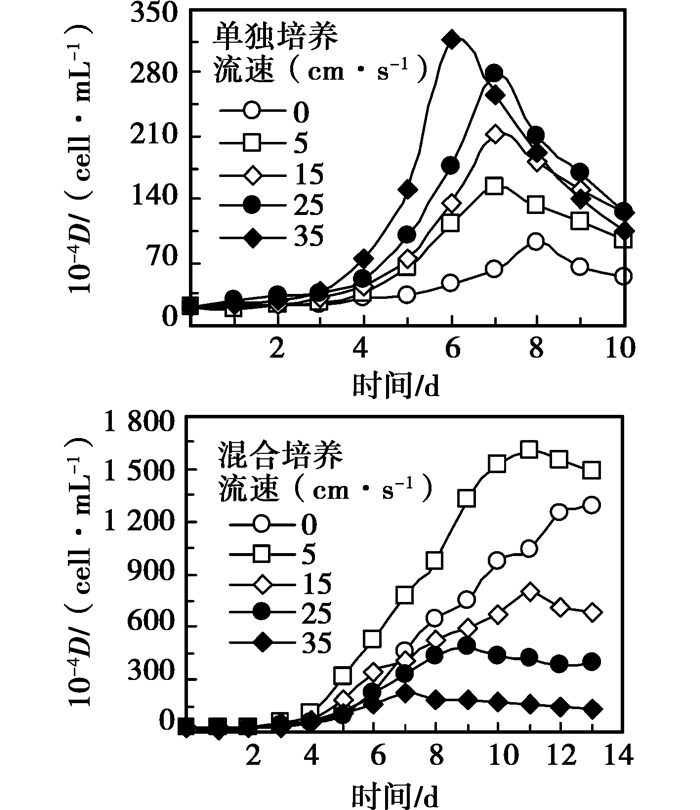
|
图 2 不同流速下铜绿微囊生长曲线 |
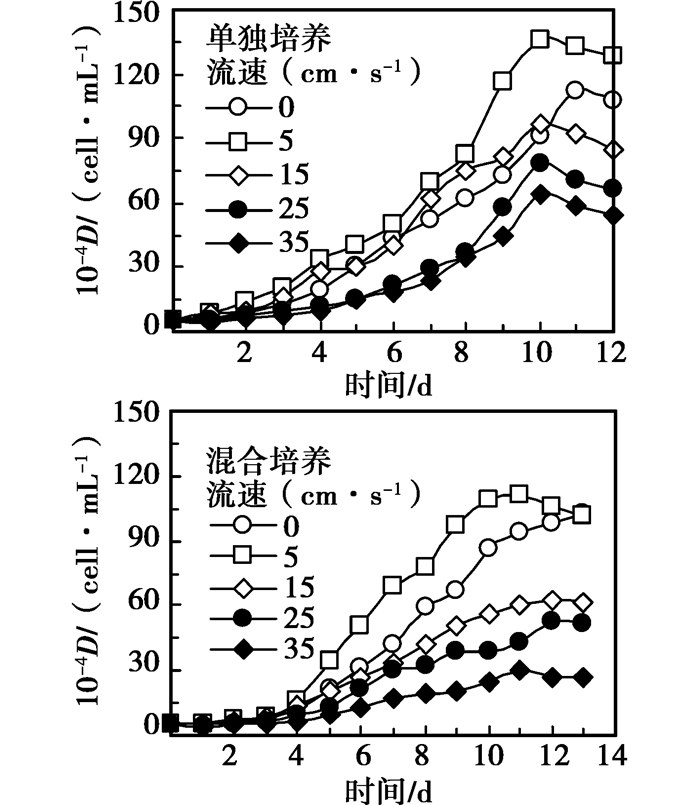
|
图 3 不同流速下四尾栅藻生长曲线 |
从图 3可以看出,在单独培养和混合培养条件下培养周期分别为12 d和13 d,都经历了明显的适应生长期和对数生长期。单独培养条件下,流速不超过15 cm/s时四尾栅藻的生长高于静止对照组中四尾栅藻的生长,当流速大于15 cm/s时相反。在混合培养条件下,水流对四尾栅藻生长的影响发生改变,流速在5 cm/s时最利于微囊藻的生长,流速大于5 cm/s时四尾栅藻的生长均低于静止对照组中四尾栅藻的生长。
2.2 微囊藻与四尾栅藻的抑制参数对单独培养和混合培养中四尾栅藻和铜绿微囊藻的生长过程(衰亡期之前)进行逻辑斯缔方程的参数估计,并计算竞争抑制参数作图,如图 4所示。图中α为微囊藻对栅藻的竞争抑制参数,β为栅藻对微囊藻的竞争抑制参数。从图 4中可以看出,在实验组和对照组中微囊藻对栅藻的竞争抑制参数α虽为正值,但都非常小,实验组与对照组之间的α值相差较小;栅藻对微囊藻的竞争抑制参数β在静止对照组和实验组除35 cm/s外β均为负值,也就是说在富营养盐条件下,水体流速低于35 cm/s时,栅藻的存在将促进微囊藻的生长,在流速为5 cm/s下达到最大值,并随流速的增加逐渐降低,在流速为35 cm/s时,β变为正值栅藻对微囊藻生长的影响转变为抑制作用。
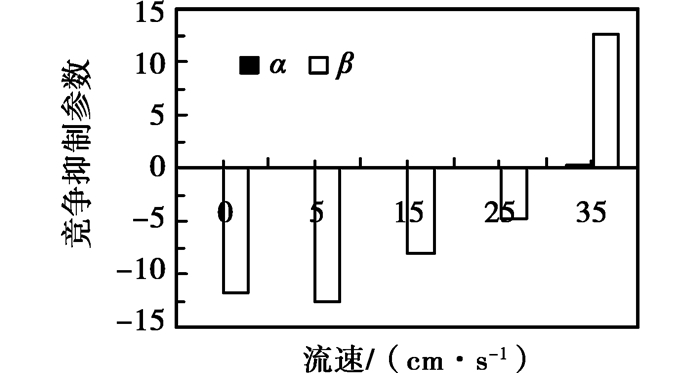
|
图 4 微囊藻与栅藻之间的竞争抑制参数 |
将微囊藻在单独培养和混合培养条件下最大比增长速率与流速的关系作图,如图 5所示。由图 5可知,在单独培养条件下微囊藻的比增长速率随流速的增加而增加,在35 cm/s时达到最大值;混合培养条件下微囊藻的比增长速率随流速的增加先增加后降低,在流速为15 cm/s达到最大值为1.08 d-1。在0~25 cm/s的流速下混合培养条件下微囊藻的比增长速率均大于单独培养条件下微囊藻的比增长速率,仅当流速为35 cm/s时单独培养下微囊藻的比增长速率较混合培养下的高。
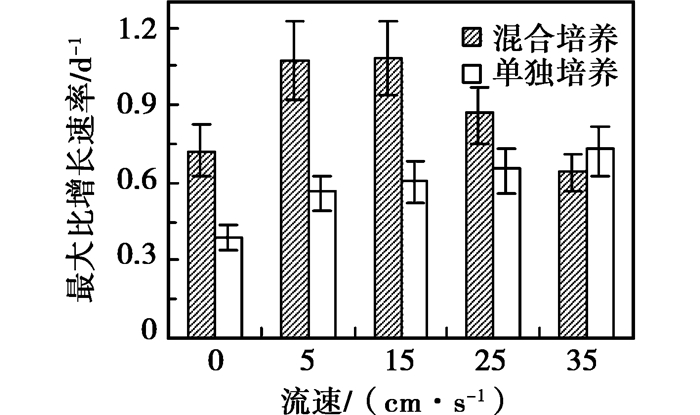
|
图 5 单独和混合培养下铜绿微囊藻增长速率 |
将微囊藻单独培养和混合培养条件下的最大藻密度与流速的关系作图,如图 6所示。从图 6可以看出,单独培养条件下微囊藻的最大藻密度随流速的增加而增加;混合培养条件下微囊藻的最大藻密度随流速的增加先增加后降低,在5 cm/s时达到最大值,混合竞争培养改变了微囊藻对水流的适应性;混合培养条件下最大藻密度大于单独培养条件下的最大藻密度,除流速在35 cm/s的实验组中,在流速为5 cm/s的条件下混合培养最大藻密度是单独培养条件下的10倍左右。混合培养与单培养条件下微囊藻密度存在显著性差异(p=0.03)。
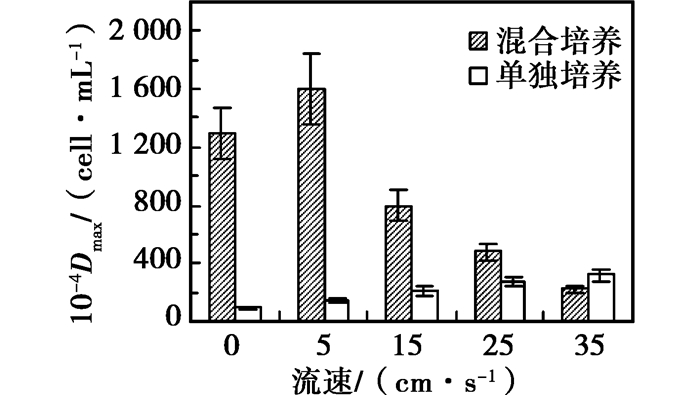
|
图 6 单独和混合培养下铜绿微囊藻最大藻密度 |
从实验结果可知,单独培养下水体的流动提高了微囊藻的生长,并随流速的增加而增加,在35 cm/s时达到最大值;这可能是水流提高了微囊藻对营养盐的吸收,Laveria等[21]研究发现当细胞直径小于1 mm时细胞边界层的营养主要,而废弃物的排放主要靠分子扩散的方式释放,水体的流动提高了营养物质的运移和废弃物的扩散;Goldman J C[22]提出扰动能提高营养盐与吸收营养者的接触率,营养盐接受者在扰动条件下增加了营养的交换速度,水流作用下微囊藻形成群体更有利于对光的摄取[23];随流速的增加将对藻细胞产生机械破坏[24],同时也影响藻细胞的分裂速率[25],因此,在高流速下细胞的生长表现为抑制作用。
混合培养条件下,四尾栅藻对铜绿微囊藻的生长产生促进作用,微囊藻的藻密度显著增加,除流速在35 cm/s时为抑制作用;而铜绿微囊藻对四尾栅藻表现为弱的抑制作用。微囊藻与栅藻的共同培养得到光照[9-10]和温度[5]条件实验得到,藻种之间将产生抑制作用;在贫营养水平、N/P值小的情况下表现出相互促进共生,而富营养和超富营养条件下表现为竞争和相互抑制[3]。本实验中发现流动的水体使富营养水体中栅藻对微囊藻的抑制变为促进作用,同时微囊藻初始接种藻密度是四尾栅藻的4倍,Hu等[7]研究发现初始藻密度较高的藻种也易成为优势藻。这可能是由于微囊藻细胞较小,相对于四尾栅藻具有更大的比表面积,在流动条件下位置的变化更能吸收营养和接受光照,更易获取生长所需条件[26]。实验中观察到微囊藻细胞形成群体[27]也利于吸收更多的营养盐;水体的流动有利于非产毒微囊藻,可能主要依靠分泌代谢产物抑制栅藻生长的影响较弱,而栅藻在竞争中分泌的化感物质和资源竞争将促进微囊藻的生长。另外,培养基营养物组分随藻的生长繁殖发生改变将影响微囊藻对水流的适应性[28]。当流速为35 cm/s时,水体流动对细胞产生机械破坏从而表现为抑制作用。可见水体流动将有利于较为聚集的微囊藻区域,藻类的相互竞争更利于微囊藻生长繁殖并成为优势藻种。本实验揭示了水体流动下微囊藻成为优势种并形成水华的机理,为控制蓝藻水华提供科学依据。
4 结论1) 四尾栅藻与微囊藻的相互竞争改变了彼此对水流的适应性;微囊藻的最佳流速在单独培养下为35 cm/s,在混合培养下变为5 cm/s;竞争延长了微囊藻的对数生长时间;微囊藻在混合培养出现明显的稳定期。
2) 流速在0~25 cm/s时,四尾栅藻对微囊藻产生促进作用,当流速为35 cm/s时表现为抑制作用;在整个实验过程中微囊藻对四尾栅藻均产生较低的抑制作用;微囊藻在混合培养下最大比增长速率和最大藻密度均高于单独培养,除流速35 cm/s外。
3) 产生这一现象的原因可能是,微囊藻自身的特点和水流改变了藻类的生境条件、藻类对光摄取和营养盐的吸收、微囊藻细胞群体的形成等,同时水流和竞争促进藻类胞外物质的分泌共同作用的结果;实验揭示了微囊藻水华形成前的机理,蓝藻水华的发生可能是从局部逐渐扩大的过程。
| [1] |
孔繁翔, 高光.
大型浅水富营养化湖泊中蓝藻水华形成机理的思考[J]. 生态学报, 2005, 25(3): 589–595.
KONG Fanxiang, GAO Guang. Hypothesis on cyanobacteria bloom-forming mechanism in large shallow eutrophic lakes[J]. Acta Ecologica Sinica, 2005, 25(3): 589–595. (in Chinese) |
| [2] | Kravchuk E S, Ivanova E A, Gladyshev M I. Spatial distribution of resting stages(akinetes)of the cyanobacteria Anabaena flos-aquae in sediments and its influence on pelagic populations[J]. Marine and Freshwater Research, 2011, 62(5): 450–461. DOI:10.1071/MF10256 |
| [3] |
万蕾, 朱伟, 赵联芳.
氮磷对微囊藻和栅藻生长及竞争的影响[J]. 环境科学, 2007, 26(6): 1230–1235.
WAN Lei, ZHU Wei, ZHAO Lianfang. Effect of nitrogen and phosphorus on growth and competition of M. aeruginosa and S. quadricauda[J]. Chinese Journal of Environmental Scienc, 2007, 26(6): 1230–1235. (in Chinese) |
| [4] | Bucka H. Ecology of selected planktonic algae causing water blooms[J]. Acta Hydrobiologica, 1989, 31(3/4): 207–258. |
| [5] |
郑忠明, 白培峰, 陆开宏, 等.
铜绿微囊藻和四尾栅藻在不同温度下的生长特性及竞争参数计算[J]. 水生生物学报, 2008, 32(5): 720–727.
ZHENG Zhongming, BAI Peifeng, LU Kaihong, et al. Growth characteristics and competitive parameters of Microcystis aeruginosa and Scendesmus quadricauda at different temperatures[J]. Acta Hydrobiologica Sinica, 2008, 32(5): 720–727. (in Chinese) |
| [6] |
晁建颖, 颜润润, 张毅敏.
不同温度下铜绿微囊藻和斜生栅藻的最佳生长率及竞争作用[J]. 生态与农村环境学报, 2011, 27(2): 53–57.
CHAO Jianying, YAN Runrun, ZHANG Yimin. Optimal growth of and competition between Microcystis aeruginosa and Scenedesmus obliquus related to temperature[J]. Rural Eco-Environment, 2011, 27(2): 53–57. (in Chinese) |
| [7] | Hu S H, Zhang D Y. The effects of initial population density on the competition for limiting nutrients in two freshwater algae[J]. Oecologia, 1993, 96(4): 569–574. DOI:10.1007/BF00320515 |
| [8] |
胡小贞, 金相灿, 储昭升, 等.
太湖铜绿微囊藻与四尾栅藻的光竞争及模拟优势过程初探[J]. 农业环境科学学报, 2005, 24(3): 538–543.
HU Xiaozhen, JIN Xiangcan, CHU Zhaoshen, et al. Light competition between Microcystis aeruginosa and Scendesmus quadricauda from Taihu Lake and the dominance process simulation in microcosm[J]. Journal of Agro-Environment Science, 2005, 24(3): 538–543. (in Chinese) |
| [9] |
陈晓峰, 逄勇, 颜润润.
竞争条件下光照对两种淡水藻生长的影响[J]. 环境科学与技术, 2009, 32(6): 6–11, 28.
CHEN Xiaofen, PANG Yong, YAN Runrun. Effect of light intensity on growth of two species of algae under competition cultures[J]. Environmental Science & Technology, 2009, 32(6): 6–11, 28. (in Chinese) |
| [10] |
李小龙, 耿亚红, 李夜光, 等.
从光合作用特性看铜绿微囊藻(Microcystis aeruginosa)的竞争优势[J]. 武汉植物学研究, 2006, 24(3): 225–230.
LI Xiaolong, GENG Yahong, LI Yeguang, et al. The advantages in competition based on the photosynthetic characteristics of Microcystis aeruginosa[J]. Journal of Wuhan Botanical Research, 2006, 24(3): 225–230. (in Chinese) |
| [11] | Xing W, Huang W M, Li D H, et al. Effects of iron on growth, pigment content, photosystem Ⅱ efficiency, and siderophores production of Microcystis aeruginosa and Microcystis wesenbergii[J]. Current Microbiology, 2007, 55(2): 94–98. DOI:10.1007/s00284-006-0470-2 |
| [12] |
阎峰, 储昭升, 金相灿, 等.
Fe(Ⅲ)对太湖铜绿微囊藻和四尾栅藻竞争的影响[J]. 环境科学研究, 2007, 20(5): 61–65.
YAN Feng, CHU Zhaosheng, JIN Xiangcan, et al. Effects of Fe(Ⅲ)on the growth competition of Microcystis aeruginosa and Scenedesmus quadricauda[J]. Research of Environmental Sciences, 2007, 20(5): 61–65. (in Chinese) |
| [13] |
杨威, 孙凌, 袁有才, 等.
碱度水平对铜绿微囊藻和四尾栅藻生长和竞争的影响[J]. 农业环境科学学报, 2007, 26(4): 1264–1268.
YANG Wei, SUN Ling, YUAN Youcai, et al. Effects of alkalinity on growth and competition of Microcystis aeruginosa and Scenedesmus quadricauda[J]. Journal of Agro-Environment Science, 2007, 26(4): 1264–1268. (in Chinese) |
| [14] |
张民, 孔繁翔, 史小丽, 等.
铜绿微囊藻在竞争生长条件下对氧化还原电位降低的响应[J]. 湖泊科学, 2007, 19(2): 118–124.
ZHANG Min, KONG Fanxiang, SHI Xiaoli, et al. Responses of Microcystis aeruginosa to reducing oxidation reduction potential under competition growth condition[J]. Journal of Lake Sciences, 2007, 19(2): 118–124. DOI:10.18307/2007.0202 (in Chinese) |
| [15] | Yamamoto T, Hashimoto T, Tarutani K, et al. Effects of winds, tides and river water runoff on the formation and disappearance of the Alexandrium tamarense bloom in Hiroshima Bay, Japan[J]. Harmful Algae, 2002, 1(3): 301–312. DOI:10.1016/S1568-9883(02)00029-X |
| [16] | Arfi R. The effects of climate and hydrology on the trophic status of Sélingué Reservoir, Mali, West Africa[J]. Lakes & Reservoirs:Research & Management, 2003, 8(3/4): 247–257. |
| [17] | Rippka R, Deruelles J, Waterbury J B, et al. Generic assignments, strain histories and properties of pure cultures of cyanobacteria[J]. Microbiology, 1979, 111(1): 1–61. DOI:10.1099/00221287-111-1-1 |
| [18] |
秦伯强, 胡维平, 陈伟民, 等.
太湖梅梁湾水动力及相关过程的研究[J]. 湖泊科学, 2000, 12(4): 327–334.
QIN Boqiang, HU Weiping, Chen Weimin, et al. Studies on the hydrodynamic processes and related factors in Meiliang Bay, northern Taihu Lake, China[J]. Journal of Lake Sciences, 2000, 12(4): 327–334. DOI:10.18307/2000.0406 (in Chinese) |
| [19] | Lotka A J. Fluctuations in the abundance of species considered mathematically:with comment by Volterra V[J]. Nature, 1927, 119: 12–13. |
| [20] | Volterra V. Fluctuations in the abundance of a species considered mathematically[J]. Nature, 1926, 118(2972): 558–560. DOI:10.1038/118558a0 |
| [21] | Llaveria G, Figueroa R I, Garcés E, et al. Cell cycle and cell mortality of alexandrium minutum(dinophyceae)under small-scale turbulence conditions[J]. Journal of Phycology, 2009, 45(5): 1100–1109. |
| [22] | Goldman J C. Oceanic nutrient cycles[M]. Fasham M J R. Flows of energy and materials in marine ecosystems:theory and practice.[S.l.]:Plenum Press, 1984:137-170. |
| [23] | Regel R H, Brookes J D, Ganf G G, et al. The influence of experimentally generated turbulence on the Mash01 unicellular Microcystis aeruginosa strain[J]. Hydrobiologia, 2004, 517(1/2/3): 107–120. |
| [24] | Tiller C L. Physicochemical aggregation and deposition in aquatic environments[M]. Buffle J, Leeuwen H P V. Environmental particles:volume 2.[S.l.]:Lewis Publishers, 1993:353-386. |
| [25] |
史小丽, 王凤平, 蒋丽娟, 等.
扰动对外源性磷在模拟水生态系统中迁移的影响[J]. 中国环境科学, 2002, 22(6): 537–541.
SHI Xiaoli, WANG Fengping, JIANG Lijuan, et al. Effect of disturbance on the movement of exogenous phosphorus in simulative aquatic eco-systems[J]. China Environmental Science, 2002, 22(6): 537–541. (in Chinese) |
| [26] | Dickman E M, Newell J M, González M J, et al. Light, nutrients, and food-chain length constrain planktonic energy transfer efficiency across multiple trophic levels[J]. Proceedings of the National Academy of Sciences of the United States of America, 2008, 105(47): 18408–18412. DOI:10.1073/pnas.0805566105 |
| [27] | Reynolds C S. Variability in the provision and function of mucilage in phytoplankton:facultative responses to the environment[J]. Hydrobiologia, 2007, 578(1): 37–45. DOI:10.1007/s10750-006-0431-6 |
| [28] | Juhl A R, Velazquez V, Latz M I. Effect of growth conditions on flow-induced inhibition of population growth of a red-tide dinoflagellate[J]. Limnology and Oceanography, 2000, 45: 905–915. DOI:10.4319/lo.2000.45.4.0905 |
 2013, Vol. 36
2013, Vol. 36

