2. 中国科学院 重庆绿色智能技术研究院, 重庆 401122
2. Chongqing Institute of Green and Intelligent Technology, Chinese Academy of Sciences, Chongqing 401122, China
单级自养脱氮工艺是一种新型的生物脱氮工艺,在处理低碳比高氨氮废水上具有简易、高效、低耗的特点,具有广阔的应用前景,成为生物脱氮领域中的研究热点[1-2]。但是由于单级自养脱氮系统中较高的NH4+-N质量浓度,较低的C/N以及较低的DO条件,使得单级自养脱氮工艺N2O排放风险高。此外,当进水含有有机碳源后,系统内可能有多种菌种共存[3-4],氮代谢途径复杂多样,使得单级自养脱氮工艺N2O的排放情况不明了。
N2O是一种强有力的温室气体,其增温潜势分别是CO2的190~270倍、CH4的4~21倍[5],是破坏臭氧层的最重要因子[6]。近年来的研究表明,污水生物脱氮过程是N2O的一个重要人为来源,且其N2O排放量有日益增高的趋势[7-8]。因此,污水生物脱氮过程中N2O的排放问题不容忽视,而目前关于单级自养脱氮工艺N2O排放特征的研究还很鲜见。
有研究表明,单级自养脱氮工艺可以在连续曝气或者间歇曝气方式下运行[9],低质量浓度的乙酸钠可促进厌氧氨氧化活性[10],单级自养脱氮系统进水加入有机碳源后,系统的TN去除率增加[3-4, 11]。然而,关于曝气方式及有机碳源对单级自养脱氮系统N2O排放特征影响的研究尚未见报道。因此,本研究采用人工配水,考察了曝气方式及有机碳源对单级自养脱氮系统N2O排放量和排放特征的影响,研究成果可为提高系统脱氮效率,减少温室气体N2O的排放提供依据。
1 试验材料与方法 1.1 反应器及运行方式采用有机玻璃板制成的SBBR(sequencing batch biofilm reactor)反应器,试验装置如图 1所示。
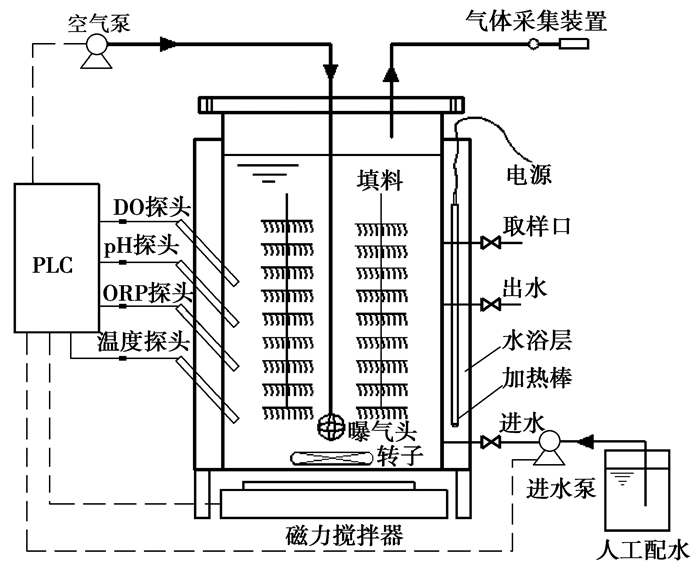
|
图 1 试验装置示意图 |
反应器为圆柱形,外层为水浴加热层,配备恒温加热棒以维持系统温度稳定,内层为反应器主体,有效容积为15 L,反应器内置组合填料供微生物附着生长,底部设有磁力搅拌器。反应器运行周期为16 h,每周期末换1/2的水。试验期间反应器内温度为(30±2) ℃,pH值为7.8~8.2。反应器密闭运行,在一个运行周期内每隔1 h采集一次水样和气样。
1.2 试验用水采用人工配制的氨氮废水,即向自来水中加入适量的NH4HCO3,使进水NH4+-N质量浓度约为140 mg/L,加入NaHCO3调节pH值为7.8~8.2,并加入适量的KH2PO4作为磷源,配制微量元素贮备液[12],按2 mL/L加入反应器,人工配水水质见表 1。
| 表 1 人工配水水质 |
采用了3个SBBR反应器,控制条件如表 2所示。
| 表 2 反应器控制条件 |
生物脱氮过程中产生的N2O包括两部分:一部分以气态形式逸出系统,排放至大气中,每小时反应器N2O排放量即为该小时N2O的平均排放速率,一个运行周期内每小时的排放量累加起来即为N2O累积排放量。另一部分则溶解于反应器溶液中,为溶解态N2O,以质量浓度表示。
气态N2O采用Agilent 7820A气相色谱仪分析测定,色谱柱为填充80/100目porapak Q的填充柱。ECD检测器、进样口和色谱柱的温度分别为300、100、70 ℃。定量六通阀进样,进样量为1 mL,载气为高纯N2(纯度>99.999%),流速为30 mL/min,N2O出峰保留时间为3 min。所有气体样品均测定3次,取平均值。
溶解于反应器溶液中的N2O采用上部空间法测定。取反应器出水于顶空瓶中,加入0.5 mL质量浓度为1 000 mg/L的HgCl2溶液,以抑制残余微生物活性;向水样上部空间通入N2,振荡0.5 h后,测定水样上部气体中N2O质量浓度,根据亨利定律计算溶解于反应器溶液中N2O的量。
NH4+-N、NO2--N、NO3--N、TN和COD等均采用国家标准方法进行检测[13]。DO采用YSI Professional ODOTM便携式溶氧仪测定,pH值采用YSI pH100便携式pH计测定。
2 试验结果与讨论 2.1 单级自养脱氮系统脱氮性能图 2为反应器稳定运行时,单级自养脱氮系统在一个典型运行周期内NH4+-N、NO2--N、NO3--N、TN质量浓度及TN去除率的变化。
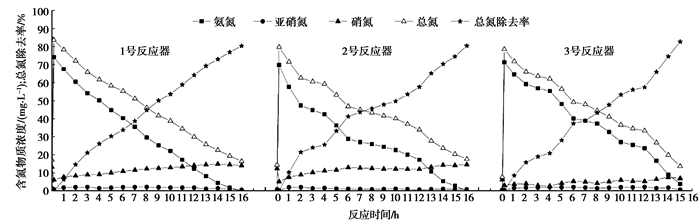
|
图 2 一个典型周期反应器内含氮物质变化 |
由图 2可知,运行周期末3个反应器的NH4+-N完全转化,TN去除率分别达到80.4%,80.4%和90.1%,3号反应器TN去除率最高。此外,3号反应器出水COD低于15 mg/L。
单级自养脱氮系统主要通过亚硝化厌氧氨氧化反应去除NH4+-N。由图 2可知,在整个运行周期中,3个反应器NO2--N质量浓度始终低于2.5 mg/L,由于系统生物膜外层的氨氧化菌(Ammonia-oxidizing bacteria,AOB)将NH4+-N氧化成NO2--N后,生成的NO2--N可立即被生物膜内层的厌氧氨氧化反应消耗,因而没有在溶液中大量累积。在整个运行周期中,1号和2号反应器NO3--N质量浓度始终低于16 mg/L,而3号反应器的NO3--N质量浓度低于8 mg/L,这是由于3号反应器进水含有机碳源,促进了反硝化作用[3-4],消耗了部分NO3--N所致。
2.2 单级自养脱氮系统N2O排放特征图 3为系统在一个典型周期内N2O的排放情况,表 3为系统在该周期中N2O排放量及N2O转化率。N2O转化率为一个周期内N2O累积排放量与周期内总氮去除量的比值。
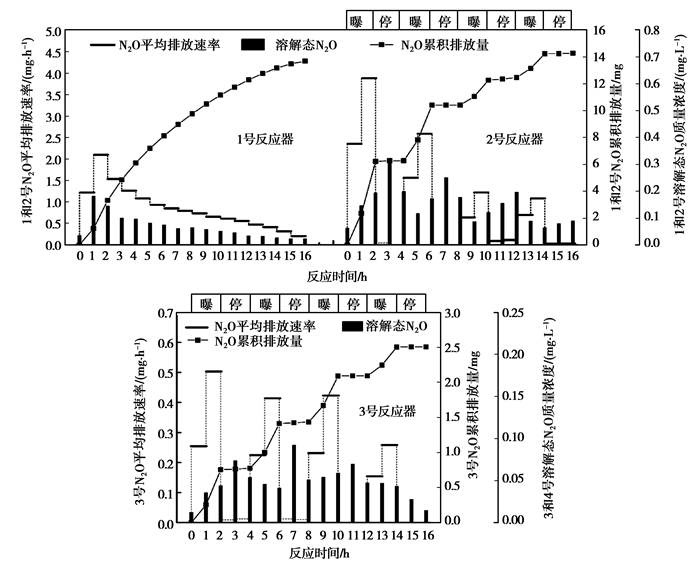
|
图 3 一个典型周期内N2O排放情况 |
| 表 3 一个典型周期内N2O排放量和N2O转化率 |
单级自养脱氮系统中存在亚硝化菌和厌氧氨氧化菌,另外由于进水含有少量有机碳源,系统中还存在反硝化菌,N2O的产生可能主要来自AOB的反硝化作用。已有研究[14]认为,低DO和较高的NO2--N质量浓度条件下,容易发生AOB的反硝化,从而导致N2O的排放。SBBR单级自养脱氮工艺的氮去除途径主要为亚硝化厌氧氨氧化,在生物膜内部存在NO2--N和低溶氧区域,为AOB的反硝化提供了条件。目前对厌氧氨氧化过程中N2O排放的研究相对较少,但有学者认为,N2O可被厌氧氨氧化菌的混培物作为电子受体而被代谢[15]。反硝化作用对N2O排放的影响较为复杂,反硝化过程分四阶段进行,NO3--N→NO2--N→NO→N2O→N2,最终产物通常为N2O和N2。有研究报道[8, 16-17],较高的DO和较低的pH值容易抑制一氧化二氮(NOS)酶的活性,使N2O还原成N2的过程受阻,导致N2O的大量排放。但也有文献报道[18-19],在反硝化过程中加入有机碳源,可将N2O还原成N2,从而减少了N2O的排放。
1号反应器为连续曝气,由图 3可知,N2O平均排放速率在运行周期的第2小时达到最大值2.09 mg/h,之后持续下降至周期末的0.202 mg/h。在整个运行周期内,N2O累积排放量持续增加,至周期结束时达到13.69 mg。溶解态N2O质量浓度在运行周期的第1小时达到最大值0.183 mg/L,之后持续下降至周期末的0.022 6 mg/L。运行周期末,N2O转化率为1.36%。
与1号反应器的连续曝气方式不同,2号反应器采用间歇曝气,曝停比为2 h:2 h,在各曝气时段内其DO质量浓度和曝气量均大于1号反应器。2号反应器的N2O排放特征与1号明显不同。由图 3可知,在每个2 h:2 h的曝停时段内,2号反应器的N2O平均排放速率在曝气时段较大,且大于1号反应器,停曝时段几乎为零;相应的,N2O累积排放量在曝气段增加,停曝段出现平台期。因此,间歇曝气反应器N2O的排放主要来自曝气段。
从停曝段进入曝气段后,2号反应器N2O平均排放速率出现持续2h的增加。这有两方面原因,一是由于曝气吹脱作用,将溶液中的N2O大量吹脱出去。第二,DO从停曝段的最低值0.2~0.4 mg/L逐渐升高至曝气段第2小时的1.2~1.6 mg/L,较高的DO条件促使系统中更多的NH4+-N转化为NO2--N,为AOB的反硝化作用创造了底物条件,而生物膜的构造又为AOB的反硝化作用提供了低氧微环境,从而使得N2O平均排放速率随曝气时段的延长而增加。2号反应器从曝气段进入停曝段后,其N2O平均排放速率迅速下降,且几乎为零,这主要是由于曝气吹脱作用的解除,使得N2O更多地溶入反应器中,并可能进一步被厌氧氨氧化菌或反硝化菌利用;与此同时,较低的DO值也有利于NO2--N的转化。因此,N2O平均排放速率表现为随着反应器的曝气和停曝而交替变化。
从停曝段进入曝气段后,2号反应器中溶解态N2O质量浓度表现为先降低后升高。溶解态N2O质量浓度的降低是由于曝气吹脱作用将大量溶解态N2O吹脱出去,而之后质量浓度的升高则是由于在此阶段N2O产生量增加,且更多地溶于水中。反之,当系统从曝气段进入停曝段后,2号反应器溶解态N2O质量浓度出现了先升高后降低。此时,溶解态N2O质量浓度的升高是由于曝气吹脱作用减弱所致,而质量浓度的降低则可能是因为停止曝气后系统DO质量浓度下降,NH4+-N转化为NO2--N的量减少,AOB反硝化作用减弱,使得N2O产量减少。此外系统中部分溶解态N2O也可能在厌氧状态下被厌氧氨氧化菌所利用。因此,与N2O平均排放速率相似,2号反应器溶解态N2O质量浓度也随着反应器的曝气和停曝而交替变化。
3号反应器的曝气方式与2号反应器相同,但3号反应器的进水加入了乙酸钠作为有机碳源。由图 3可知,3号反应器N2O的排放特征与2号反应器相似,即N2O排放量主要来自曝气段,N2O平均排放速率和溶解态N2O质量浓度随着反应器的曝气和停曝而交替变化。但在运行周期内的各个时段内,3号反应器N2O平均排放速率,N2O累积排放量和溶解态N2O质量浓度均明显小于2号反应器。由表 3也可知,3号反应器在一个运行周期内N2O累积排放量为2.51 mg,仅为2号反应器14.28 mg的1/6。这是由于3号反应器进水含有少量有机碳源,可促进反硝化作用,而反硝化反应可能利用有机碳源将溶解态N2O还原成N2,使得N2O排放量减少。有研究表明[18-19],反硝化过程中加入有机碳源,反硝化反应可将N2O还原成N2。此外,当系统进水含有有机碳源后,系统的脱氮途径将会存在短程硝化反硝化,全程硝化反硝化等多种脱氮途径[12]。相比于不含有机碳源的系统,含氮物质的转化途径更加灵活多样化,这可能在一定程度减少了NO3--N、NO2--N、NO、NO2等物质的累积,从而减少了其转化为N2O的风险。
2.3 不同生物脱氮工艺N2O转化率表 4为进水较低氨氮质量浓度下,不同生物脱氮工艺N2O转化率的比较。
| 表 4 不同生物脱氮工艺N2O转化率比较 |
由表 4可知,在本研究的单级自养脱氮工艺中,N2O转化率分别为1.36%,1.49%和0.236%,低于文献报道的其他生物脱氮工艺N2O转化率。
大量文献表明,较高的NO2--N质量浓度容易导致N2O的排放[24-25]。Zeng,et al[26]在研究亚硝酸型同步硝化反硝化过程N2O的排放时,发现N2O的排放与NO2--N质量浓度具有良好的正相关性。由图 2可知,本研究的3个反应器在整个运行周期中NO2--N质量浓度始终低于2.5 mg/L,较低的NO2--N累积量是单级自养脱氮工艺N2O排放量较低的原因之一。
其次,单级自养脱氮工艺的主要脱氮途径是亚硝化厌氧氨氧化,而至今厌氧氨氧化的氮代谢中尚未证实N2O的存在[27],并且在试验室规模的厌氧氨氧化反应器排放的尾气中也没有发现N2O[28]。此外,郑平等[15]研究表明,N2O可被厌氧氨氧化菌的混培物作为电子受体而被代谢。因此,相对于其他生物脱氮工艺,由于单级自养脱氮工艺的主要脱氮途径厌氧氨氧化反应不产生N2O,甚至可能利用N2O,而使得其N2O排放风险降低。此外,由2.2的分析可知,当系统进水含有一定量有机碳源时,还可促进反硝化反应的进行,反硝化菌有可能利用有机碳源将N2O还原成N[18-19]2,从而减少了N2O排放量。
另外,Park等[25]研究表明,生物膜系统N2O的排放量小于非生物膜系统,他认为在有载体或填料的生物膜系统中,生物截留量大,生物膜内形成供多种微生物共同代谢的好氧缺氧微生物环境,有利于减少系统N2O的排放。本研究单级自养脱氮工艺采用生物膜法,在生物膜的外层形成好氧区,内层形成缺氧和厌氧区。由于好氧,缺氧和厌氧区紧密相连,由NH4+-N转化的NO2--N可以立即进入生物膜内层而被Anammox菌消耗利用,使得NO2--N积累量相对较小;在生物膜外层生成的N2O也可以快速扩散进入生物膜内层,而被反硝化菌、Anammox菌所消耗,从而减少了N2O排放。
3 结论1) 当进水NH4+-N质量浓度约为140 mg/L时,1号、2号和3号反应器的N2O累积排放量和N2O转化率分别为13.69、14.28、2.51 mg和1.36%,1.49%,0.236%。与其他生物脱氮工艺相比,单级自养脱氮工艺N2O转化率较低。
2) 曝气方式对N2O排放特征影响较大,在一个运行周期内,连续曝气的1号反应器N2O累积排放量持续增加,N2O平均排放速率和溶解态N2O质量浓度为先升高至最大值,之后持续下降。间歇曝气的2号反应器N2O排放量主要来自曝气段,N2O平均排放速率和溶解态N2O质量浓度整体呈现出先升高后降低的趋势,且随着反应器的曝气和停曝而交替变化。
3) 有机碳源对系统N2O排放有较大影响,含有机碳源的3号反应器N2O累积排放量和N2O转化率约为不含有机碳源的2号反应器的1/6。
| [1] | Ahn Y H. Sustainable nitrogen elimination biotechnologies:a review[J]. Process Biochemistry, 2006, 41: 1709–1721. DOI:10.1016/j.procbio.2006.03.033 |
| [2] | Jetten M S M, Cirpus I, Kartal B, et al. 1994-2004:10 years of research on the anaerobic oxidation of ammonium[J]. Biochemical Society Transactions, 2005, 33(1): 119–123. DOI:10.1042/BST0330119 |
| [3] | Li J, Guo J S, Fang F, et al. Effect of organic carbon on nitrogen conversion and microbial communities in the completely autotrophic nitrogen removal process[J]. Environmental Technology, 2012, 33(10): 1–9. |
| [4] | Xiao Y, Zeng G M, Yang Z H, et al. Coexistence of nitrifiers, denitrifiers and Anammox bacteria in a sequencing batch biofilm reactor as revealed by PCR-DGGE[J]. Journal of Applied Microbiology, 2009, 106(2): 496–505. DOI:10.1111/jam.2009.106.issue-2 |
| [5] | IP CC. Climate change 1995:the Science of Climate Change[M]. Cambridge: Cambridge University Press, 1996: 21-24. |
| [6] | Ravishankara A R, Daniel J S, Portmann R W. Nitrous oxide(N2O):the dominant ozone-depleting substance emitted in the 21st century[J]. Science, 2009, 326(5949): 123–125. DOI:10.1126/science.1176985 |
| [7] |
张静蓉, 王淑莹, 尚会来, 等.
污水短程硝化反硝化和同步硝化反硝化生物脱氮中N2O排放量及控制策略[J]. 环境科学, 2009, 30(12): 3624–2629.
ZHANG Jingrong, WANG Shuying, SHANG Huilai, et al. N2O Emission and control in shortcut nitrification and denitrification and simultaneous nitrification and denitrification biological nitrogen removal systems[J]. Environmental Science, 2009, 30(12): 3624–2629. DOI:10.3321/j.issn:0250-3301.2009.12.030 (in Chinese) |
| [8] |
耿军军, 王亚宜, 张兆祥, 等.
污水生物脱氮革新工艺中强温室气体N2O的产生及微观机理[J]. 环境科学学报, 2010, 30(9): 1729–1738.
GENG Junjun, WANG Yayi, ZHANG Zhaoxiang, et al. N2O production and mechanism in recently developed biological nitrogen removal processes[J]. Acta Scientiae Circumstantiae, 2010, 30(9): 1729–1738. (in Chinese) |
| [9] |
方芳, 杨国红, 郭劲松, 等.
DO和曝停比对单级自养脱氮工艺影响试验研究[J]. 环境科学, 2007, 28(9): 1975–1980.
FANG Fang, YANG Guohong, GUO Jinsong, et al. Influence of DO and aeration/non-aeration ratio on one-step SBBR completely autotrophic nitrogen removal process[J]. Environmental Science, 2007, 28(9): 1975–1980. (in Chinese) |
| [10] | 刘金苓. 厌氧氨氧化微生物的有机代谢机理及其固定化效应研究[D]. 广州: 中山大学, 2006. |
| [11] | Wang C C, Lee P H, Kumar M, Huang Y T, et al. Simultaneous partial nitrification, anaerobic ammonium oxidation and denitrification(SNAD) in a full-scale landfill-leachate treatment plant[J]. Journal of Hazardous Materials, 2010, 175: 622–628. DOI:10.1016/j.jhazmat.2009.10.052 |
| [12] |
杨国红, 方芳, 郭劲松, 等.
单级自养脱氮工艺氨氮去除途径研究[J]. 环境科学, 2009, 30(1): 102–107.
YANG Guohong, FANG Fang, GUO Jinsong, et al. mechanism of ammonium removal in the completely autotrophic nitrogen removal in one reactor process[J]. Environmental Science, 2009, 30(1): 102–107. (in Chinese) |
| [13] | 国家环保局编. 水和废水监测分析方法[M]. 第四版. 北京: 中国环境科学出版社, 2002. |
| [14] | Poth M, Focht D D. 15N kinetic analysis of N2O production by nitrosomonas europaea:an examination of nitrifier denitrification[J]. Applied Environmental Microbiology, 1985, 49(5): 1134–1141. |
| [15] |
郑平, 冯孝善, JettenM S M, 等.
厌氧氨氧化菌基质转化特性的研究[J]. 浙江农业大学学报, 1997, 23(4): 409–413.
ZHENG Ping, FENG Xiaoshan, Jetten M S M, et al. Study on substrate conversion characteristics of mixed microbial culture for anaerobic ammonium oxidation[J]. Journal of Zhejiang Agricultural University, 1997, 23(4): 409–413. (in Chinese) |
| [16] | Otte S, Grobben N G, Robertson L A, et al. Nitrous oxide production by Alcaligenes faecalis under transient and dynamic aerobic and anaerobic conditions[J]. Applied and Environmental Microbiology, 1996, 62(7): 2421–2426. |
| [17] | Hanaki K, Hong Z, Matsuo T, et al. Production of nitrous oxide gas during denitrification of wastewater[J]. Water Science and Technology, 1992, 26(5/6): 1027–1036. |
| [18] | Yang Q, Liu X H, Peng C Y, et al. N2O production during nitrogen removal via nitrite from domestic wastewater:main sources and control method[J]. Environmental science technology, 2009, 43(24): 9400–9406. DOI:10.1021/es9019113 |
| [19] |
于德爽, 李津, 陆婕.
短程与全程硝化反硝化过程中N2O产量比较[J]. 中国给水排水, 2008, 24(7): 66–69.
YU Deshuang, LI Jin, LU Jie. Comparison of N2O production quantity between complete and shortcut nitrification and denitrification processes[J]. China Water & Wastewater, 2008, 24(7): 66–69. (in Chinese) |
| [20] |
王淑莹, 张静蓉, 尚会来, 等.
生物膜同步硝化反硝化脱氮过程中N2O的产生量及机理分析[J]. 北京工业大学学报, 2011, 37(9): 1400–1406.
WANG Shuying, ZHANG Jingrong, SHANG Huilai, et al. The N2O production and mechanism analysis of simultaneous nitrification and denitrification in biofilm reactor[J]. Journal of Beijing University of Technology, 2011, 37(9): 1400–1406. (in Chinese) |
| [21] |
阮文权, 陈坚.
好氧颗粒污泥同步硝化反硝化脱氮过程中N2O的产生[J]. 无锡轻工大学学报, 2004, 23(4): 37–41.
RUAN Wenquan, CHEN Jian. The Generation of N2O with SND aerobic granular sludge[J]. Journal of Wuxi University of Light Industry, 2004, 23(4): 37–41. (in Chinese) |
| [22] | Hu Z, Zhang J, Li S P, et al. Effect of anoxic/aerobic phase fraction on N2O emission in a sequencing batch reactor under low temperature[J]. Bioresource Technology, 2011, 102(5): 5486–5491. |
| [23] | Wang P, Liu J, Wang B, et al. The impacts of pH and DO on N2O production during wastewater aerobic nitrogen removal process[C]//International Symposium on Biotechnology for Environmental Pollution Control, 2004, Beijing, China. |
| [24] | Weissenbacher N, Loderer C, Lenz K, et al. NOx monitoring of a simultaneous nitrifying-denitrifying(SND) activated sludge plant at different oxidation reduction potentials[J]. Water Research, 2007, 41: 397–405. DOI:10.1016/j.watres.2006.10.034 |
| [25] | Park K Y, Inamori Y, Mizuochi M, et al. Emission and control of nitrous oxide from a biological wastewater treatment system with intermittent aeration[J]. Journal of Bioscience and Bioengineering, 2002, 90(3): 247–252. |
| [26] | Zeng R J, Lemaire R, Yuan Z, et al. Simultaneous nitrification, denitrification and phosphorus removal in a lab-scale sequencing batch reactor[J]. Biotechnology and Bioengineering, 2003, 84(2): 170–178. DOI:10.1002/(ISSN)1097-0290 |
| [27] | Kartal B, Kuypers M M M, Lavik G, et al. Anammox bacteria disguised as denitrifiers:nitrate reduction to dinitrogen gas via nitrite and ammonium[J]. Environment Microbiology, 2007, 9(3): 635–642. DOI:10.1111/emi.2007.9.issue-3 |
| [28] | Van Der Star W R L, Miclea A I, Van Dongen U G J M, et al. The membrane bioreactor:a novel tool to growanammox bacteria as free cells[J]. Biotechnology and Bioengineering, 2008, 101(2): 286–294. DOI:10.1002/bit.v101:2 |
 2014, Vol. 37
2014, Vol. 37

