b. 昆明理工大学 复杂有色金属资源清洁利用国家重点实验室, 昆明 650093
b. State Key Laboratory of Complex Nonferrous Metal Resources Cleaning Utilization, Kunming University of Science and Technology, Kumming 650093, China
从含金银的物料中提取金银的化学方法主要有氰化法[1-2]、硫代硫酸盐法[3-4]、硫氰化物法[5-6]和硫脲法[7-8]等。硫脲法是用含有氧化剂(如Fe3+、H2O2等)的酸性硫脲(TU)溶液浸出含金银的物料,使金银氧化并与硫脲形成配合物进入溶液中[9-10]。硫脲法因具有试剂无毒或低毒性、选择性好且浸出速度快等优点而备受重视,并被越来越多地用于从含量较低的一些金银矿[11-13]、湿法炼锌浸出渣[14]、电子废料[15-17]等物料中回收金银。对于硫脲浸出液中的金银,可通过活性炭或生物吸附剂吸附[17-18],离子交换法[19]加以富集,或采用锌、铝等活泼金属置换[20-21]、电沉积[22-23]等方法进行回收。电沉积法过程简单,所得阴极产物中金银含量高,便于进一步分离纯化,电积尾液可返回浸出,易于循环利用。叶富兴[22]采用酸性硫脲溶液浸出含银1.1(质量分数,%)的银精矿,获得含Ag(Ⅰ)2.1 g/L的贵液,用钛板作阳极,不锈钢板作阴极,控制阴极电流密度为70 A/m2进行银电积,获得银电积回收率95.65%,但电流效率仅11.46%。由于通常所处理的物料金银含量较低,所得浸出液中Au(Ⅰ)、Ag(Ⅰ)和TU浓度一般分别低于0.05、2和10 g/L,因此,对含金银酸性硫脲溶液的电化学行为的研究主要集中在低浓度Au(Ⅰ)、Ag(Ⅰ)和低浓度TU溶液。Díaz等[23-24]采用循环伏安对酸性硫脲溶液中金(1.0×10-5)、银(1.0×10-4)电沉积的研究结果表明,溶液中存在Pb(Ⅱ)1.0×10-5、Zn(Ⅱ)1.0×10-5或Fe(Ⅱ)1.0×10-4会使金、银的起始还原电位正移,但不影响它们的沉积速率,而存在2.0×10-4的Cu(Ⅱ)会使金、银的电还原速率略微减小;另外,溶液中氧的还原有助于提高电流效率,通过控制阴极还原电位和电解液流速,大幅度减弱了阴极的析氢反应。
对于Au(Ⅰ)、Ag(Ⅰ)和TU浓度均较高的酸性硫脲溶液的电化学行为的研究未见报道,笔者以含TU 50 g/L、Fe3+ 5 g/L、pH 1的硫酸溶液于40 ℃浸出含银17.5(质量分数,%)、金0.19(质量分数,%)的铜阳极泥,获得含Ag(Ⅰ)7.24 g/L、Au(Ⅰ)0.07 g/L的酸性硫脲浸出液,用循环伏安法研究了酸性硫脲浸出液中金、银、铁等各物种在阴极电还原的析出电位。
1 实验 1.1 试剂与仪器试剂:硫脲(TU),硫酸铁(Fe2(SO4)3·6H2O),硫酸银(Ag2SO4),硫酸均为分析纯。
仪器:CHI 600C型电化学工作站(上海辰华),RET加热磁力搅拌器(德国IKA)。
1.2 溶液的配制1) 模拟银浸出液:40 ℃下,0.05 mol/L H2SO4+5 g/L Fe3++1.0 g/L Ag(Ⅰ)溶液中最后添加50 g/L TU配制成含Fe3+5 g/L、Ag(Ⅰ)1.0 g/L、TU 50 g/L、pH 1.0的H2SO4溶液。
2) 模拟金浸出液:以0.05 mol/L H2SO4+5 g/L Fe3++50 g/L TU溶液250 mL,于40 ℃下鼓空气浸出金微粒(Au 99.9(质量分数,%)12 h,浸出时以硫酸调pH 1.0,得到含Au(Ⅰ)0.07 g/L的浸出液。
3) 铜阳极泥浸出液:以含5 g/L Fe3++50 g/L TU、pH 1.0的硫酸溶液250 mL,于40 ℃鼓空气浸出20 g铜阳极泥(含银17.5(质量分数,%),金0.19(质量分数,%))12 h,浸出时以硫酸调控pH 1.0,获得含Ag(Ⅰ)7.24 g/L、Au(Ⅰ)0.07 g/L的浸出液。
1.3 循环伏安测试以50 mL烧杯作为电解池,工作电极为2.0 cm2钛片,对电极为9.0 cm2钛片,参比电极为饱和甘汞电极(SCE);每次测试前,用05#金相砂纸打磨抛光钛片电极,再分别用丙酮、蒸馏水冲洗干净;电解液温度为40 ℃,测试前通氩气15 min;扫描电位范围0.60~-0.80 V,扫描速度10~200 mV/s。本文中的电位均为相对于饱和甘汞电极。
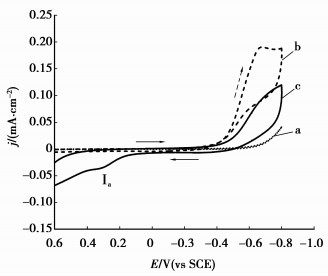
2 结果与讨论 2.1 硫脲的循环伏安pH 1.0的酸性硫脲溶液的循环伏安曲线如图 1所示。
|
图 1 酸性硫脲溶液的循环伏安曲线(扫速10 mV/s,313 K) a:H2O;b:H2SO4溶液,pH=1.0;c:TU 50 g/L+H2SO4溶液,pH=1.0 |
从图 1可以看出:a线中,纯水的析氢反应起始还原电位为-0.50 V,析氢反应的电流密度较小,-0.8 V时的电流密度仅为0.035 mA/cm2;电位回扫至0.6 V时未产生阳极电流。b线中,pH 1.0的H2SO4溶液析氢反应起始电位为-0.25 V,电位增至-0.40 V后阴极电流密度快速增大,表明析氢反应加剧,电位增至-0.68 V时出现还原峰,阴极表面有明显气泡析出,此时阴极电流密度为0.190 mA/cm2;电位回扫至0.6 V时也未产生阳极电流。c线中,pH 1.0的H2SO4溶液中增加了50 g/L TU,与b线相比,阴极析氢反应的起始电位基本不变,但是-0.40~-0.80 V电位区间析氢反应的电流密度却显著降低,TU分子在阴极表面吸附形成吸附膜,抑制了还原产物氢原子的吸附/脱附[25];当电位回扫至0 V左右,开始出现阳极电流,回扫至0.30 V左右时出现一个肩状峰Ia,可确定为TU在阳极发生电化学氧化。TU的电化学氧化可按两步进行[25-26],电位低于0.9 V(vs SHE)时,TU的第1步氧化首先形成硫脲自由基[TU·]+中间体,继而形成二硫甲脒(RSSR);当电位高于0.9 V(vs SHE)时,TU发生第2步氧化,此过程不基于RSSR进行,而是由硫脲自由基[TU·]+中间体的进一步氧化。
第1步:
| $ \begin{align} 2\left( \rm{TU} \right)-2\rm{e}(\rightleftharpoons 2{{\left[\rm{TU}\cdot \right]}^{+}})=\rm{RSSR}+2{{\rm{H}}^{+}}, \\ ~\varphi _{\rm{RSSR/TU}}^{0}=0.42\rm{ V}。\\ \end{align} $ | (1) |
第2步:
| $ {\left[{{\rm{TU}}\cdot} \right]^ + } -ne = 其他多种产物。$ | (2) |
第2步氧化过程复杂,产物较多,主要有甲脒亚磺酸(H2NHNCSO2H)、甲脒磺酸(H2NHNCSO3H)、氨腈(NH2CN)、脲((NH2)2CO)、S0、HSO4-、SO42-、CO2和N2等。图 1中回扫电位未达到0.9 V(vs SHE),因此TU只发生第1步电化学氧化,其峰值电流密度仅为0.04 mA/cm2。
2.2 Fe3+的循环伏安pH 1.0的H2SO4溶液中含5 g/L Fe3+的循环伏安曲线见图 2所示。

|
图 2 不同扫速下含5 g/L Fe3+的硫酸溶液的循环伏安曲线(313 K,pH=1.0) |
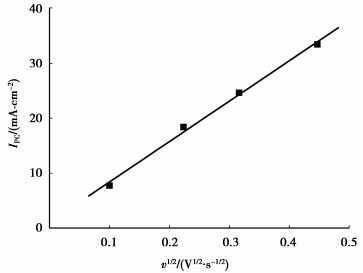
由图 2可以看出,Fe3+在0.15 V左右开始发生还原反应,在-0.3~-0.5 V之间出现一个还原峰,但阴极表面没有沉积物,说明在此电位范围内只发生了Fe3+到Fe2+的还原,起始还原电位φFe3+/Fe2+为0.15 V;虽然φFe3+/Fe2+0=0.77 V(vs SHE)[27],但因溶液中Fe3+仅为5 g/L(0.089 mol/L),此时φFe3+/Fe2+相对于标准电极电位负移了大约0.38 V;随扫速增大,阴极峰值电位基本不变,但峰值电流随之增大。将图 2中各扫速的峰值电流密度IPC对扫速v1/2作图,如图 3所示。
|
图 3 阴极峰值电流密度IPC与扫速v1/2的关系(313 K,pH=1.0) |
可以看出,IPC与v1/2呈线性关系,表明Fe3+到Fe2+的还原反应受扩散控制。阴极峰值电位φP与扫速v无关,说明Fe3+到Fe2+还原过程是可逆的。对于可逆体系,峰值电流密度IPC和电位扫描速度v之间存在下列关系[28]
| $ {I_{{\rm{PC}}}} = 2.69 \times {10^5}{n^{3/2}}{D_0}^{1/2}{c_0}{v^{1/2}}, $ | (3) |
式中:n为电极反应转移的电子数;D0为反应物(Fe3+)的扩散系数;c0为反应物的初始浓度。由图 2可知:IPC=3.33×10-2 A/cm2,n=1,cFe3+=8.93×10-5 mol/cm3,v=0.20 V/s;由式(3)可得40 ℃时Fe3+在pH 1.0的H2SO4溶液中的扩散系数DFe3+为9.61×10-6 cm2/s,而25 ℃时Fe3+在1 mol/L H2SO4溶液中的扩散系数为3.8×10-6 cm2/s[29],说明温度升高,加速了Fe3+离子的扩散。
此外,图 2中还可以看出,当扫速为10 mV/s时出现一个较小的滞留环,但随着扫速的增加,滞留环逐渐减小;扫速增至100 mV/s时,滞留环消失。说明扫速较低时,阴极区域生成的Fe2+在回扫的过程中有足够的时间脱离阴极表面的反应区,同时溶液本体的Fe3+也有足够时间扩散至阴极表面,因此回扫时Fe3+仍有一定的还原电流,出现了伏安曲线的交叉;随着扫速的增加,阴极表面附近Fe3+贫化加剧,回扫时Fe3+的还原电流减小,滞留环逐渐消失。
2.3 硫脲与Fe3+共存时的循环伏安仅含有5 g/L Fe3+、pH 1.0的H2SO4溶液呈黄色,当加入TU(50 g/L)后溶液立即变为棕红色,此时Fe3+与TU按式(4)发生配位反应生成[FeSO4(TU)]+[12],其生成稳定常数β为6.64[23],室温下这种棕红色溶液大约在10 min内稳定,之后棕红色逐渐消失,溶液变为无色,再逐渐变浑浊,析出淡黄色固体物质。
| $ {\rm{F}}{{\rm{e}}^{3 + }} + {\rm{S}}{{\rm{O}}_4}^{2 - } + {\rm{TU}} = {[{\rm{FeS}}{{\rm{O}}_4}\left( {{\rm{TU}}} \right)]^ + }。$ | (4) |
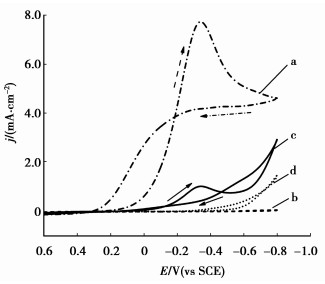
pH 1.0的H2SO4溶液中同时含有5 g/L Fe3+和50 g/L TU时的循环伏安测试结果如图 4所示。
|
图 4 同时含有TU与Fe3+的硫酸溶液的循环伏安曲线(扫速10 mV/s,313 K) a:Fe3+ 5 g/L,pH=1.0;b:TU 50 g/L,pH=1.0;c:TU 50 g/L + Fe3+ 5 g/L,pH=1.0放置5 min;d:TU 50 g/L + Fe3+ 5 g/L,pH=1.0放置24 h |
图 4中a线为pH 1.0的H2SO4+ 5 g/L Fe3+溶液的循环伏安曲线,Fe3+/Fe2+电对的还原峰值电流密度为7.8 mA/cm2。c线为pH 1.0的H2SO4+ 5 g/L Fe3+溶液最后添加50 g/L TU并放置5 min的循环伏安曲线,与a线相比可以看出,Fe3+/Fe2+电对的还原峰值电位基本不变(-0.33 V),但Fe3+的起始还原电位明显负移,而且峰值电流密度显著降低至1.0 mA/cm2,说明c线中Fe3+与TU共存(5 min)使Fe3+浓度显著降低。根据图 1和图 2的结果,TU氧化为RSSR的起始电位φRSSR/TU为0 V,而φFe3+/Fe2+为0.15 V,因此当Fe3+与TU共存时,必然发生Fe3+氧化TU生成RSSR的反应:
| $ 2\rm{F}{{\rm{e}}^{3+}}+2\rm{TU}\rightleftharpoons 2\rm{F}{{\rm{e}}^{2+}}+\rm{RSSR}+2{{\rm{H}}^{+}}。$ | (5) |
说明Fe3+与TU一经混合,两者之间的配位反应和氧化反应就同时发生,使溶液中Fe3+浓度快速降低,由于[FeSO4(TU)]+并不十分稳定,而Fe3+对TU的氧化反应却持续进行,使得先前生成的[FeSO4(TU)]+发生分解,浓度逐渐降低,棕红色消失,最终溶液中的[FeSO4(TU)]+全部分解,Fe3+被耗尽,溶液变为无色。d线为pH 1.0的H2SO4+ 5 g/L Fe3+溶液最后添加50 g/L TU并放置24 h后的循环伏安曲线,此时Fe3+/Fe2+电对的还原峰已完全消失,在-0.5~-0.8 V电位区间阴极还原电流逐渐增加,为析氢反应所致。此外,在含有Fe3+的酸性溶液中,TU还可被进一步氧化,生成元素硫析出[30]。
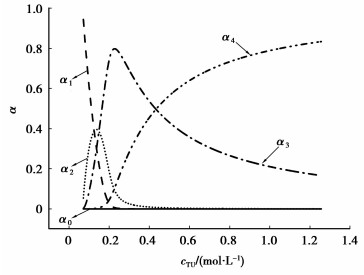
2.4 模拟浸出液的循环伏安Ag+与TU主要形成[Ag(TU)]+,[Ag(TU)2]+,[Ag(TU)3]+和[Ag(TU)4]+4种配离子,它们的累积生成常数β[Ag(TU)]+,β[Ag(TU)2]+,β[Ag(TU)3]+和β[Ag(TU)4]+分别为:107.59、1010.35、1012.87和1013.57[23]。模拟银浸出液中cAgT=9.26×10-3 mol/L,cTUT=0.66 mol/L(即50.0 g/L),以α0,α1,α2,α3和α4分别表示溶液中游离的Ag+,[Ag(TU)]+,[Ag(TU)2]+,[Ag(TU)3]+和[Ag(TU)4]+的摩尔分数(αi=c[Ag(TU)i]+/cAgT,i=0~4),根据热力学平衡计算出不同配位数的银硫脲配离子的摩尔分数与TU浓度的关系如图 5所示[31-32]。从图 5中可以看出,TU浓度为0.66 mol/L的模拟银浸出液中,银主要以[Ag(TU)3]+和[Ag(TU)4]+形式存在,且所占摩尔分数α3,α4分别为0.242 4、0.756 4,即c[Ag(TU)4]+/c[Ag(TU)3]+浓度比为3.1。
|
图 5 模拟银浸出液中不同配位数的银硫脲配离子的摩尔分数与硫脲浓度的关系 |
图 6(a)为pH 1.0的H2SO4+ 1.0 g/L Ag++ 50 g/L TU溶液的循环伏安曲线,在扫描电位范围内出现还原峰Ic和氧化峰Ia。Ic为[Ag(TU)4]+按式(6)发生还原反应生成Ag0,其起始还原电位φ[Ag(TU)4]+/Ag为-0.50 V,并在-0.57 V处达到峰值电流密度。
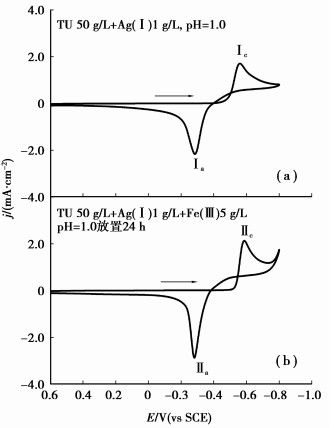
|
图 6 模拟银浸出液的循环伏安曲线(扫速10 mV/s,313 K) |
| $ {{[\rm{Ag}{{\left( \rm{TU} \right)}_{4}}]}^{+}}+{{\rm{e}}^{-}}\rightleftharpoons \rm{A}{{\rm{g}}^{0}}+4\rm{TU}\rm{。} $ | (6) |
图 6(a)中氧化峰Ia的电位为-0.4~0 V,其峰值电位为-0.29 V,与Hajbi等[33]研究酸性硫脲溶液中Ag0氧化形成[Ag(TU)3]+的电位为-0.4~0 V相符。
图 6(b)为模拟银浸出液放置24 h后测得的循环伏安曲线,在扫描电位范围内只出现一对还原峰Ⅱc/氧化峰Ⅱa;图 6(b)与图 6(a)极为相似,说明还原峰Ⅱc和氧化峰Ⅱa应为[Ag(TU)4]+/Ag0电对的还原/氧化过程;图 6(b)与图 4对比可以看出,图 6(b)中在-0.33 V处的Fe3+/Fe2+电对还原峰消失,进一步说明当Fe3+与TU共存一定时间后,Fe3+因与TU发生氧化还原反应而相互被消耗。由于图 6中的TU浓度远远大于Fe3+浓度,因此图 6(b)的溶液中Fe3+已被消耗殆尽。然而,在实际的浸出过程中,由于空气(O2)的鼓入使Fe2+再次氧化为Fe3+,而RSSR则因发挥氧化剂的作用按式(1)的逆反应又转化为TU。
将图 6(a)和(b)与图 1对比不难看出,Ag0转化为[Ag(TU)4]+的电位远比TU转化为RSSR的电位负,表明在有单质银存在时,银在TU之前优先被氧化;而且Ag0的氧化电流远远大于TU的氧化电流,使图 6(a)、(b)中0.30 V附近TU的氧化峰太弱而难以体现。另外,图 6(a)、(b)中也未能看到RSSR的还原峰,这应该归结为溶液中RSSR浓度很低,未能形成明显的RSSR还原峰。由于TU的第2步氧化不是基于RSSR,而是硫脲自由基[TU·]+进一步发生氧化反应的结果[24],此外,由于存在单质银的优先氧化,从而很大程度上减少了TU氧化为RSSR的机会。
Au+与TU主要形成[Au(TU)2]+配离子,其累积生成常数β[Au(TU)2]+为1021.96[23]。模拟金浸出液的循环伏安曲线如图 7所示。
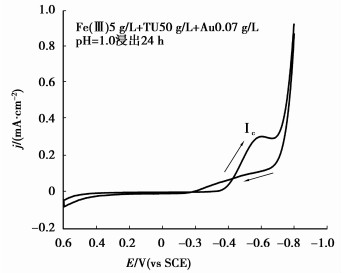
|
图 7 模拟金浸出液的循环伏安曲线(扫速10 mV/s,313 K) |
由图 7可以看出[Au(TU)2]+的起始还原电位φ[Au(TU)2]+/Au为-0.32 V,对应的还原峰的峰值电位为-0.59 V,由于[Au(TU)2]+浓度仅为0.07 g/L(3.55×10-4 mol/L),因此峰值电流密度仅为0.31 mA/cm2,而且φ[Au(TU)2]+/Au相对于标准电极电位(φ[Au(TU)2]+/Au0=0.38 V(vs SHE)[23])负移了大约0.45 V。对比图 6、图 7和图 1的结果可以看出,虽然溶液中[Au(TU)2]+的浓度远低于[Ag(TU)4]+,但[Au(TU)2]+仍可优先于[Ag(TU)4]+在阴极还原析出,并不可避免地伴随着析氢反应的发生。
2.5 铜阳极泥浸出液的循环伏安铜阳极泥浸出液电沉积时,阴极上可能发生电化学还原的组分有Fe3+,Fe2+,RSSR,H+,[Ag(TU)i]+,[Au(TU)2]+,[Cu(TU)4]2+和[Pb(TU)4]2+等,其中H+和[Ag(TU)i]+的浓度远远高于其他组分。
铜阳极泥浸出液的循环伏安曲线见图 8(a)所示,将图 8(a)中-0.28~-0.38 V电位范围的循环伏安曲线进行局部放大(如图 8(b)所示),可以看出铜阳极泥浸出液的起始还原电位为-0.32 V,应为[Au(TU)2]+优先被还原为Au0;图 8(a)中明显可见的还原峰ⅢC,应为[Au(TU)2]+至Au0以及[Ag(TU)4]+至Ag0的2个还原峰相连和叠加,峰值电位为-0.47 V;由于图 8中铜阳极泥浸出液银的浓度cAgT为图 6的7倍,致使图 8中[Ag(TU)4]+还原起始电位正移至大约-0.36 V,还原峰ⅢC的峰值电流密度为图 6的大约7倍。将图 8(a)与图 2对比,在0.15~-0.32 V之间未产生还原电流,说明酸性TU溶液浸出铜阳极泥结束后,共存的Fe3+被剩余的TU还原为Fe2+,因此循环伏安曲线上未出现Fe3+/Fe2+电对的还原峰。此外,当扫描电位超过-0.70 V时,阴极表面析出大量气泡,此时电流密度达到24.25 mA/cm2,说明氢的析出已经非常剧烈,这可能是由于还原生成的Au0和Ag0等覆盖在阴极表面,改变了阴极表面的电化学特性,降低了氢的析出过电位,使析氢反应加剧。
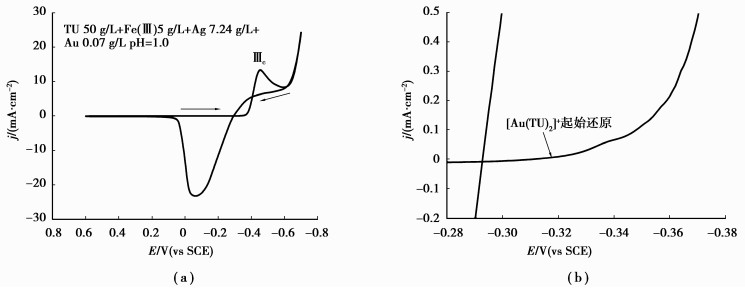
|
图 8 铜阳极泥浸出液的循环伏安曲线(扫速:10 mV/s,313 K) |
其他杂质金属的硫脲配离子如[Cu(TU)4]2+、[Pb(TU)4]2+等在铜阳极泥浸出液中的浓度均小于0.1 g/L,故在图 8(a)中未能形成明显的还原峰。
综上分析,以酸性硫脲溶液浸出铜阳极泥,于40 ℃对硫脲浸出液进行电沉积时,金在阴极上优先被还原析出,继而与银同时还原析出,阴极上同时还伴随着氢气的析出、RSSR的还原和杂质金属的还原,由于RSSR和杂质金属的浓度都不高,因此阴极析氢才是降低电流效率的主要原因。通过适当增大阴极沉积面积、降低电流密度,可有效降低电沉积的槽电压(阴极电位),抑制阴极大量析氢,提高电流效率。
3 结论铜阳极泥的酸性硫脲浸出液中,金银和硫脲的配离子主要以[Au(TU)2]+,[Ag(TU)4]+和[Ag(TU)3]+的形式存在,且c[Ag(TU)4]+/c[Ag(TU)3]+浓度比为3.1;浸出液中Fe3+,H+,[Au(TU)2]+,[Ag(TU)4]+和[Ag(TU)3]+在阴极电还原的起始电位分别为:0.15、-0.25、-0.32和-0.36 V,当金、银浓度降低时,它们的还原电位将进一步负移;当浸出液中硫脲浓度比Fe3+浓度高得多时,因两者间的氧化还原反应而使Fe3+转为Fe2+,还原峰消失。于40 ℃对硫脲浸出液进行电沉积时,各物种在阴极电还原的先后顺序为:Fe3+,H+,[Au(TU)2]+,[Ag(TU)4]+和[Ag(TU)3]+。金在阴极上优先于银被还原析出,继而与银同时还原析出,并伴随着氢气的析出、RSSR和杂质金属的还原,而阴极析氢是降低电流效率的主要原因。因此,适当降低电沉积时的阴极电流密度,避免阴极电位过负而大量析氢,可以在保证金、银完全沉积的同时有效提高电流效率。硫脲浸出电解沉积工艺可简化从含金银的物料中提取金银的流程,实现浸出剂的循环利用。
| [1] | Karimi P, Abdollahi H, Amini A, et al. Cyanidation of gold ores containing copper, silver, lead, arsenic and antimony[J]. International Journal of Mineral Processing, 2010, 95(1/4): 68–77. |
| [2] | Muir D M. A review of the selective leaching of gold from oxidised copper-gold ores with ammonia-cyanide and new insights for plant control and operation original research article[J]. Minerals Engineering, 2011, 24(6): 576–582. DOI:10.1016/j.mineng.2010.08.022 |
| [3] | Ficeriová J, Baláž P, Villachica C L. Thiosulfate leaching of silver, gold and bismuth from a complex sulfide concentrates[J]. Hydrometallurgy, 2005, 77(1/2): 35–39. |
| [4] | Ha V H, Lee J C, Jeong J, et al. Thiosulfate leaching of gold from waste mobile phones[J]. Journal of Hazardous Materials, 2010, 178(1/3): 1115–1119. |
| [5] | Li J S, Safarzadeh M S, Moats M S, et al. Thiocyanate hydrometallurgy for the recovery of gold.Part Ⅰ:chemical and thermodynamic considerations[J]. Hydrometallurgy, 2012, 113/114: 1–9. DOI:10.1016/j.hydromet.2011.11.005 |
| [6] | Yang S H, Chen G T, Cai Y N, et al. Selective leaching of silver-rich residue in NH4SCN solution under oxygen[J]. Separation and Purification Technology, 2011, 77(1/2): 1–6. |
| [7] | Gönen N, Körpe E, YIldIrIm M E, et al. Leaching and CIL processes in gold recovery from refractory ore with thiourea solutions[J]. Minerals Engineering, 2007, 20(6): 559–565. DOI:10.1016/j.mineng.2006.11.003 |
| [8] | Li J Y, Xu X L, Liu W Q. Thiourea leaching gold and silver from the printed circuit boards of waste mobile phones[J]. Waste Management, 2012, 32(6): 1209–1212. DOI:10.1016/j.wasman.2012.01.026 |
| [9] | Marsden J O, House I.The chemistry of gold extraction[M].2nd ed.Warrenton:Society for Mining, Metallurgy, and Exploration, 2006. |
| [10] |
程德平, 夏式均.
硫脲浸出银及其机理的探讨[J]. 杭州大学学报:自然科学版, 1996, 28(1): 39–44.
CHENG Deping, XIA Shijun. Study on silver leaching by thiourea and discussion of micromechanism[J]. Journal of Hangzhou University:Natural Science Edition, 1996, 28(1): 39–44. (in Chinese) |
| [11] |
方兆珩, MuhammedM.
硫脲浸取硫化精矿中的金和银[J]. 中国有色金属学报, 1992, 2(5): 63–67.
FANG Zhaoxian, Muhammed M. Thiourea leaching of gold and silver from sulfide concentrate[J]. The Chinese Journal of Nonferrous Metals, 1992, 2(5): 63–67. (in Chinese) |
| [12] | Deng T L, Liao M X, Wang M H, et al. Technical note enhancement of gold extraction from biooxidation residues using an acidic sodium sulphite-thiourea system[J]. Minerals Engineering, 2001, 14(2): 263–268. DOI:10.1016/S0892-6875(00)00181-3 |
| [13] |
吴争平, 尹周澜, 黄开国, 等.
辉银矿在硫脲体系中浸出银的热力学分析[J]. 贵金属, 2000, 21(4): 29–33.
WU Zhengping, YIN Zhoulan, HUANG Kaiguo, et al. Leaching thermodynamic analysis of argentite in thiourea system[J]. Precious Metals, 2000, 21(4): 29–33. (in Chinese) |
| [14] |
黄开国, 胡天觉.
硫脲法从锌的酸浸渣中回收银[J]. 中南工业大学学报, 1998, 29(6): 538–541.
HUANG Kaiguo, HU Tianjue. Silver recovery with thiourea system from acidic leaching residues of zinc hydrometallurgy[J]. Journal of Central South University of Technology, 1998, 29(6): 538–541. (in Chinese) |
| [15] | Ficeriová J, Baláž P, Dutková E, et al. Leaching of gold and silver from crushed Au-Ag wastes[J]. The Open Chemical Engineering Journal, 2008, 2: 6–9. DOI:10.2174/1874123100802010006 |
| [16] |
吴骏, 陈亮, 邱丽娟, 等.
废电路板硫脲提金研究[J]. 黄金, 2008, 29(6): 55–58.
WU Jun, CHEN Liang, QIU Lijuan, et al. Study on selectively leaching gold from waste printed circuit boards with thiourea[J]. Gold, 2008, 29(6): 55–58. (in Chinese) |
| [17] | Gurung M, Adhikari B B, Kawakita H, et al. Recovery of gold and silver from spent mobile phones by means of acid thiourea leaching followed by adsorption using biosorbent prepared from persimmon tannin[J]. Hydrometallurgy, 2013, 133: 84–93. DOI:10.1016/j.hydromet.2012.12.003 |
| [18] | Zhang H G, Ritchie I M, Brooy S R L. The adsorption of gold thiourea complex onto activated carbon[J]. Hydrometallurgy, 2004, 72(3-4): 291–301. DOI:10.1016/S0304-386X(03)00182-8 |
| [19] | Syed S. Recovery of gold from secondary sources:A review[J]. Hydrometallurgy, 2012(115/116): 30–51. |
| [20] | Teutli M, Lapidus G, Gonzalez I. The kinetics of silver cementation from thiourea solutions using aluminium[J]. Mining, Metallurgy and Exploration, 1990(24): 249–256. |
| [21] | Lee H Y, Kim S G, Oh J K. Cementation behavior of gold and silver onto Zn, Al and Fe powders from acid thiourea solutions[J]. Canadian Metallurgical Quarterly, 1997, 36(3): 149–155. |
| [22] |
叶富兴.
硫脲法从银精矿中提取银、金的研究[J]. 矿冶工程, 2006, 26(4): 181–83.
YE Fuxing. Recovery silver and gold from silver concentrate by thiourea method[J]. Mining and Metallurgical Engineering, 2006, 26(4): 181–83. (in Chinese) |
| [23] | Díaz M E P, González I, Lapidus G T. Electrodeposition of a silver-gold alloy(DORé)from thiourea solutions in the presence of other metallic ion impurities[J]. Hydrometallurgy, 2008, 93(1/2): 23–29. |
| [24] | Díaz M E P, AlonsoA R, González I, et al. Influence of oxygen reduction and hydrogen evolution in the gold and silver direct electrodeposition process from thiourea solutions in a filter press type reactor[J]. Hydrometallurgy, 2012, 129-130: 90–96. DOI:10.1016/j.hydromet.2012.09.006 |
| [25] | 冯加民. 硫脲电化学氧化中的物种分析和动力学分析[D]. 徐州: 中国矿业大学, 2010. |
| [26] | Yang X Y, Moast M S, Miller J D. The interaction of thiourea and formamidine disulfide in the dissolution of gold in sulfuric acid solutions[J]. Minerals Engineering, 2010, 23(9): 698–704. DOI:10.1016/j.mineng.2010.04.006 |
| [27] | Dean J A. Lange's handbook of chemistry[J]. Materials and Manufacturing Processes, 1990, 5(4): 687–688. DOI:10.1080/10426919008953291 |
| [28] | 巴德, 福克纳. 电化学方法原理和应用[M]. 2版. 邵元华, 朱果逸, 董献堆, 等, 译. 北京: 化学工业出版社, 2011. |
| [29] | 腾岛昭, 湘泽益男, 井上澈. 电化学测定方法[M]. 陈震, 姚建年, 译. 北京: 北京大学出版社, 1995. |
| [30] |
赵林治, 杨书廷.
硫脲稳定性研究[J]. 河南师范大学学报:自然科学版, 1992, 20(1): 98–102.
ZHAO Linzhi, YANG Shuting. Study on the stability of thiourea[J]. Journal of Henan Normal University:Natural Science, 1992, 20(1): 98–102. (in Chinese) |
| [31] | 罗勤慧. 配位化学[M]. 北京: 科学出版社, 2012. |
| [32] | 杨显万, 邱定. 湿法冶金[M]. 2版. 北京: 冶金工业出版社, 2011. |
| [33] | Hajbi A E, Chartier P. Complexation and adsorption of thiourea in sulphate medium on electrochemically roughened silver electrodes[J]. Journal of Electroanalytical Chemistry and Interfacial Electrochemistry, 1987, 227(1/2): 159–170. |
 2014, Vol. 37
2014, Vol. 37

