2. 贵州理工学院 制约工程学院, 贵阳 550003
2. College of Pharmaceutical Engineering, Guizhou Institute of Technology, Guiyang 550003, China
苝酰亚胺有大的共轭体系和平面结构,是一个缺电子体系。该类化合物具有很强的π共轭作用和很高的荧光量子产率,吸收光谱范围较宽,具有优良的光化学和热稳定性,是良好的分子电子学和光学材料,其在有机光电导体[1]、电子传输材料[2-3]、有机太阳能电池材料[4-7]、有机电致发光二极管[8-9]、激光染料[10]等众多领域都有很好的应用。但是苝亚胺衍生物的稠环共轭体系具有较大的共平面性,使分子之间的大π键相互作用大大增强,晶格能[11]也随之升高,导致其大多数衍生物溶解性较差,使其在许多领域的应用受到限制。为了改善其溶解度,必须对其进行修饰,修饰主要集中于苝酰亚胺的酰胺[8, 12]和苝中心环的湾位(苝环上的1,6,7,12位)[13-14]引入取代基。文献报道在其酰亚胺位引入取代基可以增加其溶解性,不会影响其光学性质,但是其溶解性增加是有限的;在其苝中心环的湾位,也就是1,6,7,12位点引入取代基不仅改善其溶解度,还在一定程度上改变化合物的光学性质,但是反应过程复杂,副产物多,分离困难,产率较低,限制其在现实中的应用。笔者以苝四羧酸二酐为原料,通过在一边酰胺位置上引入辛烷基,然后经氧化还原,溴化,Suzuki偶联反应在苝上9位引入不同的取代基合成得到一系列9-取代基-N-正辛基-苝-3,4-二羧酸单酰亚胺衍生物,本方法突破常规的修饰位置而进行修饰,不仅可以增加其溶解性,而且可以在很大程度上改变其光学性质,且该方法反应步骤较少,分离简单,产率较高。
1 实验 1.1 仪器与试剂 1.1.1 主要原料及试剂3,4,9,10-苝四羧酸二酐(98%),四三苯基膦钯(99.8%),苯硼酸(98%),4-甲氧基苯硼酸(98%),4-(二苯基氨基)苯硼酸(98%)均购于Aldrich;溴,二氯甲烷,环己烷,苯,碳酸钾,四氢呋喃,乙酸乙酯均为化学纯。
1.1.2 主要仪器精密显微熔点测定仪X-5(北京福凯仪器有限公司),核磁共振仪Bruker 500(Bruker 500 Ultrashield),紫外-可见分光光度计Cintra10e(澳大利亚GBC公司),荧光分光光度计RF-5301PC(日本岛津公司),Vario EL型元素分析仪(德国Elementae公司)。
1.2 合成 1.2.1 N-正辛基-苝-3,4-二羧酸单酰亚胺的合成[16]将3,4,9,10-苝四甲酸二酐(2.5 mmol,1 g)与正辛胺(2.5 mmol,0.41mL)在三颈瓶中混合,以蒸馏水与正丙醇混合溶液为溶剂,加热至60 ℃搅拌5 h,抽滤,固体干燥后加入12%的氢氧化钾溶液,搅拌均匀后加入高压反应釜,在180 ℃下反应10 h,取出混合物,二氯甲烷萃取,无水硫酸钠干燥后,过滤,减压旋干得到粗产物,用二氯甲烷过硅胶柱分离得到纯净的红色固体,产率30%,熔点:199~200 ℃。1HNMR (CDCl3,500 MHz)δ:8.446~8.430(d,2 H,J=8 Hz,Ar-H),8.289~8.274(d,2H,J=8 Hz,Ar-H),8.231~8.215(d,2H,J=8 Hz,Ar-H),7.840~7.824(d,2 H,J=8 Hz,Ar-H),7.571~7.540(t,2 H,J=7.75 Hz,Ar-H),4.181~4.151 (t,2 H,J=7.5 Hz,N-CH2),1.788~1.729(m,2H,R-CH2),1.456~1.292(m,10H,R-CH2),0.895~0.879 (t,3 H,J=6.25 Hz,R-CH3)。
1.2.2 9-溴-N-正辛基-苝-3,4-二羧酸单酰亚胺的合成合成路线如图 1所示。
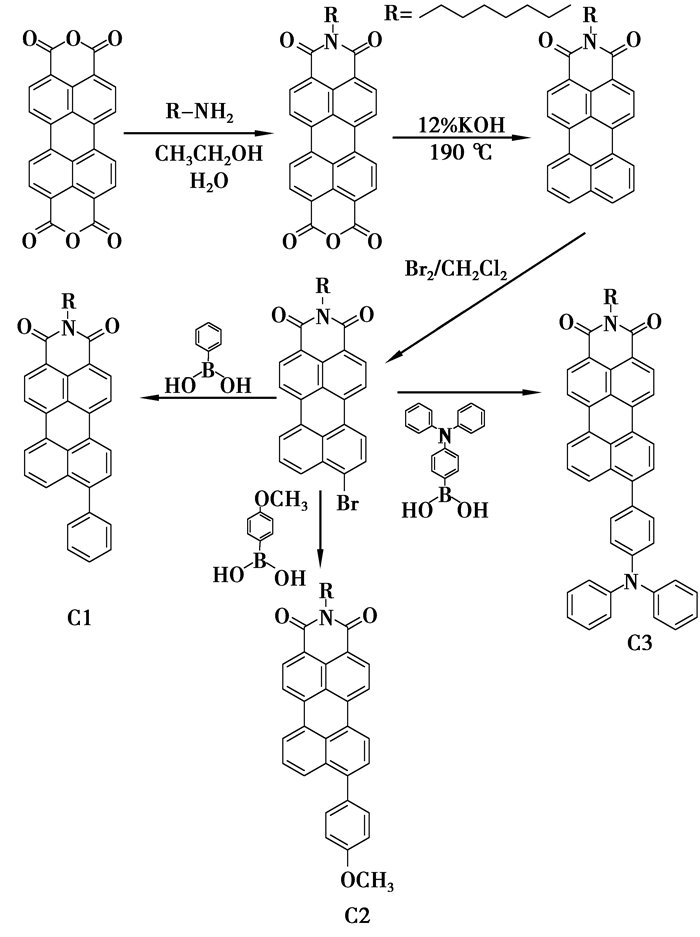
|
图 1 9-取代基-N-正辛基-苝-3,4-二羧酸单酰亚胺合成步骤 |
将N-正辛基-苝-3,4-二羧酸单酰亚胺(1.2 mmol,0.5 g)加入三颈瓶中,以二氯甲烷作为溶剂,逐渐滴加液溴(1 mL),回流反应约4 h除去多余液溴,二氯甲烷萃取,无水硫酸钠干燥后,减压旋干得到粗产物,用环己烷与二氯甲烷的混合溶剂过硅胶柱得到纯净的红色产物,产率70%,熔点:246~248 ℃。1HNMR(CDCl3,500 MHz)δ:8.538~8.503(m,2 H,Ar-H),8.393~8.378(d,1 H,J=7.5 Hz,Ar-H),8.333~8.316(d,1 H,J=8.5 Hz,Ar-H),8.280~8.253(m,2 H,Ar-H),8.135~8.118(d,1 H,J=8.5 Hz,Ar-H),7.863~7.846(d,1 H,J=8.5 Hz,Ar-H),7.694~7.663(t,1 H,J=7.75 Hz,Ar-H),4.199~4.169(t,2 H,J=7.5 Hz,N-CH2),1.786~1.725(m,2 H,R-CH2),1.467~1.258(m,10 H,R-CH2),0.893~0.866(t,3 H,J=6.75 Hz,R-CH3)。
1.2.3 目标化合物的合成1) 9-苯基-N-正辛基-苝-3,4-二羧酸单酰亚胺(C1)的合成。
将9-溴-N-正辛基-苝-3,4-二羧酸单酰亚胺(0.98 mmol,0.5 g),苯硼酸(1.17 mmol,0.14 g),K2CO3(11.7 mmol,1.62 g),蒸馏水(1 mL)和四三苯基膦钯(0.0488 mmol,0.06 g)在三颈瓶中混合,以干燥THF为溶剂,氩气保护,回流反应过夜,减压旋干得到粗产物,用环己烷与二氯甲烷的混合溶剂过硅胶柱得到纯净红色产物,产率75%,熔点:232-234 ℃。1HNMR(CDCl3,500 MHz)δ:8.516~8.500(d,2 H,J=8 Hz,Ar-H),8.407~8.368(m,2 H,Ar-H),8.323~8.307(m,2 H,Ar-H),7.971~7.955(d,1 H,J=8 Hz,Ar-H),7.574~7.487 (m,7 H,Ar-H),4.181~4.156(t,2 H,J=6.25 Hz,N-CH2),1.764~1.718(m,2 H,R-CH2),1.463~1.258(m,10 H,R-CH2),0.893~0.866(t,3H,J= 6.75 Hz,R-CH3),Anal.calcd for C36H31~NO2:C 84.84,H 6.13,N 2.75,O6.28;found C 84.81,H 6.14,N 2.78,O 6.27。
2) 9-(4-甲氧基苯基)-N-正辛基-苝-3,4-二羧酸单酰亚胺(C2)的合成。
将9-溴-N-正辛基-苝-3,4-二羧酸单酰亚胺(0.98 mmol,0.5 g),4-甲氧基苯硼酸(1.17 mmol,0.178 g),K2CO3(11.7 mmol,1.62 g),蒸馏水(1 mL)和四三苯基膦钯(0.0488 mmol,0.06 g)在三颈瓶中混合,以干燥THF为溶剂,氩气保护,回流反应过夜,减压旋干得到粗产物,用环己烷与二氯甲烷的混合溶剂过硅胶柱得到纯净的紫红色产物,产率68%,熔点:218-220 ℃。1HNMR(CDCl3,500 MHz)δ:8.546(s,2 H,Ar-H),8.403~8.357(d,4H,J=23 Hz,Ar-H),8.006~7.989 (d,1 H,J=8.5 Hz,Ar-H),7.576~7.547(t,2 H,J=7.25 Hz,Ar-H),7.482~7.465 (d,2H,J=8.5 Hz,Ar-H),7.096~7.079(d,2 H,J=8.5 Hz,Ar-H),4.203(s,2 H,N-CH2),3.926(s,3 H,ArO-CH3),1.753(s,2 H,R-CH2),1.375 ~1.284(m,10 H,R-CH2),0.890~0.863(t,3 H,J= 6.75 Hz,R-CH3);Anal.calcd for C37H33NO3:C 82.35,H 6.16,N 2.60,O 8.89;found C 82.38,H 6.17,N 2.58,O 8.87。
3) 9-{4-(二苯基胺基)苯基}-N-正辛基-苝-3,4-二羧酸单酰亚胺(C3)合成。
将9-溴-N-正辛基-苝-3,4-二羧酸单酰亚胺(0.98 mmol,0.5 g),4-(二苯基氨基)苯硼酸(1.17 mmol,0.338 g),K2CO3(11.7 mmol,1.62 g),蒸馏水(1 mL)和四三苯基膦钯(0.0488 mmol,0.06 g)在三颈瓶中混合,以干燥THF为溶剂,氩气保护,回流反应过夜,减压旋干得到粗产物,用环己烷与二氯甲烷的混合溶剂过硅胶柱得到纯净的紫红色产物,产率68%,熔点,189-191 ℃。1HNMR(CDCl3,500 MHz)δ:8.506~8.495(d,2 H,J=5.5 Hz,Ar-H,)8.381~8.367(d,2H,J=7 Hz,Ar-H),8.302(s,2H,Ar-H),8.112~8.096(d,1H,J=8 Hz,Ar-H),7.585~7.560(m,2H,Ar-H),7.420~7.403(d,2H,J=8.5 Hz,Ar-H),7.346~7.315(t,4H,J=7.75 Hz,Ar-H),7.261~7.218(t,6H,J=10.75 Hz,Ar-H),7.109~7.080(t,2H,J=7.25 Hz,Ar-H),4.188~4.157(t,2H,J=7.75 Hz,N-CH2),1.764~1.721(m,2H,R-CH2),1.449~1.256(m,10H,R-CH2),0.891~0.865(t,3H,J= 6.75 Hz,R-CH3);Anal.calcd for C48 ~H40N2O2:C 85.18,H 5.96,N 4.14,O 4.73;found C 85.20,H 5.95,4.12,O 4.72。
2 结果与讨论 2.1 合成机理与表征3,4,9,10-苝四甲酸二酐与正辛胺反应机理如图 2所示,由其机理可知温度过高或反应时间过长时产物是N,N′-正辛基-3,4,9,10-苝四甲酰二亚胺,而不是N-正辛基-3,4-二甲酰亚胺-9,10-二羧酸酐,通过实验可知当温度在60 ℃,时间6 h时N-正辛基-3,4-二甲酰亚胺-9,10-二羧酸酐产率较高。
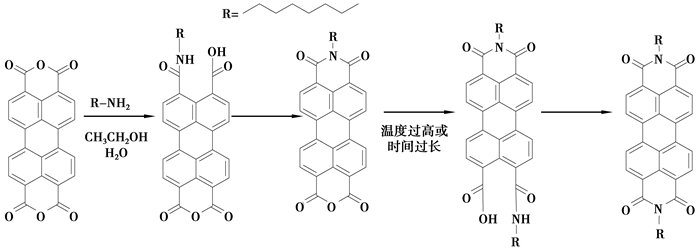
|
图 2 3,4,9,10-苝四甲酸二酐与正辛胺反应机理 |
N-正辛基-苝-3,4-二羧酸单酰亚胺结构如图 3所示,由结构可看出由于N-正辛基-3,4-二甲酰亚胺的影响溴化主要发生在右边的7,8,9,10,11,12位置,左边的供电效应在7,9,10,12位置发生溴化,而7,12位空间阻力比9,10位大,即溴化在9位或10位,由N-正辛基-苝-3,4-二羧酸单酰亚胺结构可知N-正辛基-苝-3,4-二羧酸单酰亚胺是对称化合物,无论溴化9位或10位,其溴化产物为同一化合物9-溴-N-正辛基-苝-3,4-二羧酸单酰亚胺。
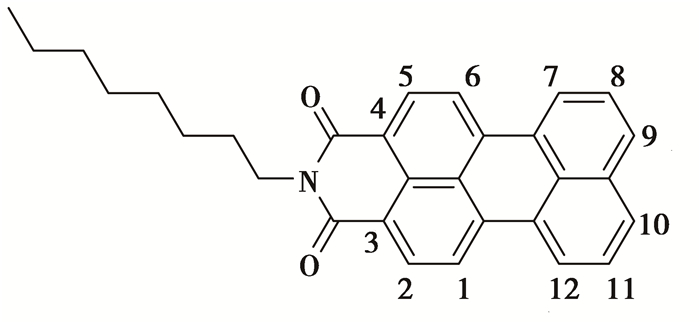
|
图 3 N-(正辛基)苝-3,4-二羧酸单酰亚胺的结构 |
Suzuki偶合反应的机理如图 4所示,由反应机理可以看出四三苯基膦钯(0)在被氧气或过氧化物氧化成(其过程是不可逆的)二价钯而失去催化活性,所以为了避免四三苯基膦钯被氧气或过氧化物氧化而失去催化活性,反应在氩气保护下进行,而且反应溶剂需要用金属钠干燥。
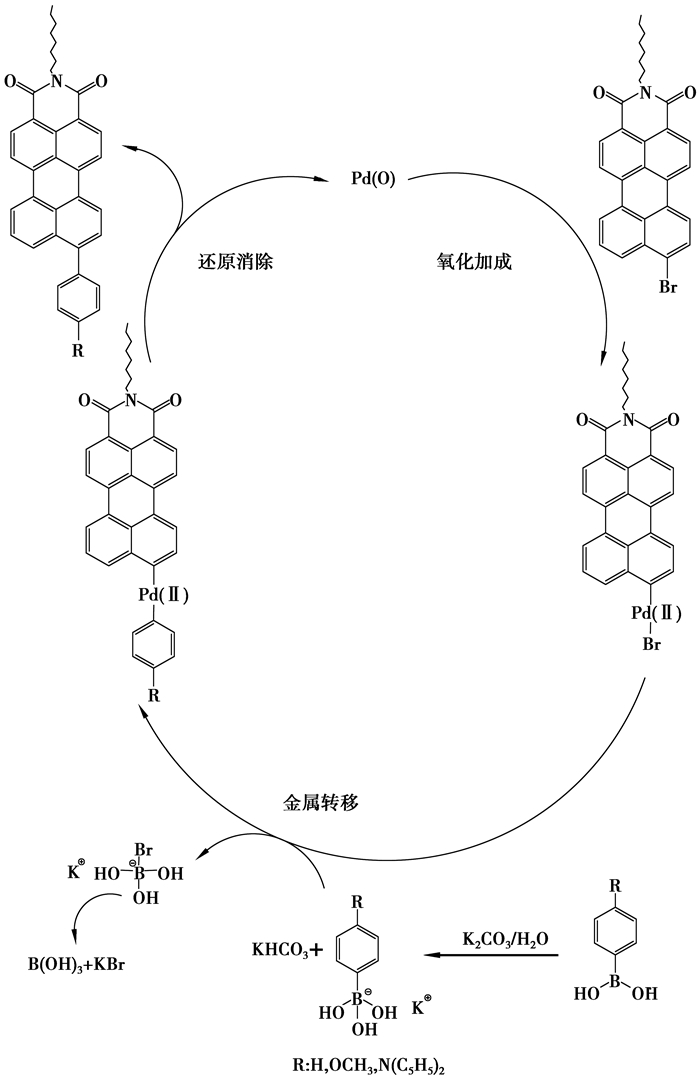
|
图 4 Suzuki偶合反应的机理 |
表征:以9-苯基-N-正辛基-苝-3,4-二羧酸单酰亚胺(C1)为例,简单分析化合物的1H-NMR谱。化合物上H的位置(C1)如图 5所示。它可以简单的分成3个部分,酰胺上的长的直链取代基、苝环和苝环上的取代基。由于酰胺是一个吸电子基,故而正辛基的16和17位上电荷密度减小,特别是16位,其位移δ值明显增大,在4.2~4.1表现出一个三峰;17位在1.8~1.7表现出一个五重峰,18~12位在1.5~1.2表现出一个复杂的多峰,23位为甲基,在0.90~0.86表现出一个三峰。苝酰亚胺的苝环上1H-NMR的化学位移在δ=7.5~9均表现出苝环的多重峰,在9-苯基-N-正辛基-苝-3,4-二羧酸酰亚胺上,由于苝环处于一个近似对称的结构,所以1和8,2和7,3和6,4和5,9和10位上的H的δ相近,苝环是一个大的π结构,上面的电荷密度分布相对均匀,但由于酰胺的吸电子作用的影响,导致3和6,4和5位电荷密度减小,故而在1H-NMR上表现出在9~8.5出现4个明显的双峰。由于苯的供电作用的影响,导致1和8,2和7,10位的电荷密度增加,故在1H-NMR上表现出在7.5~8.5出现4个明显的双峰且在7.6~7.5出现一个三峰。取代基苯上11,12,13,14,15位的H相近,在1H-NMR上表现出在7.5左右。
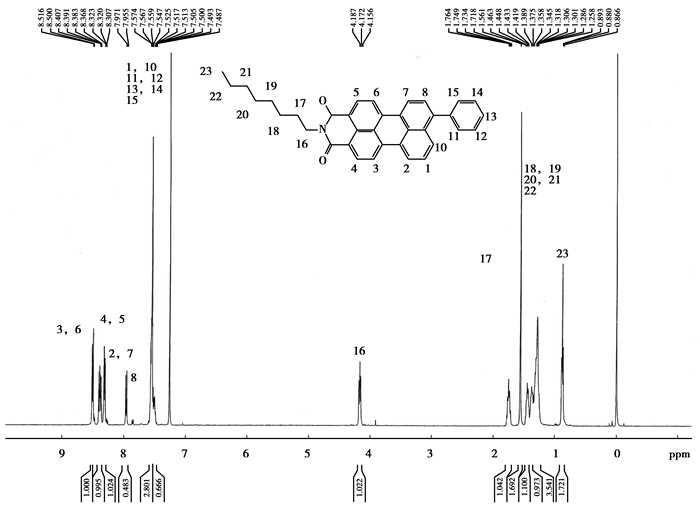
|
图 5 C1结构式及1HNMR分析 |
称取9-苯基-N-正辛基-苝-3,4-二羧酸单酰亚胺(C1)100 mg放入5 mL容量瓶中加入二氯甲烷定容且完全溶解,其溶液呈透明橘黄色,如图 6(a)所示;称取9-(4-甲氧基苯基)-N-正辛基-苝-3,4-二羧酸单酰亚胺(C2)100 mg放入5 mL容量瓶中加入二氯甲烷定容且完全溶解,其溶液呈透明红色,如图 6(b)所示;称取9-{4-(二苯基胺基)苯基}-N-正辛基-苝-3,4-二羧酸单酰亚胺(C3)100 mg放入5 mL容量瓶中加入二氯甲烷定容且完全溶解,其溶液呈透明紫色,如图 6(c)。

|
图 6 化合物C1~C3在二氯甲烷溶液(ca= 3.92×10-3 mol/L,cb=3.72×10-3 mol/L,cc=2.95×10-3 mol/L) |
目标化合物在极性溶剂乙酸乙酯溶解性最好,这是因为乙酸乙酯的极性较二氯甲烷、苯、环己烷的极性要大,故以荧光紫外图谱以乙酸乙酯为化合物的典型溶剂,其次是在二氯甲烷中有很好溶解性,在非极性溶剂苯和环己烷中也有一定的溶解性;这是因为在9位引入取代基破坏了苝亚胺衍生物的稠环共轭体系的共平面性,使分子之间的大π键相互作用大大降低,晶格能也随之降低,从而使目标化合物的溶解性增加。
2.3 紫外-可见光谱分析将化合物C1,C2和C3配成1×10-5 mol/L不同溶剂的稀溶液进行紫外-可见光谱分析,测得化合物C1-C3在不同溶剂中的最大吸收波长(λabsmax:nm)和摩尔消光系数(ε:mol-1·cm-1),结果如表 1所示。
| 表 1 化合物C1~C3在不同溶剂中的最大吸收波长(λabsmax:nm)和摩尔消光系数(ε:1×10-5 mol-1·cm-1) |
从表 1中可以看出,C1-C3均有较高的摩尔消光系数,但C1均高于C2,C3,这是因为引入苯基使得苝类分子具有更大的平面性,故而增强了分子的共轭性,而C2,C3由于引入甲氧基与N,N-二苯基氨基,一定程度上对苝环进行了一定程度的扭曲,苝环平面性遭到破坏,故而吸收强度反而下降。由表 1可以看出在环己烷,二氯甲烷中C1明显高于C2,C3,在苯中,3种分子的摩尔消光系数相差不大,在乙酸乙酯中C1的摩尔消光系数与C2相近,这是由于溶剂效应造成的,不同极性溶剂与化合物之间的相互之间的作用不同,特别是溶剂分子与供电基团中的氧原子,氮原子之间静电作用大小不同。在典型溶剂乙酸乙酯中的紫外-可见吸收光谱如图 7示。在光谱图中可以看到化合物C1,C2,C3在400~550 nm均有吸收,C3更是延展到了600 nm,这是因为随着引入的基团的供电子能力增强,最大吸收波长变长,吸收强度变大;相比于C1,由于C2和C3分别引入了供电基团甲氧基与N,N-二苯基氨基使其紫外-可见吸收光谱发生红移。
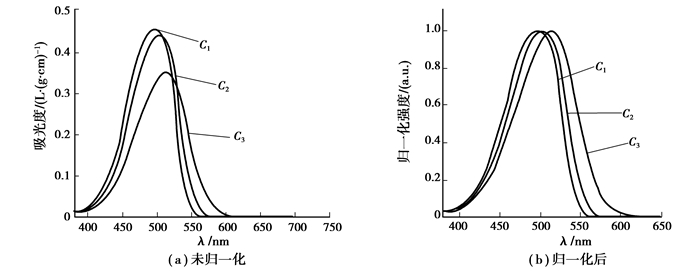
|
图 7 化合物C1~C3在乙酸乙酯(c=1×10-5 mol/L)中的紫外可见光谱 |
将化合物C1,C2,C3配成1×10-5 mol/L不同溶剂的稀溶液进行荧光分析,测定在不同溶剂中的荧光最大发射波长(λfmax)其结果如表 2所示,从表 2中可以看出,随着取代基供电子能力的增加,荧光最大发射波长(λfmax)发生红移,这是由于供电基团的影响使苝环上电子云密度增大,分子从基态到激发态的过程中也随之发生更强的分子内电荷转移,分子内电荷转移过程中会损失部分能量,即发生非辐射跃迁。
| 表 2 化合物C1~C3在不同溶剂中(c=1×10-5 mol/L)的荧光最大发射波长(λfmax) |
在典型溶剂乙酸乙酯中的荧光光谱图如图 8所示,在光谱图可以看出,相比于C1,由于C2和C3分别引入了供电基团甲氧基与N,N-二苯基氨基使其荧光发射光谱红移。
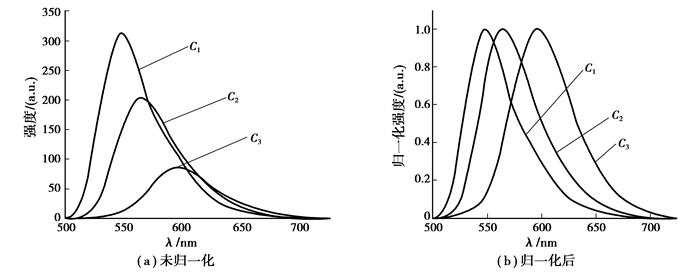
|
图 8 化合物C1~C3在乙酸乙酯(c=1×10-5mol/L)中的荧光发射光谱 |
通过Suzuki偶合反应合成了3种新型的9-取代基-N-正辛基-苝-3,4-二羧酸单酰亚胺衍生物:C1,C2和C3,其1HNMR分析结果表明:合成的产物的结构与目标分子结构相符,反应收率在70%左右。
引入不同取代基的化合物C1,C2和C3不仅在极性溶剂乙酸乙酯和二氯甲烷中有很好溶解性,在非极性溶剂苯和环己烷中也有一定的溶解性,而且很大程度上改变其光学性质:由于C2,C3化合物相比C1引入了供电基团,从而使得化合物C2,C3的紫外-可见光谱和荧光光谱都发生红移。为在现实中太阳能电池,有机发光二极管、光流放大、激光染料、物学方面,荧光探针、纳米材料、液晶显示材料等方面的应用提供更广阔的空间。
| [1] | Williams R M, Ivo N V A, Stokkum H M V. Triplet formation by charge recombination in thin film Blends of perylene red and pyrene:developing a target model for the photophysics of organic photovoltaic materials[J]. Physical Chemistry B, 2013, 117: 1239–11248. |
| [2] | Kim B J, Yu H, Oh J H, et al. Electrical transport through single nanowires of dialkyl perylene diimide[J]. Journal Physical Chemistry C, 2013, 117: 10743–10749. DOI:10.1021/jp400807t |
| [3] | Kaur B, Quazi N, Ivanov I, et al. Near-infraredreflective properties of perylene derivatives[J]. Bhattacharya Dyes and Pigments, 2012, 92: 1108–1113. DOI:10.1016/j.dyepig.2011.06.011 |
| [4] | Ye T, Singh R, Butt H J, et al. Effect of local and global structural order on the performance of perylene diimide excimeric solar cells[J]. ACS Appl.Mater.Interfaces, 2013, 27(5): 11844–11857. |
| [5] | Benjamin W E, Veit D R, Perkins M J, et al. Sterically engineered perylene dyes for high efficiency oriented fluorophore luminescent solar concentrators[J]. Chemistry of Materials, 2014, 26(3): 1291–1293. DOI:10.1021/cm403286v |
| [6] | Dimitrov S D, Durrant J R. Materials design considerations for charge generation in organic solar cells[J]. Chemistry of Materials, 2014, 26(1): 616–630. DOI:10.1021/cm402403z |
| [7] | Luo J, Xu M F, Li R Z, et al. N-annulated perylene as an efficient electron donor for porphyrin-based dyes:enhanced light-harvesting ability and high-efficiency Co(Ⅱ/Ⅲ)-based dye-sensitized solar cells[J]. Journal of American Chemical Socciety, 2014, 136(1): 265–272. DOI:10.1021/ja409291g |
| [8] | Avlasevich Y, Li C, Klaus M. Synthesis and applications of core-enlarged perylene dyes[J]. Journal of Materials Chemistry, 2010, 20(19): 3814–3826. DOI:10.1039/c000137f |
| [9] | Mato A F, Quintela J M, Peinador C. Novel naphthyridine-based compounds in small molecular non-doped OLEDs:synthesis, properties and their versatile applications for organic light-emitting diodes[J]. New Journal of Chemistry, 2012, 36(8): 1634–1640. DOI:10.1039/c2nj40279c |
| [10] | Kim Y, Oh S J, Lee J, et al. Surgical treatment of dermatomal capillary malformations in the adult face[J]. Arch Plast Surg, 2012, 39(2): 126–129. DOI:10.5999/aps.2012.39.2.126 |
| [11] | Ivlev S, Woidy P, Sobolev V, et al. On tetrafluorobromates(Ⅲ):crystal structures of the dibromate CsBr2F7 and the monobromate CsBrF4[J]. Zeitschrift für anorganische und allgemeine Chemie, 2013, 639(15): 2846–2850. |
| [12] | Chen K W, Fang T C, Chang M J. Synthes-is, photophysical and electrochemical properties of 1-aminoperylene bisimides[J]. Dyes and Pigments, 2012, 92(1): 517–523. DOI:10.1016/j.dyepig.2011.06.023 |
| [13] | Perrin L, Hudhomme P. Synthesis, electroche -mical and optical absorption properties of new perylene -3, 4:9, 10-bis(dicarboximide)and perylene-3, 4:9, 10-bis -(benzimidazole)derivatives[J]. Eur.J.Org.Chem, 2011: 5427–5440. |
| [14] | Haluk D, Eevki K S, Slddlk I. Fluorescent macromolecular perylene diimides containning pyreneor indole units in bay positions[J]. Dyes and Pigments, 2010, 86(1): 32–41. DOI:10.1016/j.dyepig.2009.11.005 |
| [15] | Langhals H, Hofer A. Controlling UV/vis absorption and stokes shifts in highly fluorescent chromophores by molecular dynamics in targeted construction of dyads[J]. Journal of Organic Chemistry, 2012, 77: 9585–9592. DOI:10.1021/jo301417p |
 2014, Vol. 37
2014, Vol. 37

