桑白皮是桑科桑属植物桑干燥的根皮,药典记载它有清肺平喘、利尿消肿作用,主治肺热喘咳、水肿、腹胀和小便不利。此外文献报道其有降血压、降血脂、降糖[4-5]、镇痛[6]、抗菌、抗炎[8-9]、抗癌及抗HIV的作用。近来也有学者开始研究其抗氧化活性[10-11],发现其对心脑血管有保护作用,对受损细胞亦有修复功效[12]。其药理作用与桑白皮主要活性成分多糖等含量相关。目前对桑白皮多糖的研究甚少,因而开展桑白皮多糖的提取、分析、药理作用及资源的开发等方面的研究对揭示桑白皮疗效与其活性成分之间关系有重要的意义。首先,与传统煎煮提取工艺相比较,本试验采用超声辅助微热提取多糖,不仅增加多糖提取率减少提取周期,而且最大程度保持样品不失真;其次,采用正交试验设计对桑白皮多糖的提取工艺进行优化,从全面试验中科学选出有代表性的均匀分散的点进行试验,不仅减少工作量节省工作时间而且更准确、高效、快速、经济和科学;再者,实验测定了桑白皮多糖的抗氧化活性,寄望为桑白皮多糖开发利用提供理论依据,为功能食品或药品的开发研制提供一定参考。
1 材料与试剂 1.1 仪器与试剂IFFM-E型流动注射化学发光分析仪(西安瑞迈分析仪器有限公司),IKA FLEX旋转蒸发仪RV10数显型(德国IKA),KQ-100型超声清洗器(昆山市超声仪器有限公司),TGC-16B高速台式离心机(上海安亭科学仪器厂),DELTA 320 pH计(梅特勒托利多仪器有限公司)。DISCV-Ⅲ型艾柯超纯水机(成都唐氏康宁科技发展有限公司)以及常规实验仪器。
Luminol 3-氨基邻苯二甲酰肼(Sigma公司产品纯度≥98%),桑白皮购买于重庆市某药店,实验所用试剂均为分析纯,所用水均为去离子水。
1.2 溶液配制 1.2.1 苯酚溶液的制备称取苯酚200 g,加铝片0.2 g和碳酸氢钠0.1 g,常压蒸馏,收集182 ℃馏分,称取该馏分50 g,置于100 mL量瓶中,加水微热溶解并稀释至刻度,摇匀后至棕色瓶中,即为50 %苯酚储备液,4 ℃冷藏备用。精密量取10 mL50 %苯酚液,置100 mL量瓶中,加水定容,即得5 %苯酚液,现配现用。
1.2.2 DNS试剂的制备称取3,5-二硝基水杨酸(DNS)3.15 g,溶于131 mL浓度为2.0 mol/L的氢氧化钠溶液中,将此溶液加入到250 mL含有92.5 g酒石酸钾钠的热水溶液(水温小于45 ℃)中,再加入2.5 g重蒸苯酚和2.5 g亚硫酸钠,搅拌溶解,冷却后定容至500 mL,贮存于棕色瓶中,放置一周后使用。
1.2.3 葡萄糖溶液的配制准确称取0.1 g于105 ℃烘干至恒重的葡萄糖标准品,置100 mL量瓶中,加水溶解并定容,即得质量浓度为1 mg/mL的标准品贮存液。使用前精密量取10 mL置100 mL量瓶中,加水定容,摇匀,即得0.1 mg/mL标准品使用液。
2 实验方法 2.1 桑白皮多糖的提取工艺优化方法采用L9(34)正交试验设计[13]对桑白皮多糖的提取工艺进行考察。将干燥的桑白皮粉碎过80目筛,称取1.00 g,加一定量水经超声提取,抽滤后收集滤液,减压蒸馏浓缩至粘稠状,冷却加20倍体积无水乙醇对多糖进行醇沉,微热使沉淀成长,冷却后于冰箱放置隔夜过滤。沉淀用无水乙醇洗涤多次,在30 ℃下干燥至恒重。以提取百分率为评价指标,寻找最佳提取工艺。并对最佳工艺进行实验验证。在此条件下对200 g桑白皮进行提取,对得到产品进行重结晶除杂后用于后续实验。
2.2 桑白皮多糖百分含量测定方法采用苯酚硫酸法[14]测定总糖含量,分别精密吸取0.1 mg/mL葡萄糖标准溶液0(空白对照),0.2,0.4,0.6,0.8,1.0 mL,置于10 mL具塞试管中,加蒸馏水至1 mL,分别加入1.0 mL 5%的苯酚溶液,混匀,缓慢加入3.0 mL浓硫酸,摇匀,静置5 min,置沸水浴中加热15 min后取出,冷却,以相应溶剂为空白,以对照组为背景,于490 nm处测定吸光度值。
DNS法[15]测定其中还原糖的含量,分别精密吸取0.1 mg/mL标准品溶液0(空白对照),0.2,0.4,0.6,0.8,1.0 mL,置10 mL具塞试管中,加水至2 mL,加1.5 mLDNS试剂,混匀,置沸水浴中加热15 min后取出,以相应溶剂为空白,对照组为背景,于540 nm处测定吸光度值,分别以葡萄糖的含量为横坐标,吸光度为纵坐标,绘制标准曲线,求得总糖和还原糖含量。多糖含量记为总糖减去还原糖。
2.3 桑白皮多糖抗氧化活性测定方法 2.3.1 清除DPPH·自由基活性测定取一系列多糖样品溶液或Vc溶液于10 mL具塞刻度试管中,加水至3 mL,后加1 mL 1,1-二苯基-2-三硝基苯肼(DPPH)标准使用液,迅速盖上混匀,于暗处避光放置30 min后在517 nm测定吸光度。以水代替样品溶液、50%乙醇代替DPPH作空白对照和背景对照,DPPH自由基清除率由如下公式计算:
DPPH·清除率%=100%×[A1-(A2-A3)]/A1,
式中:A1为以无水乙醇代替样品溶液及蒸馏水的吸光值;A2为样品溶液的吸光值;A3为以无水乙醇代替DPPH的吸光值。将清除率同质量浓度作非线性拟合得到拟合方程,计算IC50值,以此表示抗氧化能力大小。
2.3.2 清除·OH自由基活性测定采用luminol从六通阀引入的抑制化学发光法,首先H2O2与Fe2+反应产生·OH在碱性条件下氧化luminol发光,当加入多糖溶液或Vc时,由于对·OH的清除从而使发光减弱。减弱程度依赖于抗氧化剂加入量。将抗氧化剂对·OH的清除率对其浓度做曲线拟合,得到拟合方程,求出半数清除浓度IC50值。
参数:负高压780 V,增益2,主副泵转速30 r/min,进样时间t=1 s,0.004 mmol/L luminol,0.09% H2O2,0.01 mmol/L Fe2+。
2.3.3 清除·O2-自由基活性测定同样采用抑制化学发光法,邻苯三酚在碱性条件下自氧化产生·O2-氧化 luminol发光,当加入多糖溶液或Vc时,由于对·O2-的清除从而使发光减弱。减弱程度依赖于加入抗氧化剂量。计算方法与·OH相同。
参数:负高压780 V,增益4,主副泵转速30 r/min,进样时间t=2 s,luminol 0.04 mmol/L,PH为10.25碳酸盐缓冲溶液0.1 mol/L,邻苯三酚0.04 mmol/L。
3 结果与讨论 3.1 提取方法的选择多糖常有的提取方法有4种:水热浸提法、超声辅助提取法、微波辅助提取法和酶辅助提取法。第1种方法为最原始的提取方法,也是家庭煎煮最常用方法,缺点是提取时间长,且提取效率不高。后3种方法是在前者基础上增加辅助手段以达到快速、高效的目的。王芳[15]等比较了4种方法得到多糖提取率依次为酶辅助法>超声辅助法>微波辅助法>水浸提法。酶法提取效率虽然高,但需要价格昂贵的生物酶,因此,综合考虑成本、工作效率及提取率三方面因素,笔者选择超声辅助提取法作为桑白皮多糖提取方法,此外超声辅助微热提取能更大限度地保持样品不失真。
3.2 正交实验因素和水平的选择影响多糖提取效率的因素有提取温度、提取时间、提取次数、溶剂用量、辅助手段及颗粒度大小等。本实验选用超声辅助手段,因此主要涉及超声提取温度、提取时间、提取次数和溶剂用量。多糖的溶解度与温度具有密切关系,随着温度升高溶解度迅速增大,然而植物根皮中淀粉在温度达到53 ℃时开始糊化,因此本实验选择了30 ℃、40 ℃、50 ℃ 3个水平进行考察。通常提取时间越长提取率越高,但时间的延长必然伴随工作效率的降低,同时也增加杂质含量。参考文献并结合实际,超声时间选择了30、45、60 min 3个水平。提取次数一般大于1次,不超过5次,因此选择2、3、4次3个水平。加水量少造成浸提不充分,但水量过度的加大又会给后续工作比如浓缩干燥增加负担,在预实验基础上选择20、30、40倍加水量进行考察。除此以外实验时还必须注意原料颗粒大小对提取效率和实际操作的影响。一般情况下颗粒越小提取越充分,但是颗粒太小加热时容易出现溶胀现象,反而造成浸提不充分、抽滤困难,从而增加后续工作量,降低工作效率。实际生产中通常不会对颗粒大小进行严格控制,本实验也没有特意考察颗粒大小,操作时只需根据实际需求适当处理得到合适颗粒度即可。
3.3 数据分析与结果验证按照正交试验设计的9个实验组进行实验,每组平行做3个,以提取率的平均值为考察指标,结果见表 1。
| 表 1 L9(34)正交试验设计表 |
由表 1直观分析结果显示优选方案为A1B1C3D1,即提取条件为加水倍数20倍、超声时间30 min、提取温度50 ℃、提取次数2次时桑白皮多糖提取效果最好。由极差值可以看出,各因素对桑白皮提取影响程度不同,其中温度对多糖提取率影响较大,而加水倍数、超声时间和提取次数的影响相对较小。为了了解这种影响是否显著,对数据的波动进行了方差分析如表 2所示。
| 表 2 正交试验方差分析结果 |
表 2显示温度因素的F值大于临界值,因此在选择温度水平时需略加注意,而加水倍数、超声时间、提取次数对提取率不构成显著性影响。实际操作中可综合工作量进行合理选择。
因理论优选方案未在实验组中出现,故对其进行放大实验验证。具体为:在拟定最优条件下,提取样品200 g得到多糖12.59 g,提取率6.30%,将此结果与实验组3进行对比,不难看出在提取时间减少一半,提取次数减少2次的情况下,提取率仅减少0.1 %,此结果是令人满意的。与传统水煎煮提取法[16]相比,采用超声辅助手段将多糖提取率平均提高了2.6个百分点。
3.4 多糖的含量测定多糖在浓硫酸作用下,脱水生成的糠醛或羟甲基糠醛能与苯酚缩合成一种橙红色化合物,在490 nm波长下有最大吸收峰,将吸光度对浓度拟合得到关系式:y=7.613 3x-0.141 6,R2=0.981 7计算得样品真实质量浓度0.063 mg/m L,则多糖提取物百分含量为63%。
还原糖在碱性条件下与3,5-二硝基水杨酸共热,将其还原为棕红色的3-氨基-5-硝基水杨酸,在540 nm波长有紫外吸收,还原糖本身则被氧化成糖酸。将吸光度对浓度作线性拟合得y=1.51x+0.031 6,R2=0.994 9,计算还原糖含量为27%。
则多糖纯度为:63%-27%=36%,该测定方法结果高于梁静等[17]先除掉还原糖后测定的多糖纯度34.87%。因为每一次提纯过程中必定伴随目标样品的损失。
3.5 桑白皮多糖的自由基清除能力测定 3.5.1 清除·DPPH能力测定和·OH能力测定桑白皮多糖多两种自由基清除结果如表 3所示,具体情况如图 1和图 2所示。
| 表 3 多糖清除DPPH和·OH测定结果 |
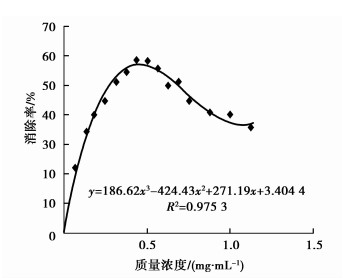
|
图 1 多糖清除DPPH测定 |
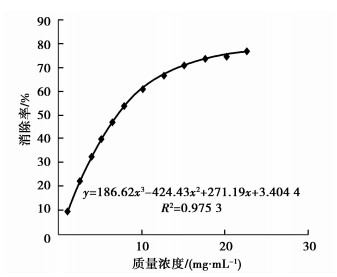
|
图 2 多糖清除·OH测定 |
由表 3显示采用DPPH法测得多糖IC50值较大,为0.27 mg/mL,图 3曲线后来下降的原因可能是多糖与DPPH的反应生成联胺化合物在517 nm也有吸收,且随质量浓度增加而增大,加之受多糖自身在醇溶液中溶解度的限制,导致测定结果偏小。与之对照Vc的IC50值为3.29 μg/mL,多糖的DPPH清除能力较小。·OH法测得多糖IC50值为6.78 μg/mL,Vc的IC50值为2.86 μg/mL,数据显示多糖对·OH表现出显著的清除作用。
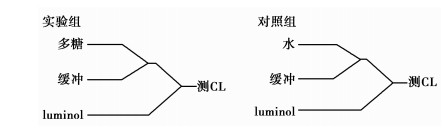
|
图 3 多糖验证实验流路设计 |
清除·O2-实验测定中发现特殊情况,化学发光强度不但没有减弱反而增强,并且增强程度与多糖加入量有关,在一定浓度范围内,化学发光增强随多糖浓度增大而增大。对此现象的原因进行两个假设猜想:1)多糖在该体系中自己产生·O2-氧化luminol产生化学发光;2)多糖对邻苯三酚体系产生的超氧阴离子不仅没有清除作用,反而促进其产生·O2-。
为了验证猜想设计两组实验。
第1组实验方法:去掉邻苯三酚,让多糖直接与缓冲液和luminol混合以是否产生化学发光作为结果判定,以水作为对照,如图 3所示。
结果两组实验均未检测到化学发光,因此排除多糖产生·O2-的猜想。所以多糖在这个体系中可能是促进邻苯三酚的氧化,并且这种作用依赖于多糖的加入量。设计实验对结果进行验证。
第2组实验:采用邻苯三酚多糖-luminol混合模式,先以水做空白混合一段时间后换成多糖溶液。发光动力学曲线如图 4所示,表明多糖对该体系具有增敏作用,配制不同质量浓度的多糖测定其对发光强度的增加百分率,将发光强度增加百分率对多糖浓度进行相关性拟合得到关系式y=25.353x+11.73,R2=0.980 4,结果表明促进作用对多糖剂量依赖,且线性相关。
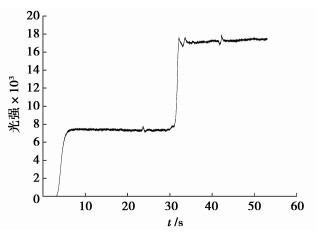
|
图 4 多糖促发光动力学曲线图 |
笔者以提取率为指标采用正交试验设计优化实验方案对桑白皮多糖提取工艺进行研究,得到最佳提取条件为:加水倍数20倍、超声时间30 min、提取温度50 ℃、提取次数2次。与单因素试验相比,只需用较少试验次数即可获得最佳实验方案,省时又节约经费,还可通过方差分析比较各因素对结果影响程度大小,对于影响不显著的,可根据实际需求合理选择。
自由基清除实验表明桑白皮多糖多糖具有一定的DPPH自由基清除作用和明显的·OH自由基清除作用,具有一定的开发利用价值。桑白皮多糖对邻苯三酚碳酸盐-luminol发光体系具有增敏作用,并且具有剂量依赖性,该发现有望发展为多糖的含量测定提供新方法等,具有潜在应用价值。然而这种作用的机制目前还有待进一步研究,因此展开对桑白皮多糖结构的研究对于揭示其独特功效机理以及后续研究都具有重要意义。
| [1] | 国家药典委员会. ZBBZH/ZY/1-2010中华人民共和国药典一部[S]. 北京: 中国医药科技出版社, 2010. |
| [2] | Chang J J, Shu M J, Huang H P, et al. Mulberry anthocyanins inhibit oleic acid-induced lipid accumulation by reduction of lipogenesis and promotion of hepatic lipid clearance[J]. Journal of Agricultural and Food Chemistry, 2013, 61(25): 6069–6076. DOI:10.1021/jf401171k |
| [3] | Liu L K, Chou F P, Chen Y C, et al. Effects of mulberry (Morus alba L.)extracts on lipid homeostasis in vitro and in vivo[J]. Journal of Agricultural and Food Chemistry, 2009, 57(16): 7605–7611. DOI:10.1021/jf9014697 |
| [4] | Stefanut M N, Cata A, Pop R, et al. Anti-hyperglycemic effect of bilberry, blackberry and mulberry ultrasonic extracts on diabetic rats[J]. Plant Foods for Human Nutrition, 2013, 68(4): 378–384. DOI:10.1007/s11130-013-0380-y |
| [5] | Chan K C, Lin M C, Huang C N, et al. Mulberry 1-deoxynojirimycin pleiotropically inhibits glucose-Stimulated vascular smooth muscle cell migration by activation of AMPK/RhoB and down-regulation of FAK[J]. Journal of Agricultural and Food Chemistry, 2013, 61(41): 9867–9875. DOI:10.1021/jf403636z |
| [6] | Cui J, Li C, Jiang Z S. Antioxidant and analgesia activities of total flavonoids from the root bark of morus alba[J]. Food Science, 2011, 32(23): 281–284. |
| [7] | Zhang X M, Liao W F, Cong Q F, et al. Isolation and structural characterization of the polysaccharides of cortex mori radices[J]. Acta Chimica Sinica, 2013, 71(5): 722–728. DOI:10.6023/A13010109 |
| [8] | Oh T S, Choi D K, Yun J W. Morus alba L. root bark stimulates adipocyte differentiation in 3T3-L1 cells[J]. Biotechnology and Bioprocess Engineering, 2011, 16(5): 978–986. DOI:10.1007/s12257-011-0174-8 |
| [9] | Yadav V R, Prasad S, Sung B, et al. The role of chalcones in suppression of NF-κB-mediated inflammation and cancer[J]. International Immunopharmacology, 2011, 11(3): 295–309. DOI:10.1016/j.intimp.2010.12.006 |
| [10] | Yang J Y, Lee H S. Evaluation of antioxidant and antibacterial activities of morin isolated from mulberry fruits (Morus alba L.)[J]. Journal of the Korean Society for Applied Biological Chemistry, 2012, 55(4): 485–489. DOI:10.1007/s13765-012-2110-9 |
| [11] | Ma C L, Zhou J, Sun W F, et al. Research on extraction of morus nigra linn polysaccharide and its antioxidant activity[J]. The Food Industry, 2011(8): 71–74. |
| [12] | Feng B H, Su H H, Yang J J. Study on vasodilating mechanism of the acetone extract from cortex mori[J]. Traditional Chinese Drug Research & Clinical Pharmacology, 2005, 16(4): 247–250. |
| [13] | 方开泰, 马长兴. 正交与均匀设计[M]. 北京: 科学出版社, 2001: 40-51. |
| [14] | Zhuang X W, Liu X F, Mao G Y, et al. Determination of lethariella cladonioides polysaccharide from tibet[J]. Chinese Journal of Experimental Traditional Medical Formulae, 2012, 18(4): 103–106. |
| [15] | Wang F, Zheng H X. Several extraction processes of polysaccharide from Morus aLba L. leaves[J]. Journal of Zhejiang Normal University:Natural Sciences, 2008, 31(1): 77–83. |
| [16] |
张帆, 刘宏炳, 田树革, 等.
药桑中黄酮和多糖的超声提取与含量测定[J]. 西北药学杂志, 2008, 23(5): 282–283.
ZHANG Fan, LIU Hongbing, TIAN Shuge, et al. Ultrasonic extraction and content determination of total flavonoids and polysaccharide from Morus nigra Linn[J]. Northwest Pharmaceutical Journal, 2008, 23(5): 282–283. (in Chinese) |
| [17] | Liang J, Liu X Y, Deng B Y, et al. Extraction of polysaccharides from zizyphus jujube and evaluation of anti oxidant activity[J]. Food Science and Technology, 2012, 37(1): 177–181. |
 2014, Vol. 37
2014, Vol. 37

