2. 中国科学院过程工程研究所绿色过程与工程重点实验室,北京 100190;
3. 中国科学院大学,北京 100039
2. Key Laboratory of Green Process and Engineering, Institute of Process Engineering, Chinese Academy of Sciences, Beijing 100190, P.R.China;
3. University of Chinese Academy of Science, Beijing 100049, P.R.China
粉煤灰是煤炭在燃煤锅炉中燃烧所残留的固体废物,其中含有大量的铝、铁、硅等元素,是一种十分重要的非传统氧化铝资源。从粉煤灰中提铝属于粉煤灰精细化利用技术,对减轻粉煤灰环境污染、扩大粉煤灰资源化利用途径具有积极意义[1]。目前,从粉煤灰中提铝的方法主要有:酸法、碱法、碳热氯化法等,各方法均存在不足之处。比如:酸法、碱法多用于高铝粉煤灰提铝,且工艺流程长[2];碳热氯化法对设备的耐腐蚀性要求比较高。金属的氯化物与其相应金属的其他化合物比较,大都具有低熔点、高挥发性等性质。氯化冶金是将矿物中氧化物转变为氯化物,并利用上述性质将氯化物与其他化合物和脉石分离的方法[3]。氯化冶金工艺具有对原料适应性强、分离效率高、综合利用效果好等优点。近年来,随着防腐蚀技术的发展,氯化冶金技术的应用也越来越广泛,应用于研究镁、铝、钛、铈、钽、钇、硼等元素的提取[4-9]。所谓固定床粉煤灰碳热催化氯化提铝方法,就是将催化剂、粉煤灰与碳混合造粒,然后通入氯气,在一定的条件下发生化学反应,使部分元素变为气态氯化物并收集提取的方法。
该课题在青海省西宁市进行。由于西宁地区平均海拔为2 295 m,气压为0.77 atm,因此,实验的各工艺参数与常压时均有差别,若按常压环境分析其氯化过程热力学,则结果难以准确。国内外学者研究不同催化剂对氯化结果的影响虽然较多,但很少就催化剂本身是否参与氯化反应进行深入探讨,对催化剂及其氯化产物与产品氯化铝在不同比例、不同温度下的反应也未做详细阐述。因此,笔者针对气压为0.77 atm的环境特点,利用和参考热力学软件Factsage相应模块的计算和分析结果,展开对粉煤灰碳热氯化热力学研究。
1 粉煤灰中物相组成粉煤灰化学组成与物相形态受燃煤组成、燃烧条件和燃烧程度等因素影响较大。中国粉煤灰以低钙灰为主,表 1和表 2给出了中国低钙粉煤灰化学组成与物相形态的一般范围[1]。
| 表 1 中国低钙粉煤灰的主要化学组成 Table 1 The main chemical composition of low calcium flyash of China |
| 表 2 中国低钙粉煤灰的主要矿物形态 Table 2 The main mineral phases of low calcium flyash of China |
由表 1和表 2可知:粉煤灰的化学组成与矿物组成波动范围很大,这也意味着其理化性质也有较大差异。为便于研究,分别从单体氧化物Al2O3、SiO2、Fe2O3的角度,讨论氯化过程。
2 优势区域图优势区域图是以图的形式表示系统内平衡状态与热力学参数的关系[10]。通过Factsage软件绘制的各温度下的Al-Cl-O、Fe-Cl-O、Si-Cl-O优势区域图,可以一目了然地看出氯化系统中为达到氯化物的生成所需要控制的PCl2(atm)与PO2(atm)。特别是对于存在多种价态、多种形态的氯化物而言,往往单纯用反应方程式热力学平衡计算难以完整描述其反应。
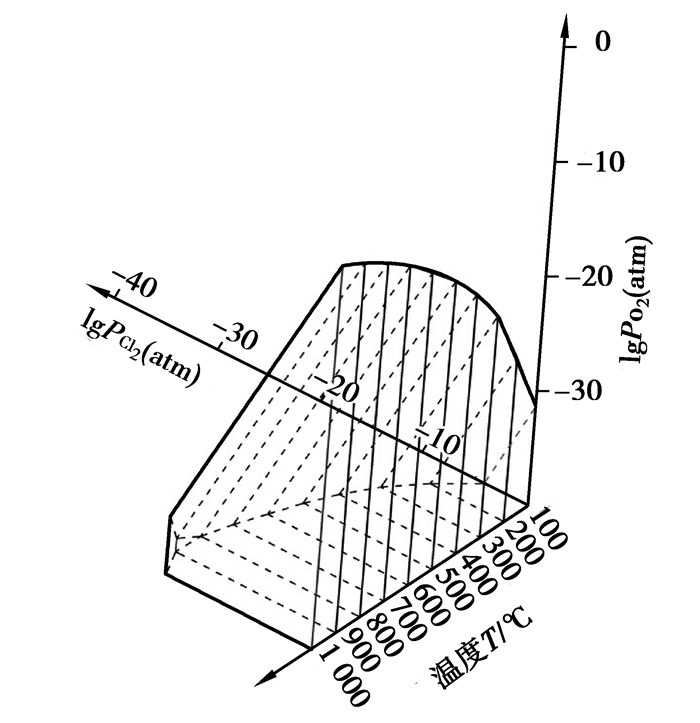
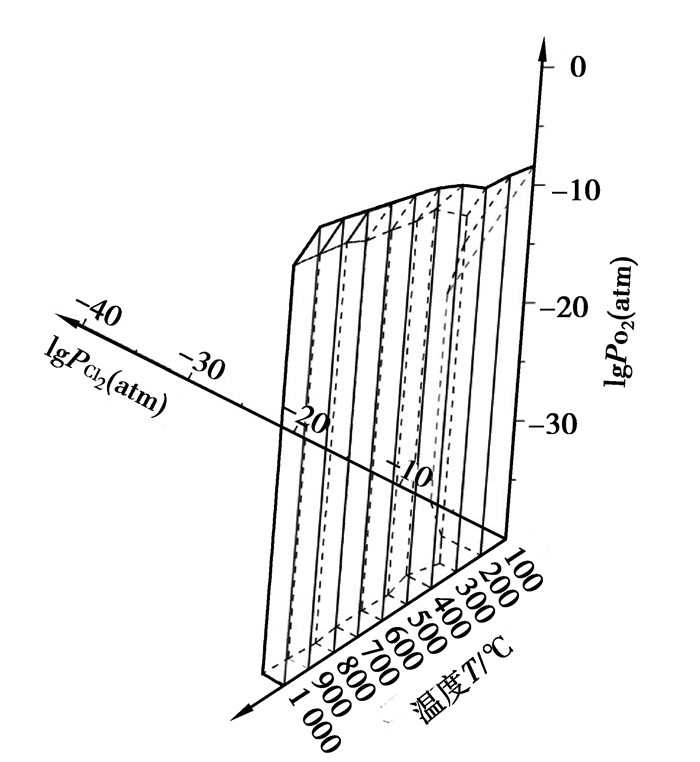
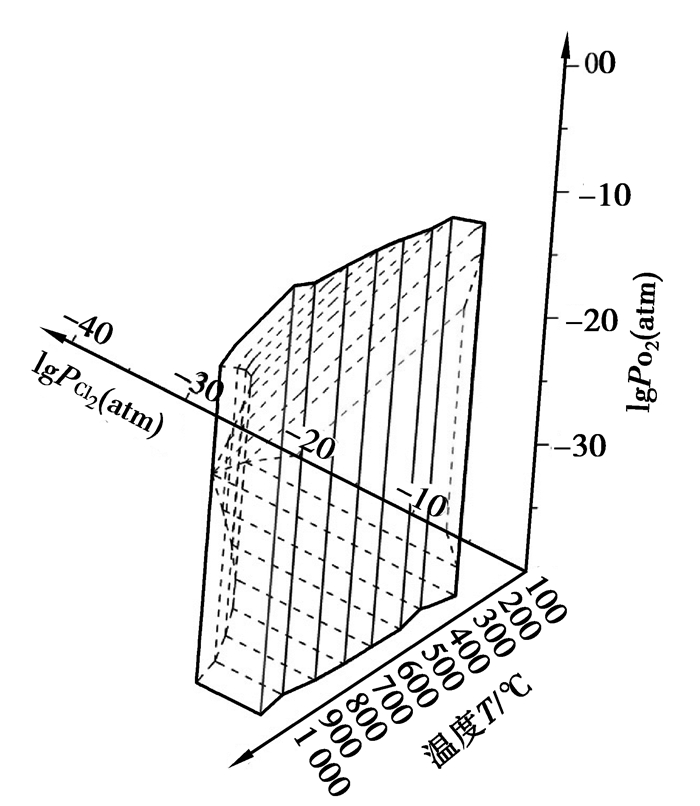
利用Factsage软件绘制0.77 atm下的Al-Cl-O、Fe-Cl-O、Si-Cl-O优势区域图,温度范围为100~1 000 ℃,观察各自主要氯化产物AlCl3(Al2Cl6)、FeCl3(Fe2Cl6)、FeCl2、SiCl4稳定区域与氯势、氧势的关系,以及随温度变化情况。由于绘制出的各温度下平面区域图较为冗繁,故以lgPCl2(atm)为X轴,范围-40~-0.11(PCl2=0.77 atm时对应的lgPCl2(atm));lgPO2(atm)为Y轴,范围-40~-0.11;温度为Z轴,范围为100~1 000 ℃。利用CAD软件,分别将Al、Fe、Si各自温度下主要氯化产物区域整合,即得到离散温度下的优势区域图。如果将各温度下区域边界端点用线相连,所形成立体图形,即可近似视为温度连续变化时各氯化物稳定区的变化情况。AlCl3(Al2Cl6)、FeCl3(Fe2Cl6)、FeCl2、SiCl4稳定区图分别如图 1~4所示。
|
图 1 AlCl3(Al2Cl6)优势区图 Figure 1 The predominance area diagram of AlCl3(Al2Cl6) |
|
图 2 FeCl3(Fe2Cl6)优势区图 Figure 2 The predominance area diagram of FeCl3(Fe2Cl6) |
|
图 3 FeCl2优势区图 Figure 3 The predominance area diagram of FeCl2 |

|
图 4 SiCl4优势区图 Figure 4 The predominance area diagram of SiCl4 |
图 1中存在凝聚相AlCl3和气态AlCl3(Al2Cl6)等组分;图 2存在凝聚相FeCl3与气相FeCl3(Fe2Cl6)等组分;图 3中FeCl2在不同温度下分别以固相、液相稳定存在;图 4中硅的氯化物均为气态SiCl4。
通过图 1可以看出,在所选的X和Y轴坐标范围内,从100 ℃逐渐升温至800 ℃过程中,各温度下AlCl3(Al2Cl6)的形成区域为直角三角形,并呈现逐渐扩大的趋势,即呈现其平衡线(直角斜边)向着低氯位、高氧位的方向迁移。这说明在这个温度范围内,随着温度的升高,有利于AlCl3(Al2Cl6)的形成。温度至900 ℃时,AlCl3(Al2Cl6)的形成区域转变为类似于直角梯形图形。温度逐渐升高至1 000 ℃时,图形的Y轴一侧的边依旧有所延长,然而X轴一侧的边却呈现逐渐收缩的趋势。图 4也表现了相近的趋势,只是区域图形转变的温度相比图 1更低些。图 2、图 3虽然区域变化不规则,但是依然能看出有类似于图 1、图 4的规律。由此可以推断出,随着温度的升高,Fe、Al、Si的主要氯化物的稳定性逐渐降低。
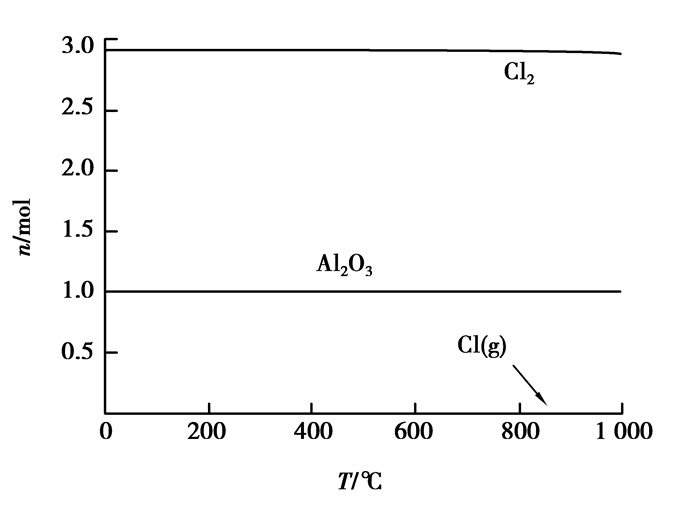
3 氯化反应热力学根据优势区域图所得到的不同温度下的产物,可知在100~1 000 ℃内,Al、Fe的主要氯化产物不唯一,且存在产物相互转化的平衡。对于复杂体系,无法只用反应方程式准确表达,如果利用Factsage软件平衡模块模拟特定条件下反应,预测了平衡产物组成则使问题变得简单直观。每摩尔Al2O3、Fe2O3、SiO2产生各自最高价氯化物对应氯气量分别为3 mol、3 mol、2 mol。因此分别模拟1 mol Al2O3与3 mol Cl2、1 mol Fe2O3与3 mol Cl2、1 mol SiO2与2 mol Cl2的反应平衡,如图 5~7所示。
|
图 5 Al2O3与Cl2反应平衡组分 Figure 5 The reaction equilibrium compositions of Al2Cl3 and Cl2 |
|
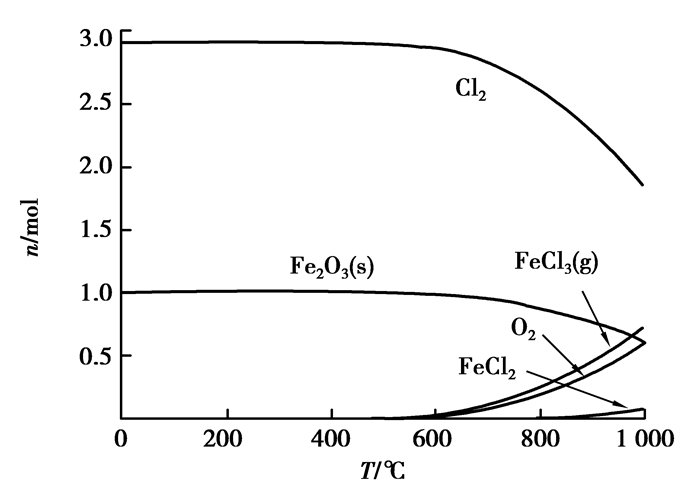
图 6 Fe2O3与Cl2反应平衡组分 Figure 6 The reaction equilibrium compositions of Fe2O3 and Cl2 |
|
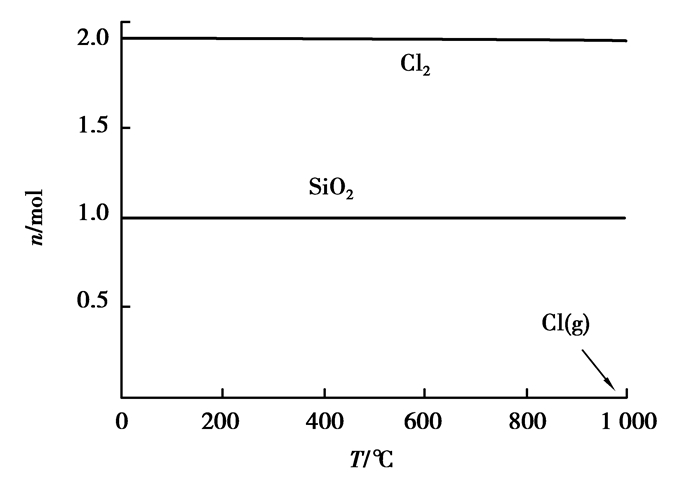
图 7 SiO2与Cl2反应平衡组分 Figure 7 The reaction equilibrium compositions of SiO2 and Cl2 |
通过图 5、图 7可以看出:Al2O3与SiO2在100~1 000 ℃时不会与Cl2自发进行反应。随着温度升高,Cl2分解产生高活性的气态氯原子数量有所增大,结合同核双原子分子反应机理,可推知氯气的反应活性随着温度的升高而增大。图 6显示,Fe2O3在500 ℃以后才能逐渐明显与Cl2反应,然而即使在1 000 ℃时,氯化率依然较低。结合图 1~4可以得出:为了达到从粉煤灰中提出铝等有价元素的目的,在保证所需氯气分压的同时,还需要降低反应过程中的氧气分压,即需要营造强还原性气氛。
4 碳热氯化热力学碳种类繁多、量大、价格低廉,在参与氯化反应时产生CO和CO2,污染程度较轻。针对难以直接与氯气反应的氧化物,碳热氯化是最常用的方法。
从热力学角度上来说,由于碳热氯化反应过程中,不仅存在氧化物氯化的过程,还存在碳气化反应,又称布多尔反应,即C+CO2(g)=2CO (g)的平衡,所以导致不同反应温度下生成的气态碳产物量的不同,导致耗碳量也随之不同。依旧采用Factsage平衡模块,在1 atm和0.77 atm时,碳气化反应平衡气相成分与温度关系如图 8所示。
|
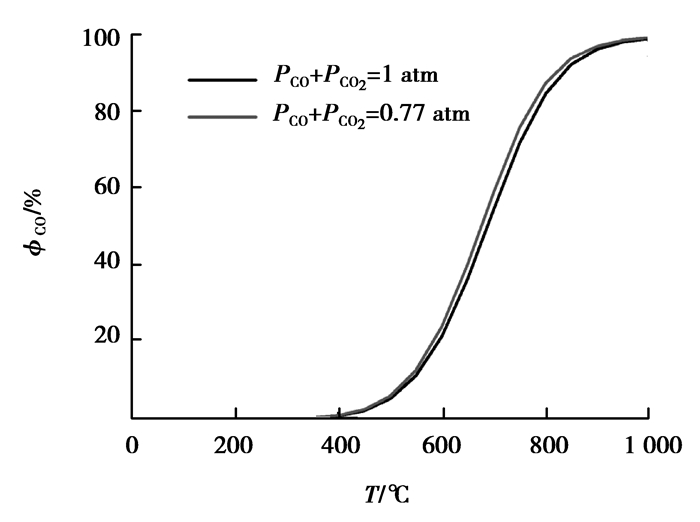
图 8 碳气化反应平衡气相成分与温度关系图 Figure 8 The carbon gasification reaction equilibrium gas compositions vs temperature |
碳气化是个吸热反应,随着温度的升高,平衡中CO的比例增大,相应CO2比例减少,这也意味着随着温度的升高,碳结合氧的效率也随之降低,即碳热氯化反应耗碳量也随之提高。如果各温度下,加碳量均只按照生成CO2来计算,则实际反应中会导致碳量不足,必定影响氯化效果。对比1 atm和0.77 atm时的CO百分比曲线可知:同温度时0.77 atm下的CO百分比更高,这意味着相比常压地区,在低压地区进行的碳热催化氯化反应,耗碳量更大。反应过程中,如果按照产物全为CO来计算碳量,则得出的碳量对于整个温度段来说都是过量的,因此,加入碳量按照每摩尔铝、铁、硅氧化物碳热氯化反应均生成CO时所需碳量模拟,则分别加入碳量为3、3、2 mol。Cl2用量则与图 5~7对应一致。利用Factsage软件针对不同温度,分别对1 mol的Al2O3、SiO2、Fe2O3的碳热氯化反应平衡进行模拟,预测结果如图 9~11所示。另外对1 mol的C与2 mol的Cl2反应平衡进行模拟,如图 12预测其产物对碳热氯化过程的影响。模拟条件是:气压为0.77 atm,温度范围为0~1 000 ℃。
|
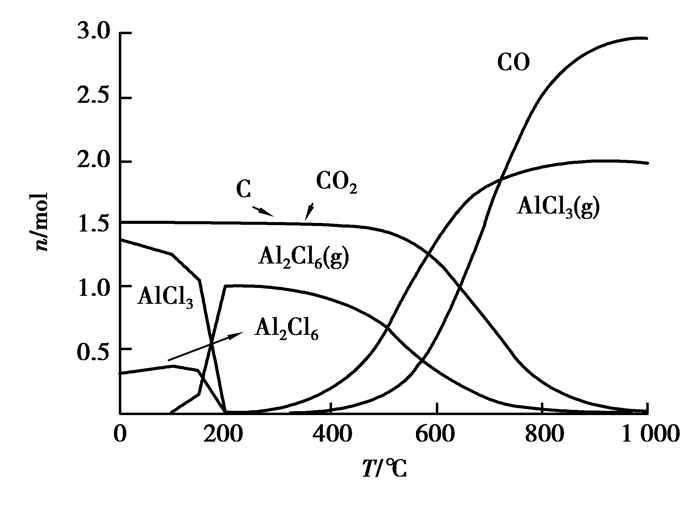
图 9 Al2O3碳热氯化反应平衡组分 Figure 9 The carbochlorination reaction equilibrium compositions of Al2O3 |
|
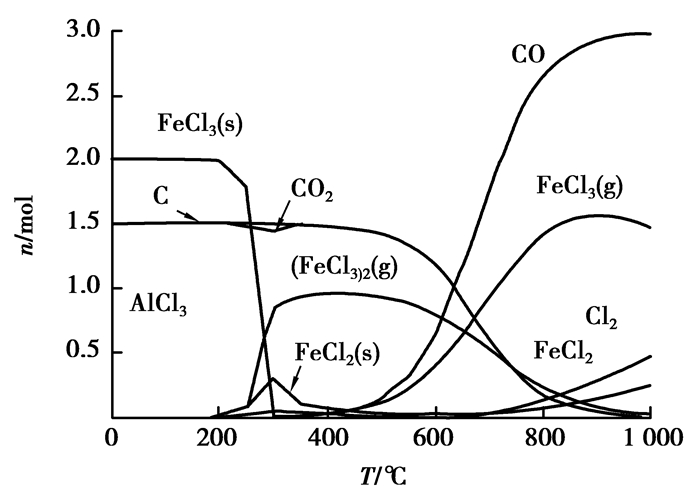
图 10 Fe2O3碳热氯化反应平衡组分 Figure 10 The carbochlorination reaction equilibrium compositions of Fe2O3 |
|
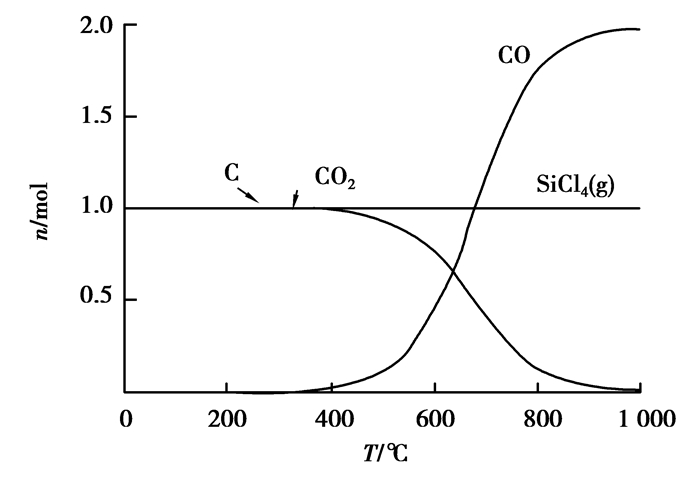
图 11 SiO2碳热氯化反应平衡组分 Figure 11 The carbochlorination reaction equilibrium compositions of SiO2 |
|
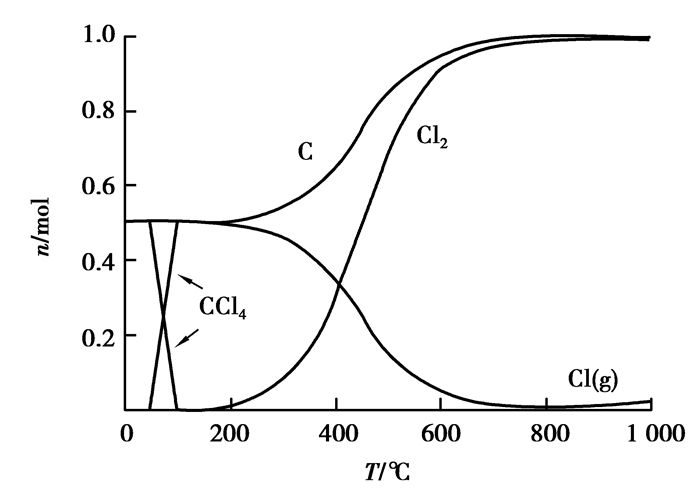
图 12 碳与氯气反应平衡组分 Figure 12 The reaction equilibrium compositions of C and Cl2 |
由图 9和图 11可知:Al2O3、SiO2在加碳氯化反应中均能产生相应的氯化物,而且氯化反应较为完全,氯化率几乎为100%,这就从热力学上证明了粉煤灰碳热氯化提铝工艺的热力学可行性。单纯从热力学理论上讲:未参与反应的残碳,对Al2O3、SiO2的氯化并没有什么影响。图 10可以看出:Fe2O3氯化率虽然也很高,但由于铁存在多价态的氯化产物,产物之间存在转化平衡,所以,在高温段会有些未反应的Cl2存在。除此之外,Fe2O3本身在高温下会直接被碳还原,这使得其碳热氯化过程相对复杂,需要根据所需要的产物来调整Cl2和碳用量。由图 12可知:碳在低温时候会与Cl2反应产生CCl4,CCl4本身就可以独立地作为某些矿物的氯化剂[11-13]。随着温度升高,CCl4越来越不稳定,会重新分解成C和Cl2,在约800 ℃后分解殆尽。图 9~11并未显示有显著的CCl4生成,因此,从热力学角度上来说,在Cl2与C均足量的情况下,二者的副反应并未对整体造成影响。关于Cl2与碳先反应生成CCl4后间接氯化氧化物,还是直接氯化属于氯化机理范畴,需通过实验验证。
5 催化剂对氯化反应的热力学影响对于碳热氯化所使用的催化剂,人们往往只侧重于研究其对动力学的影响,而对热力学影响研究较少。由于在碳热氯化环境下,很多催化剂都可被氯化,从而消耗Cl2和C,这无疑会对氯化反应带来不利影响,所以为了最大程度发挥催化剂的催化作用,需要考虑催化剂在氯化过程中的反应,除此之外,还应考虑其产物对AlCl3的影响。碳热氯化工艺的主要催化剂有碱金属和碱土金属的氧化物、硫化物、氯化物、磷酸盐、碳酸盐[14],还有硼的化合物等[15]。P、S属变价元素,比较复杂,暂不做讨论。
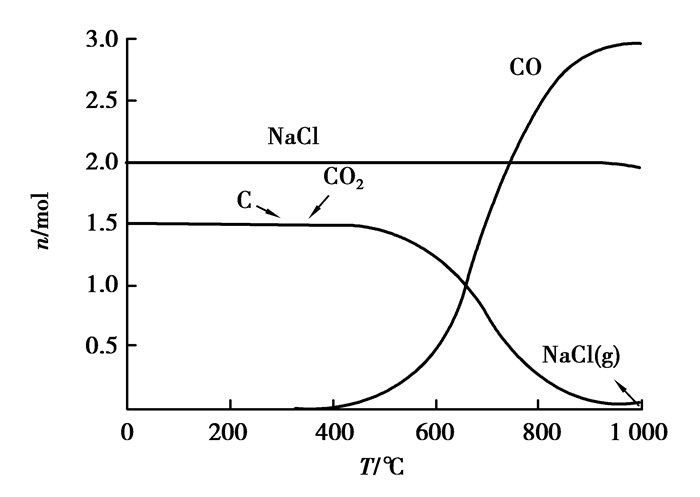
5.1 催化剂的碳热氯化反应针对典型的能参与碳热氯化反应的催化剂Na2CO3、CaCO3、B2O3进行反应模拟,其各自的氯量和碳量按照模拟1 mol Al2O3的反应所需的氯量和碳量方法计算,分别模拟n(Na2CO3):n(Cl2):n(C)=1:1:2、n(CaCO3):n(Cl2):n(C)=1:1:2、n(B2O3):n(Cl2):n(C)=1:3:3反应平衡, 气压为0.77 atm,温度范围为0~1 000 ℃,结果如图 13~15所示。
|
图 13 Na2CO3碳热氯化反应平衡组分 Figure 13 The carbochlorination reaction equilibrium compositions of Na2CO3 |
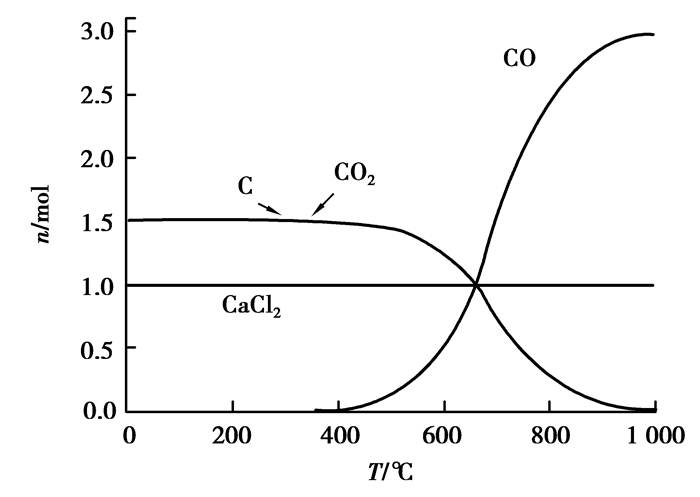
|
图 14 CaCO3碳热氯化反应平衡组分 Figure 14 The carbochlorination reaction equilibrium compositions of CaCO3 |
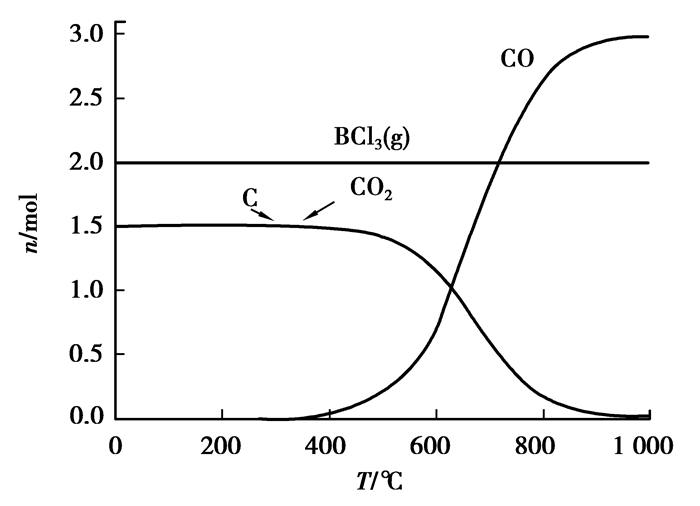
|
图 15 B2O3碳热氯化反应平衡组分 Figure 15 The carbochlorination reaction equilibrium compositions of B2O3 |
可以看出:碳热氯化的条件下,Na2CO3、CaCO3、B2O3都会被氯化,而且很完全,因此在实际氯化过程中,会不同程度地消耗氯气和碳。尤其在粉煤灰氯化体系中,很多催化剂甚至会优先于氧化铝氯化,影响到整个体系的热力学平衡,故在加入此类催化剂的同时,不应忽视它们带来的副作用。
5.2 催化剂的氯化产物对AlCl3的影响Na2CO3、CaCO3、B2O3的氯化产物分别是NaCl、CaCl2、BCl3,而NaCl、CaCl2本身也是催化剂。通过绘制AlCl3-NaCl、AlCl3-CaCl2、AlCl3-BCl3 3个二元系相图来说明它们对AlCl3挥发的影响,分别如图 16~18所示。
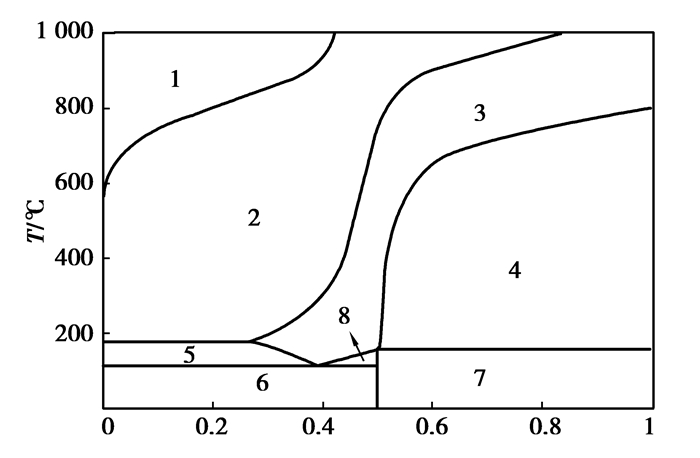
|
图 16 AlCl3-NaCl二元系相图 Figure 16 The binary phase diagram of AlCl3-NaCl nNaCl:(nNaCl+nAlCl3)/(mol:mol)注:各相区分别为1:gas; 2:gas+salt-liquid; 3:salt-liquid; 4:salt-liquid +NaCl (s); 5:AlCl3(s)+salt-liquid; 6:NaAlCl4(s)+AlCl3(s); 7:NaAlCl4(s)+ NaCl (s); 8:AlCl3(s)+NaAlCl4(s) |
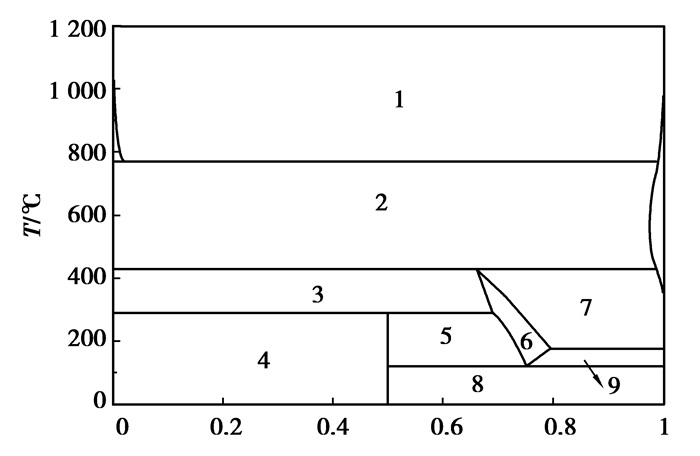
|
图 17 AlCl3-CaCl2二元系相图 Figure 17 The binary phase diagram of AlCl3-CaCl2 nAlCl3:(nAlCl3+nCaCl2)/(mol:mol)注:各相区分别为1:gas+salt-liquid; 2:gas+CaCl2(s); 3:salt-liquid+CaCl2(s); 4:CaAlCl5(s)+NaCl (s); 5:CaAlCl5(s)+salt-liquid; 6:salt-liquid; 7:gas+salt-liquid; 8:AlCl3(s)+ CaAlCl5(s); 9:AlCl3(s)+salt-liquid |
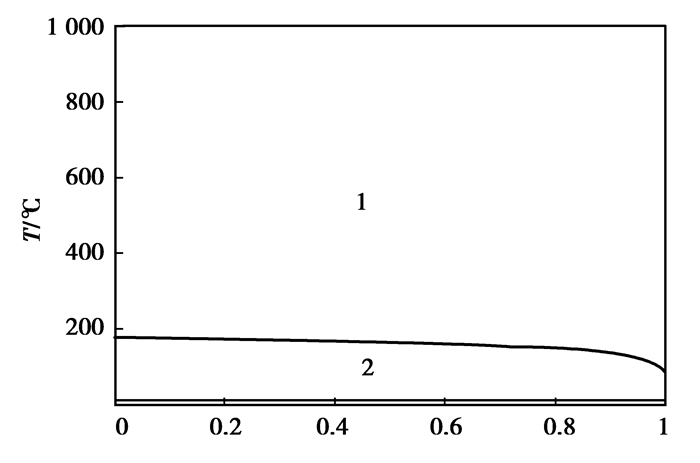
|
图 18 AlCl3-BCl3二元系相图 Figure 18 The binary phase diagram of AlCl3-BCl2 nBCl3:(nBCl3+nAlCl3)/(mol:mol)注:各相区分别为1:gas; 2:gas+ AlCl3(s) |
图 16和17显示:引入高熔点、高沸点的NaCl与CaCl2,会与AlCl3分别形成复盐NaAlCl4和CaAlCl5,影响AlCl3的挥发。图 18可知:BCl3的引入有利于AlCl3的挥发。
6 低于常压条件碳热催化氯化的规律相比常压条件,低于常压条件下的碳热催化氯化存在差异性,除了前面提到的碳气化平衡曲线位置稍有偏左外,还有下列几点:
1) 总压强为0.77 atm时,则最大极限氯位也为0.77 atm,通过图 1~4反映出的趋势来看,氯化物稳定区对应的极限氧位也高于常压下的,这意味着氯化反应进行的条件也更苛刻。
2) 气态氯化物的沸点随气压的降低而降低,低于常压条件更有利于氯化物的挥发分离。
3) 由于CaCO3、B2O3、Na2CO3的碳热氯化反应以及Al2O3、Fe2O3、SiO2分别在约520、600、250 ℃以后的反应均为增容反应,所以,在碳热氯化的主要研究温度段600~900 ℃时,低于常压条件更有利于反应进行。
4) 除了热力学的影响,在实际反应中,通入等摩尔量的氯气:在等体积流量情况下,低于常压条件需通氯气时间更长;在通Cl2相同时间情况下,氯气流速更快。因其涉及到传质与反应速率等动力学问题,其利弊尚待实验分析。
7 结论1) 温度升高,有利于铁、铝、硅的氯化物生成。
2) 在0~1 000 ℃时,Al2O3和SiO2都不能自发地与氯气反应,Fe2O3的氯化程度也不高;Al2O3、SiO2、Fe2O3、B2O3的碳热氯化反应很完全。
3) CaCl2和NaCl均会与AlCl3生成复盐,复盐的生成对AlCl3的挥发是不利的, 而引入低沸点且不与AlCl3反应的BCl3则有利于AlCl3的挥发。
4) 相比常压环境,低于常压条件对粉煤灰组分的碳热氯化有利有弊。
| [1] |
蒋家超, 赵由才.
粉煤灰提铝技术的研究现状[J]. 有色冶金设计与研究 , 2008 (2) : 40–41.
JIANG Jiachao, ZHAO Youcai. Current research situation of Al extraction from fly ash[J]. Nonferrous Metals Engineering & Research , 2008 (2) : 40–41. (in Chinese) |
| [2] |
杨磊, 池君洲, 王永旺, 等.
粉煤灰提取氧化铝的综合利用[J]. 洁净煤技术 , 2014 (4) : 113–115.
YANG Lei, CHI Junzhou, WANG Yongwang, et al. Comprehensive utilization of alumina extraction from fly ash[J]. Clean Coal Technology , 2014 (4) : 113–115. (in Chinese) |
| [3] | 傅崇说. 有色冶金原理[M]. 北京: 冶金工业出社, 1984 : 145 . |
| [4] | Cecchi E, Mercier G, Bergeron M. A feasibility study of carbochlorination of chrysotile tailings[J]. International Journal of Mineral Processing , 2009, 93 (3) : 278–283. |
| [5] | Esquivel M R, Bohé A E, Pasquevich D M. Carbochlorination of cerium dioxide[J]. Mineral Processing and Extractive Metallurgy , 2002, 111 (3) : 149–155. DOI:10.1179/037195502766647075 |
| [6] | Niu L P, Ni P Y, Zhang T A, et al. Mechanism of fluidized chlorination reaction of Kenya natural rutile ore[J]. Rare Metals , 2014, 33 (4) : 485–492. DOI:10.1007/s12598-014-0281-8 |
| [7] | Andrade-Gamboa J, Pasquevich D M. A model for the role of carbon on carbochlorination of TiO2[J]. Metallurgical and Materials Transactions B , 2000, 31 (6) : 1439–1446. DOI:10.1007/s11663-000-0028-9 |
| [8] | Gaviría J P, Bohe A E. Carbochlorination of yttrium oxide[J]. Thermochimica Acta , 2010, 509 (1) : 100–110. |
| [9] |
侯明艳, 张丽清, 董晓华, 等.
碳热氯化法分解富硼渣的可行性研究[J]. 矿产综合利用 , 2008 (1) : 24–26.
HOU Mingyan, ZHANG Liqing, DONG Xiaohua, et al. Study on feasibility of decomposition of boron-rich Slag by carbonchlorination reaction[J]. Multipurpose Utilization of Mineral Resources , 2008 (1) : 24–26. (in Chinese) |
| [10] | 李洪桂. 冶金原理[M]. 北京: 科学出版社, 2005 : 151 -152. |
| [11] | Jena P K, Brocchi E A, González J, et al. Kinetics of low-temperature chlorination of vanadium pentoxide by carbon tetrachloride vapor[J]. Metallurgical and Materials Transactions B , 2005, 36 (2) : 195–199. DOI:10.1007/s11663-005-0020-5 |
| [12] |
付啸, 张英皓, 王垚, 等.
CCl4低温氯化人造金红石制TiCl4[J]. 化工学报 , 2009 (12) : 3026–3034.
FU Xiao, ZHANG Yinghao, WANG Yao, et al. Chlorination of synthetic rutile with carbon tetrachloride at low temperature for producing titanium tetrachloride[J]. Journal of chemical industry and engineering (China) , 2009 (12) : 3026–3034. (in Chinese) |
| [13] | Jena P K, Brocchi E A, Lima M, et al. Studies on the kinetics of carbon tetrachloride chlorination of tantalum pentoxide[J]. Metallurgical and Materials Transactions B , 2001, 32 (5) : 801–810. DOI:10.1007/s11663-001-0067-x |
| [14] | Rao Y K, Soleiman M K. Alkaline each catalyst, carbonaceous reducing agent: US, 4565674[P]. 1986-1-21. |
| [15] | 李旺兴, 邱仕麟, 杨建红, 等.一种粉煤灰制备无水三氯化铝的方法:中国, 102807245A[P]. 2012-12-05. |
 2015, Vol. 38
2015, Vol. 38


