b. 重庆大学机械工程学院,重庆 400044;
c. 重庆大学生物工程学院,重庆 400044
b. School of Mechanical Engineering, Chongqing University, Chongqing 400044, P.R.China;
c. Bioengineering College, Chongqing University, Chongqing 400044, P.R.China
TC4具有密度低、比强度高、机械性能好等优点[1],同时,具有优异的耐腐蚀性和极佳的生物相容性,被广泛应用于医学方面[2],特别是骨植入和牙修复领域[3]。然而,TC4的杨氏模量(110~140 GPa)远高于自然骨(10~30 GPa),存在因应力屏蔽而造成植入体周围出现骨吸收,并最终导致植入体松动和断裂的危险,通过制备多孔材料来降低TC4的杨氏模量是解决这一问题的有效手段[4]。
选区激光熔化(Selective Laser Melting,SLM)技术是一种新型的增材制造技术[5]。由于采用逐层加工方法,SLM技术在制备带内孔的复杂结构和个性化制作等方面具有显著的优势[6],因此,成为制造医用植入材料的一个重要发展方向。
目前,采用SLM技术制造生物医用植入材料得到了广泛的关注。Vandenbroucke等[7]通过SLM制备的TC4合金医用植入体相对密度达99%,并具有较高的几何精度。Yadroitsev等[8]研究了生物医用TC4合金SLM成形过程中的温度分布和组织演变。Sallica-Leva等[9]通过SLM制备了3种不同孔隙率的TC4合金,并且考察了热处理对组织的影响。Johan等[10]将SLM制备的TC4多孔支架植入到大鼠体内,发现多孔TC4支架作为骨缺损修复材料在生物力学上具有很强的诱导成骨能力,并且高孔隙率的支架具有更好的效果。Zhang等[11]采用SLM制备的TC4医用多孔体的杨氏模量仅为16~85 GPa。
为进一步考察SLM成形TC4合金的生物学性能,笔者研究了SLM成形TC4合金的生物腐蚀性能和生物相容性,并与传统铸锻工艺制备的合金进行了对比,以评价SLM技术在医用植入材料领域的应用前景。
1 实验材料及方法 1.1 实验材料研究所用TC4粉末由德国EOS公司提供,用于对比的TC4试样取自外购的ϕ25 mm热轧棒材,成分见表 1。
| 表 1 TC4粉末与棒材化学成分(%) Table 1 Composition of TC4 powder and bars (%) |
SLM成形加工在该公司型号为M280的多金属激光烧结系统上进行,激光功率170 W,光斑直径0.1 mm,铺粉厚度0.04 mm,扫描速度1.2 m/s。加工成20 mm×20 mm×8 mm的试样。按GB/T 1423-1996测试其密度为4.39 g/cm3,致密度达到99.5%。对部分试样按照EOS公司推荐的工艺进行了退火处理:800℃×2 h、炉冷。试样分别命名为轧制态、打印态和退火态。
1.2 电化学实验将打印态、退火态和轧制态合金加工成10 mm×10 mm×3 mm的试样。背面焊接导线,用环氧树脂镶嵌,只暴露1 cm2表面,经砂纸逐级打磨至1 000号砂纸,酒精洗净后用蒸馏水冲洗2遍,冷风吹干。
使用武汉科斯特公司CS350电化学综合测试系统。以样品为工作电极,饱和甘汞电极为参比电极,Pt电极为辅助电极;动电位扫描范围-0.25~+0.25 V,扫描速度1 mV/s。
测试分别在两种常用的模拟生理溶液环境中进行,温度均控制在37℃,一种是Ringer’s生理盐水,另一种是Kukobo等人[12]研究开发的SBF仿生溶液。两种溶液成分见表 2、3。
| 表 2 林格式生理盐水的成分(1 000 mL H2O) Table 2 Composition of Ringer's saline |
| 表 3 SBF溶液的成分(1 000 mL H2O) Table 3 Composition of SBF solution |
称取打印态和退火态合金各15 g加工成10 mm×10 mm×5 mm的块体,表面打磨抛光。用丙酮洗净表面油污后,在酒精中超声清洗10 min,用蒸馏水冲洗3遍,烘干备用。试验按照GB/T 16175-2008标准进行,步骤如下:
1) 取静脉鲜血10 mL到肝素抗凝管中。取抗凝鲜血8 mL,加质量浓度9 g/L的氯化钠注射液10 mL稀释。
2) 试验样品组每管加入试验样品5 g,再加入氯化钠注射液10 mL;取一支空试管加入10 mL生理盐水作为阴性对照组;另取一支空试管加入10 mL蒸馏水作为阳性对照组。将12支试管放在37℃恒温水浴箱中30 min后取出,每支试管加入0.2 mL的稀释抗凝鲜血,轻轻混合均匀,再放入37℃恒温水浴箱中60 min后取出。
3) 将所有试管置入离心机中离心5 min (2 500 r/min),分别吸取各试管上清液移入比色皿中,用分光光度计测定吸光度,选用波长545 nm。
4) 根据下列公式计算溶血率η为
| $ \eta = \frac{{{D_{\rm{t}}}-{D_{{\rm{nc}}}}}}{{{D_{{\rm{pc}}}}-{D_{{\rm{nc}}}}}} \times 100\%, $ |
式中:Dt为试验样品的吸光度;Dnc为阴性对照组的吸光度;Dpc为阳性对照组的吸光度。
若材料的溶血率小于5%,说明材料符合医用材料的溶血要求;若溶血率大于5%,则预示材料有溶血作用。
1.4 细胞毒性试验取打印态和退火态合金加工成10 mm×10 mm×5 mm的块体各3个,表面打磨抛光。用丙酮洗净表面油污后,在酒精中超声清洗10 min,用蒸馏水冲洗3遍,烘干备用。试验按照GB/T 16886.5-2003标准进行,步骤如下:
1) 制备浸提液。浸提前,将样品经紫外灭菌20 min。浸提全过程使用无菌操作技术。浸提液采用含体积分数为10%小牛血清的DMEM培养液,浸提时试件表面积(cm2)与浸提介质体积(mL)之比分别为R1=0.5,R2=1,R3=1.5。将浸提液置于37℃培养箱中24 h,然后采用0.22 μm微孔滤膜过滤除菌,制备成材料浸提液。使用空白培养液作为阴性对照组。
2) 细胞接种和培养。将传代一次的原代培养家兔的成骨细胞用细胞培养液配置1×104个/mL的细胞悬液,分注于96孔塑料培养皿内,每孔100 μL,共种3板,然后置于含5%(体积分数) CO2空气的、(37±2)℃的细胞培养箱中培养24 h。而后弃去原培养液,用PBS液洗涤2次,实验组分别加入6种浸提液,每种8孔,每孔100 μL,对照组加入100 μL空白培养液。然后将96孔板放回细胞培养箱中继续培养2、4、6 d。
3) 细胞观察和吸光度测定。培养2、4、6 d后,各取出一块96孔板,在倒置显微镜下观察细胞形态并摄影。然后弃去浸提液和培养液,加入20 μL/孔的MTT液,继续培养6 h后取出,弃去原液,加入150 μL/孔二甲基亚砜,置震荡器上震荡10 min,在免疫酶标仪上以500 nm波长测定吸光度值,并根据其吸光度按下列公式计算细胞的相对增殖度(RGR)。
| $ {\rm{RGR}}(\% ) = \frac{{实验组平均吸光度值}}{{阴性对照组平均吸光度值}} \times 100\% 。 $ |
4) 细胞毒性评定。按GBT 16886.5-2003标准规定把RGR值转换成6级反应以评定材料的毒性程度。0或1级合格;2级结合细胞形态进行综合评价;3~5级不合格。
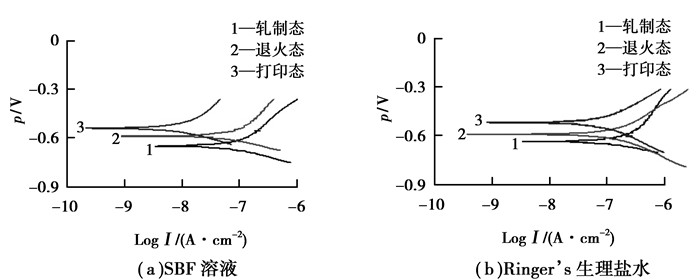
2 结果与分析 2.1 电化学分析图 1给出了3种材料在SBF溶液和Ringer’s生理盐液中的极化曲线。表 4和表 5分别是试样在SBF溶液和Ringer’s生理盐液中的电化学测试数据,由图和表可以看出,在两种溶液中,材料的自腐蚀电位φcorr和极化电阻Rp按照轧制态、退火态、打印态的顺序依次增加。自腐蚀电位是腐蚀系统不受外加极化条件下的稳定电位,这一参数反映材料的热力学特性和电极的表面状态[13]。φcorr越高,腐蚀倾向越小。3种试样的腐蚀倾向由大到小的顺序为轧制态、退火态、打印态。
|
图 1 3种试样在两种溶液中的极化曲线 Figure 1 The polarization curve of 3 samples in the two solutions |
| 表 4 3种试样在SBF溶液中的电化学数据 Table 4 Electrochemical data of 3 samples in the SBF solution |
| 表 5 3种试样在Ringer’s生理盐液中的电化学数据 Table 5 Electrochemical data of 3 samples in the Ringer's saline |
自腐蚀电位只是说明腐蚀发生的难易程度,从实际应用来看,腐蚀动力学是更值得关注的问题,这一性能可以从腐蚀电流密度得到体现,并且可以通过它计算得到腐蚀速率。比较三者的测试结果不难看出,材料的腐蚀电流密度icorr和腐蚀速度ν按照轧制态、退火态、打印态的顺序依次降低。中国金属耐蚀性的标准中,腐蚀速度(mm/a) < 0.05的耐蚀性评价为优良,级别为1级[14]。由此可见,3种试样在生理环境中的耐蚀性均达到优良以上,这也是TC4合金在医用植入材料中广泛应用的原因之一。
无论从热力学还是动力学角度来看,SLM成形的TC4合金均优于传统的铸轧合金,其原因可以从二者组织结构方面的差异进行分析。
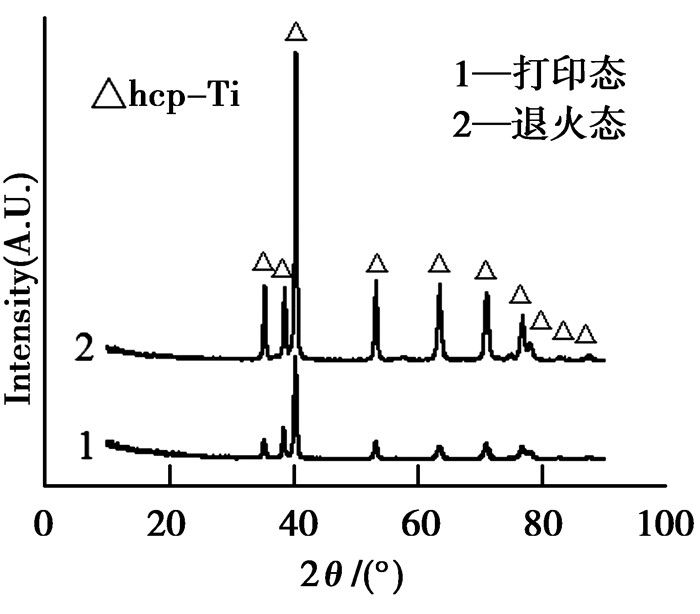
图 2为3种试样的金相组织。由图可见,轧制态TC4金相组织呈现较为粗大的层片状篮网排列特征,为典型的α+β两相组织,β相薄片分布在粗大的α相层片周围[1]。打印态的组织为细小针状,这是由于激光熔化过程产生高冷却速率,合金发生马氏体转变,得到细小的针状α′组织[9, 15-17]。退火后组织呈现和打印态类似的层状,只是部分针状组织有粗化现象,其原因在于SLM成形TC4合金的层状结构在800℃退火时具有高度稳定性,只有加热到更高温度并长时间保温才会出现球状α相[8]。此外,由图 3可见,SLM成形打印态和退火态TC4合金中均只能检测到密排六方相,这些密排六方相包括了α-Ti和α′马氏体,因为它们有相同的晶体结构和非常相似的晶格常数[15]。在本文的退火条件下,α′没有明显分解,故未检测到β相。

|
图 2 3种试样的金相组织 Figure 2 Optical microstructure of 3 samples |
|
图 3 打印态及退火态XRD图谱 Figure 3 XRD patterns of the as build state and the annealed |
与体心立方β相相比,六方α相具有更高的堆积致密度,在钛合金表面形成致密氧化层(TiO2)时,α合金比β合金更稳定,因此,单相α合金比两相α+β合金有着更好的腐蚀性能[1]。这是SLM成形TC4合金的耐蚀性能好于α+β两相组织的轧制态合金的原因之一。
Amaya-Vazquez等[18]研究发现,激光熔化快冷过程产生的α′马氏体组织有利于耐蚀性能的提高。同时,激光熔化造成的组织高度细化也有利于腐蚀性能的改善[19]。另一方面,快速冷凝过程中,合金元素来不及重新分布,依然保持着与雾化粉末一样的高度均匀性。SLM成形合金的这种组织特点和成分均匀性是其耐腐蚀性优良的又一原因。退火后SLM成形合金中针状组织发生粗化,所以其耐蚀性有所下降[20]。
2.2 溶血实验溶血是红细胞溶解导致血红蛋白释放入血浆的现象。造成溶血的因素除红细胞本身疾病外,还有一些外源性因素,包括生物组织接触的材料引起的不良反应。它们可引起红细胞的细胞毒性或对红细胞的机械损伤以及使血浆渗透压改变等。表 6所示为各组吸光度值及样品的溶血率。国家标准GB/T 16175-2008要求阴性对照组的吸光度应不大于0.03,阳性对照组的吸光度应为0.8±0.3。本试验阴性和阳性对照组吸光度测试值均符合要求,试验结果有效。表 6显示,打印态及退火态的溶血率均低于5%,因此,不会引起急性溶血。
| 表 6 各组吸光度及材料溶血率 Table 6 The absorbance of each group and the material hemolysis rate |
细胞毒性是生物医用材料对特定细胞造成毒性作用的能力或趋势,可对细胞造成损伤或使细胞死亡。通过体外细胞毒性试验可检测材料的细胞毒性作用。MTT比色法是一种检测体外培养细胞生长存活的新方法,其原理是用酶标仪检测溶解于二甲亚基亚砜的MTT的显色浓度可得到吸光度值,吸光度值的大小可以反映存活细胞数量的多少及细胞代谢活性的强弱,因而吸光度值降低程度即可反映材料析出液的细胞毒性大小[21]。
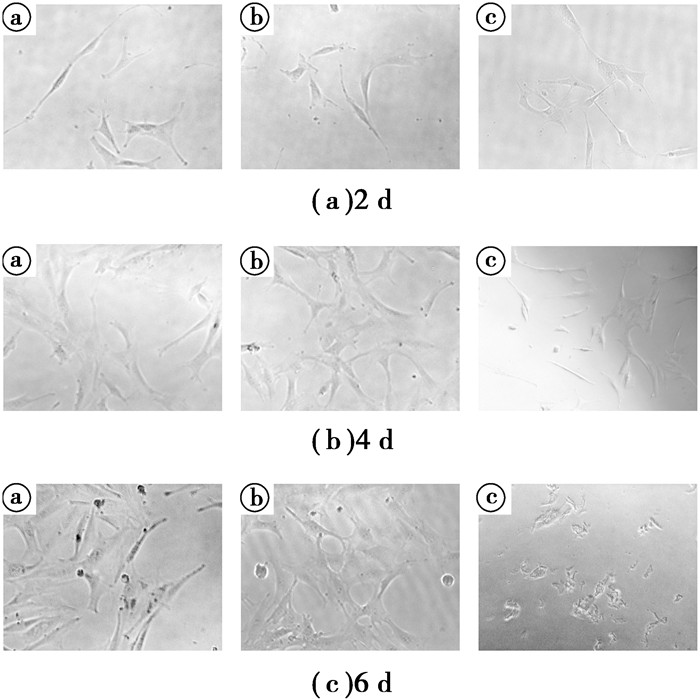
图 4为浸提比例R=1与对照组的细胞分别培养2、4、6 d后的细胞形态。由图 4(a)可见3组细胞在培养2 d后均存在分裂状态,生长良好,部分细胞形态伸展,呈成骨细胞的典型状态。3组细胞之间形态并无明显差异。由图 4(b)可见,培养4 d后,3组细胞均得到了一定程度的增殖,细胞形态基本不变,3组细胞中,退火态增殖得更加明显。由图 4(c)可见,培养6 d后,由于细胞的正常老化、死亡,细胞形态相对于培养4 d时较差,而相比较阴性对照组,实验组的细胞形态更好,这与酶标仪测出的数据相一致。
|
图 4 浸提比例R=1与对照组的细胞分别培养2、4、6 d后的细胞形态(ⓐ打印态;ⓑ退火态;ⓒ阴性对照组) Figure 4 Cell morphology of cell extraction ratio R=1 and the control group were cultured 2, 4, 6 d. (ⓐas build state; ⓑannealed; ⓒnegative control group) |
细胞毒性试验结果如表 7所示。由表可见,阴性打印态和退火态在不同培养天数的细胞相对增殖率均大于100%,毒性分级为0级,表明两种状态下的合金均具有良好的细胞相容性。
| 表 7 不同试样的MTT细胞毒性测试试样结果 Table 7 MTT cytotoxicity test results from different samples |
1) 在SBF溶液和Ringer’s生理盐液中SLM成形TC4合金相比于传统铸轧工艺制备的TC4合金有着更好的耐蚀性能;经800 ℃×2 h退火后的SLM成形TC4合金相比退火前的腐蚀性能有所下降。
2) SLM成形态及退火后的TC4合金的溶血率分别为1.434%、1.389%,不会引起急性溶血;两种状态合金的细胞毒性均为0级,对成骨细胞没有毒性。
| [1] |
C.莱茵斯, M.皮特尔斯.钛与钛合金[M].陈振华, 等, 译.北京:化学工业出版社, 2005. Leyens C, Peters M.Titanium and Titanium Alloys[M].Beijing:Chemical Industry press, 2005. |
| [2] |
张玉梅, 郭天文, 李佐臣.
钛及钛合金在口腔科应用的研究方向[J]. 生物医学工程学杂志, 2000, 17(2): 206–208, 217.
ZHANG Yumei, GUO Tianwen, LI Zuochen. Researches on titanium and titanium alloy in Department of Stomatology applications[J]. Journal of Biomedical Engineering, 2000, 17(2): 206–208, 217. (in Chinese) |
| [3] |
杨海欧, 林鑫, 陈静, 等.
激光成形制备生物医用钛合金材料研究进展[J]. 铸造技术, 2011, 32(10): 1431–1434.
YANG Haiou, LIN Xin, CHEN Jing, et al. Laser Fabrication of Biomedical Titanium Materials[J]. Casting technology, 2011, 32(10): 1431–1434. (in Chinese) |
| [4] |
刘辉, 杨冠军, 于振涛, 等.
生物医用多孔钛合金材料的制备[J]. 钛工业进展, 2010(1): 915.
LIU Hui, YANG Guanjun, YU Zhentao, et al. Preparation of Porous Titanium Alloy Materials for Biomedical Application[J]. Titanium Industry Progress, 2010(1): 915. (in Chinese) |
| [5] | Kruth J P, Levy G, Klocke F, et al. Consolidation phenomena in laser and powderbed based layered manufacturing[J]. CIRP AnnalsManufacturing Technology, 2007, 56(2): 730–759. DOI:10.1016/j.cirp.2007.10.004 |
| [6] | Vrancken B, Thijs L, Kruth JP, et al. Heat treatment of Ti6Al4V produced by Selective Laser Melting:Microstructure and mechanical properties[J]. Journal of Alloys and Compounds, 2012, 541: 177–185. DOI:10.1016/j.jallcom.2012.07.022 |
| [7] | Vandenbroucke B, Kruth J P. Selective laser melting of biocompatible metals for rapid manufacturing of medical parts[J]. Rapid Prototyping Journal, 2007, 13(4): 196–203. DOI:10.1108/13552540710776142 |
| [8] | Yadroitsev I, Krakhmalev P, Yadroitsava I. Selective laser melting of Ti6Al4V alloy for biomedical applications:Temperature monitoring and microstructural evolution[J]. Journal of Alloys and Compounds, 2014, 583: 404–409. DOI:10.1016/j.jallcom.2013.08.183 |
| [9] | SallicaLeva E, Jardini A L, Fogagnolo J B. Microstructure and mechanical behavior of porous Ti6Al4V parts obtained by selective laser melting[J]. J Mech Behav Biomed Mater, 2013, 26: 98–108. DOI:10.1016/j.jmbbm.2013.05.011 |
| [10] | Van Der Stok J, Van Der Jagt O P, Amin Yavari S, et al. Selective laser meltingproduced porous titanium scaffolds regenerate bone in critical size cortical bone defects[J]. Journal of Orthopaedic Research, 2013, 31(5): 792–799. DOI:10.1002/jor.v31.5 |
| [11] | Zhang S, Wei Q, Cheng L, et al. Effects of scan line spacing on pore characteristics and mechanical properties of porous Ti6Al4V implants fabricated by selective laser melting[J]. Materials & Design, 2014. |
| [12] | Kokubo T. Bioactive glass ceramics:properties and applications[J]. Biomaterials, 1991, 12(2): 155–163. DOI:10.1016/0142-9612(91)90194-F |
| [13] |
曹楚南. 腐蚀电化学[M]. 北京: 化学工业出版社, 1994: 156.
CAO Chunan. Electrochemical corrosion[M]. Beijing: Chemical Industry press, 1994: 156. (in Chinese) |
| [14] |
王凤平, 康万利, 敬和民. 腐蚀电化学原理、方法及应用[M]. 北京: 化学工业出版社, 2008: 15.
WANG Fengping, KANG Wangli, JING Hemin. Electrochemical corrosion principle, method and Application[M]. Beijing: Chemical Industry press, 2008: 15. (in Chinese) |
| [15] | Facchini L, Magalini E, Robotti P, et al. Ductility of a Ti6Al4V alloy produced by selective laser melting of prealloyed powders[J]. Rapid Prototyping Journal, 2010, 16(6): 450–459. DOI:10.1108/13552541011083371 |
| [16] | Thijs L, Verhaeghe F, Craeghs T, et al. A study of the microstructural evolution during selective laser melting of Ti-6Al-4V[J]. Acta Materialia, 2010, 58(9): 3303–3312. DOI:10.1016/j.actamat.2010.02.004 |
| [17] | Vilaro T, Colin C, Bartout J D. AsFabricated and HeatTreated Microstructures of the Ti6Al4V Alloy Processed by Selective Laser Melting[J]. Metallurgical and Materials Transactions A, 2011, 42(10): 3190–3199. DOI:10.1007/s11661-011-0731-y |
| [18] | AmayaVazquez M R, SánchezAmaya J M, Boukha Z, et al. Microstructure, microhardness and corrosion resistance of remelted TiG2 and Ti6Al4V by a high power diode laser[J]. Corrosion Science, 2012, 56: 36–48. DOI:10.1016/j.corsci.2011.11.006 |
| [19] | Abbas G, Liu Z, Skeldon P. Corrosion behaviour of lasermelted magnesium alloys[J]. Applied Surface Science, 2005, 247(14): 347–353. |
| [20] | Vrancken B, Thijs L, Kruth J P, et al. Microstructure and mechanical properties of a novel β titanium metallic composite by selective laser melting[J]. Acta Materialia, 2014, 68: 150–158. DOI:10.1016/j.actamat.2014.01.018 |
| [21] |
李凯, 刘彦普, 杨涛, 等.
评价Ti6Al7Nb合金的细胞相容性及其组织相容性[J]. 中国组织工程研究与临床康复, 2007(13): 2406–2410.
LI Kai, LIU Yanpu, YANG Tao, et al. Cell compatib ility and biocompatibility of Ti6Al7Nb alloy[J]. Journal of Clinical Rehabilitative Tissue Engineering Research, 2007(13): 2406–2410. (in Chinese) |
 2015, Vol. 38
2015, Vol. 38

