工业排放的废水中有机污染物难降解,造成严重的水污染,治理工业废水已成为各国科研工作者研究的热点。光催化氧化法就是利用半导体的特性,在光的照射下吸附光子,使半导体材料被光激发产生电子空穴对,进行氧化反应,把有害的化合物分解成为二氧化碳、水和无机盐。不产生二次污染, 无选择性氧化过程,可以处理各种有机和无机污染物,并使其矿化[1]。TiO2以其对生物无毒、化学性质稳定、耐光腐蚀、光催化活性高及价廉易得等优点成为应用最广泛的半导体光催化材料[2]。然而,光响应范围窄,只有在紫外光照射下才具有催化性能,而且电子空穴易复合、量子效率低等缺陷制约了TiO2光催化材料的实际应用推广[3]。目前,采用离子掺杂是提高TiO2光催化活性的有效方法[4-5],由于离子半径与钛离子的不同,离子进入TiO2晶格中,产生晶格畸变,形成电子和空穴的捕获阱,能够抑制电子与空穴的复合从而有效提高TiO2的光催化性能[6]。稀土离子丰富的能级和4f电子的跃迁特性,掺杂后能引起TiO2吸收峰的红移,扩展其光响应范围,产生光生载流子,提高TiO2光催化的催化活性[7]。
为提高TiO2半导体的光催化效率,笔者从拓展TiO2半导体的吸收波范围和抑制电子空穴的复合这两方面入手。一方面,采用溶胶凝胶法制备稀土元素镨掺杂TiO2的催化剂,通过稀土元素镨掺杂,细化晶粒,拓展TiO2半导体的吸收波范围;另一方面,加入氧化剂双氧水,由于双氧水是强氧化剂,可以有效捕获光生电子而实现电子和空穴的分离,以达到提高光量子产率的目的,使光催化实验在无需灯源照射、常温常压、不通氧气条件下,即可降解有机染料碱性品红溶液,实现TiO2的工业应用。
1 实验 1.1 Pr3+掺杂纳米TiO2光催化剂的制备移取适量的0.1 M硝酸镨溶液与40 mL无水乙醇、10 mL蒸馏水、9 mL冰醋酸混合于烧杯中,搅拌20 min得到A溶液;再将17 mL的钛酸丁酯与50 mL的无水乙醇充分混合搅拌30 min得到B溶液。在搅拌的情况下,将B溶液缓慢地滴加到A溶液中。搅拌3 h形成透明凝胶状即可。将其置于室温若干天,形成凝胶。将凝胶后的样品用型号208烘干箱100℃烘干,研磨后,再将其放入SRJX-4-13马弗炉煅烧2 h,研磨待用。配制n(Pr3+):n(TiO2)分别为0%,0.1%,0.2%,0.5%,1%,2%,不同煅烧温度分别为400℃、500℃、600℃、700℃的催化剂,来考察稀土镨掺杂量和煅烧温度对样品催化性能的影响。
1.2 催化剂的表征采用S-3400N扫描电子显微镜(SEM),测试样品的粒径大小;采用XD-3全自动多晶X射线衍射仪,对样品晶相和晶粒尺寸进行测量,可获得样品的组成、结构及晶体的物相的信息;利用傅里叶红外分析仪IR PRESTIGE-21(CE),根据样品对红外光吸收测试,可以测定出样品中化学键的存在。测定粉末样品表面的成键及表面吸附情况,采用KBr压片技术,扫描范围450~4 000 cm-1。
1.3 催化剂降解碱性品红的实验将0.1 g上述所制备的催化剂加入到150 mL质量浓度为10 mg/L的碱性品红溶液中,并加入1 mL30%双氧水作氧化剂,在实验室中无灯源照射,常温常压不通氧的条件下,用90-2恒温磁力搅拌器以一定的速度进行搅拌, 使固体颗粒和液体达到吸附平衡,反应开始后每隔20 min取样一次,然后用离心机(TD-5Z)以3 500 r/min离心10 min,取上清液用Vis-7220可见分光光度计,在碱性品红溶液最大吸收波长λmax=543 nm处,测定溶液的吸光度,蒸馏水作参比液。根据吸光度的变化,计算出碱性品红的降解率,并以此来评价催化剂的光催化活性,计算公式为
| $ n = ({A_0}-{A_t})/{A_0}, $ |
式中:n为碱性品红溶液的降解率; A0为初始碱性品红溶液的吸光度; At为t时碱性品红溶液的吸光度。
2 结果与分析 2.1 Pr3+掺杂纳米TiO2的表征 2.1.1 Pr3+掺杂纳米TiO2的SEM分析图 1是500℃煅烧,n(Pr3+)/n(TiO2)=0%的SEM照片,样品为颗粒状,有片状物质,可能是样品烧结高温导致团聚,粒径较大,平均粒径约为100 nm。图 2是500℃煅烧,n(Pr3+)/n(TiO2)=0.2%的SEM照片,样品颗粒明显减小,平均粒径约为60 nm。片状物明显减少,稀土元素掺杂能提高样品的热稳定性。从图可看出稀土Pr3+掺杂TiO2能明显细化晶粒尺寸,增大催化剂的表面积,提供更多的活性位,有利于光催化反应进行。

|
图 1 500℃,n(Pr3+)/n(TiO2)=0%的SEM照片 Figure 1 500℃, Scanning electron microscopy (SEM) photograph of n(Pr3+)/n(TiO2)=0% |

|
图 2 500℃,n(Pr3+)/n(TiO2)=0.2%的SEM照片 Figure 2 500℃, Scanning electron microscopy (SEM) photograph of n(Pr3+)/n(TiO2)=0.2% |
图 3是n(Pr3+)/n(TiO2)=0.2%的样品在500℃、600℃、700℃不同温度煅烧的XRD图谱,由图可知在2θ=25.28o, 37.75o, 48.03o, 54.08o, 55.08o, 62.80o, 75.40o等出现衍射峰,这些衍射峰与锐钛矿的JCPDS卡号21-1272的峰一一相对应,即说明本实验中所制得的Pr3+/TiO2的晶相属于锐钛矿型。图中t=700℃的图谱在2θ=27.31o处出现金红石衍射峰,而这种现象在500℃、600℃时均未出现,由此可以说明煅烧升高温度可使TiO2的锐钛矿型向金红石型转变。没能出现稀土元素镨的特征波峰,可能是含量较少所致;或者是稀土Pr3+掺杂到TiO2的晶格中,没能检测到。X射线衍射宽化法可用来测定纳米颗粒的平均粒径, 其依据是Scherrer方程: D=Kλ/βcos θ,式中K是一个量纲常数, 取0.89,θ是衍射角, λ是X衍射线的波长, β是衍射峰的半峰宽。计算出500℃煅烧n(Pr3+)/n(TiO2)=0.2%的样品平均单晶粒径为8.89 nm, 说明SEM是纳米团簇。
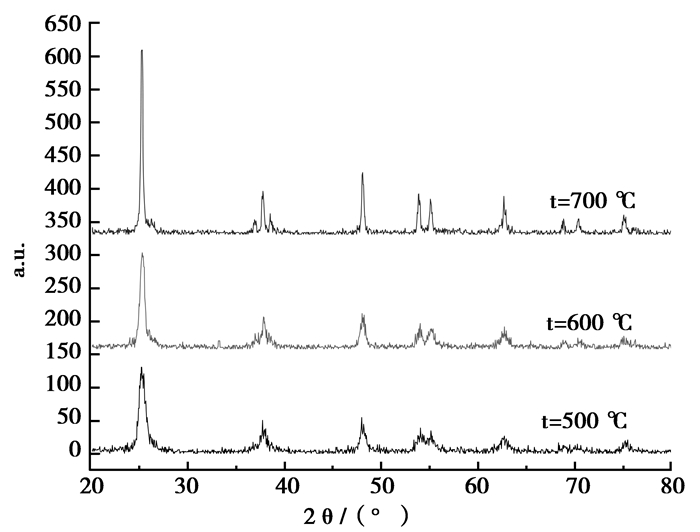
|
图 3 n(Pr3+)/n(TiO2)=0.2%不同煅烧温度的XRD图 Figure 3 n(Pr3+)/n(TiO2)=0.2%, XRD spectra of different n(Pr3+)/n(TiO2) temperatures |
由图 3可知随着温度的降低,衍射峰逐渐减弱且宽化,峰越宽则粒径越小。温度影响粒径的大小,低温有助于晶粒细化,光催化性能增强。稀土掺杂可有效抑制TiO2晶粒的进一步长大。由于Pr3+的半径与Ti4+的半径不同, Pr3+代替Ti4+必将产生局部的晶格畸变, 这种畸变所形成的应力场必然会强烈阻碍晶界的移动,从而达到抑制TiO2晶粒长大的作用[8]。
2.1.3 Pr3+掺杂TiO2的红外分析图 4是n(Pr3+)/n(TiO2)=0.2%不同煅烧温度下的红外图谱,671.11cm-1处的吸收峰为TiO2晶体表面的Ti-O键的伸缩振动吸收峰;1 632.44 cm-1的吸收峰为纳米TiO2表面吸附水分子H-O-H键的弯曲振动吸收峰[9];3 452.44 cm-1处出现一个由O-H伸缩振动引起的吸收峰;23 71.33 cm-1处为TiO2的特征吸收峰;3 755.77 cm-1的吸收峰是TiO2表面吸附的O-H的伸缩振动峰吸收峰[10]。485.13 cm-1处出现了一个微弱的吸收峰, 应归属于Pr-O键的振动吸收[11-12], 说明稀土掺杂到TiO2晶格中。
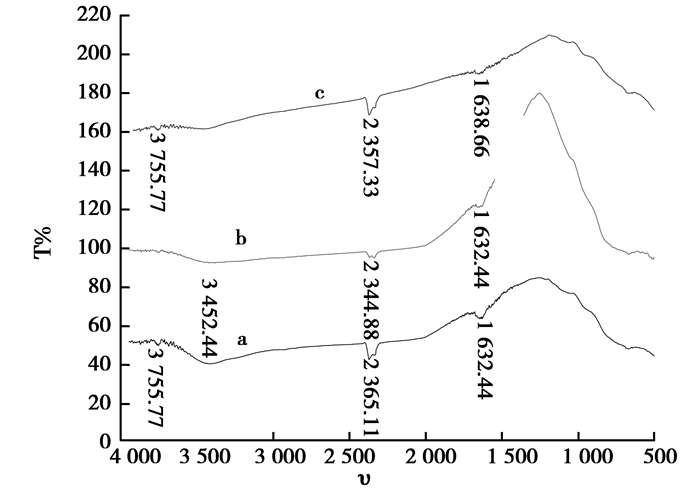
|
图 4 n(Pr3+)/n(TiO2)=0.2%不同煅烧温度下的红外图谱 Figure 4 n(Pr3+)/n(TiO2)=0.2%, FT-IR spectra of different temperatures |
图 5为在500℃煅烧, n(Pr3+)/n(TiO2)分别为0%,0.1%,0.2%,0.5%,1%,2%的TiO2催化剂,降解碱性品红的降解率曲线图。由图 5可知,最佳掺杂为0.2%,通过稀土Pr3+掺杂的TiO2的催化活性也明显提高[13],而且与稀土离子的掺杂量有关;随稀土离子掺杂量的增加,光催化活性提高。但是,当掺杂量超过一定量以后,光催化活性反而会下降[14]。当Pr3+掺杂量过多时, 过量的稀土元素就会沉积在TiO2表面,阻碍光催化反应的进行, 从而引起TiO2光催化活性的降低, 其光催化活性甚至低于纯TiO2。将0.1 g上述所制备的催化剂加入到150 mL质量浓度为10 mg/L的碱性品红溶液中,并加入1 mL30%双氧水作氧化剂,在实验室无灯源照射,常温常压不通氧的条件下,降解120 min,降解率达到97.8%。
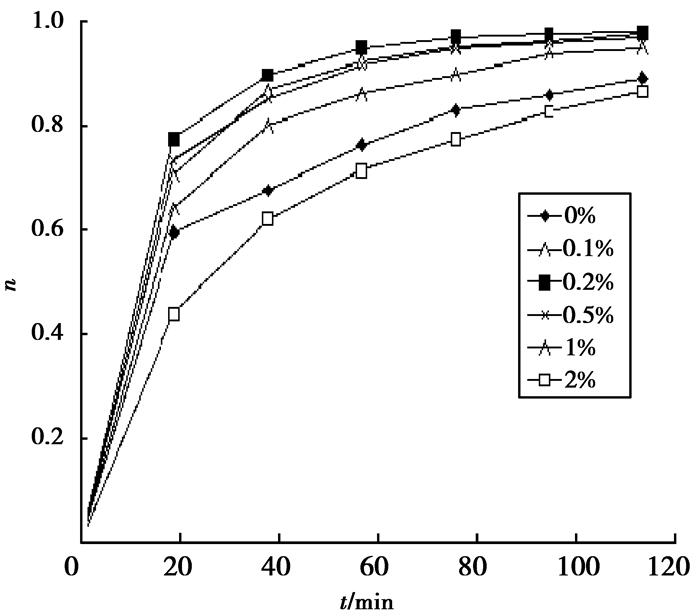
|
图 5 500℃, 不同浓度n(Pr3+)/n(TiO2)降解率曲线 Figure 5 500℃, Degradation rate of different n(Pr3+)/n(TiO2) contents |
图 6是催化性能最好,n(Pr3+)/n(TiO2)=0.2%的样品,煅烧温度分别为400℃、500℃、600℃、700℃的降解率曲线。在无灯源照射条件下,降解有机染料碱性品红溶液120 min,400℃时煅烧的催化剂的催化效果最好,最高可达100%。由图 6可知,400℃、500℃、600℃煅烧的样品催化活性接近,700℃煅烧的样品催化活性明显低。
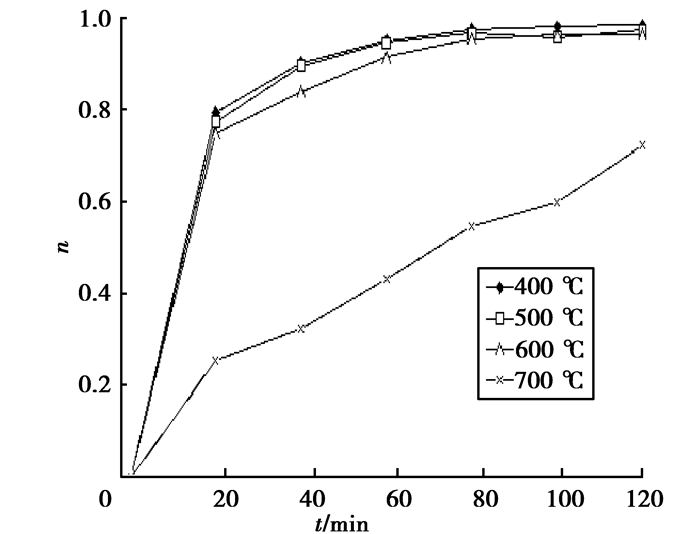
|
图 6 不同煅烧温度n(Pr3+)/n(TiO2)=0.2%降解率曲线 Figure 6 Degradation rate of different n(Pr3+)/n(TiO2)=0.2%temperatures |
分析其原因可能是在煅烧过程中,随着煅烧温度的升高样品有烧结团聚的趋向,导致样品颗粒增大,降低了催化反应的表面积,减少了催化的活性位,所以催化性能降低。而且,在700℃时有金红石相生成,同样也会降低样品催化活性,与XRD分析一致。
2.2.3 氧化剂双氧水的影响只加0.1g催化剂不加双氧水降解率只有6.5%, 说明氧化剂双氧水能够使催化剂催化性能提高。光催化反应要有效进行,就需要减少光生电子和空穴的复合,氧化剂双氧水是有效的导带电子捕获剂,可以有效捕获光生电子而实现电子和空穴的分离,以达到提高光量子产率的目的[15]。
3 结论1) 溶胶凝胶法制备的镨掺杂TiO2为锐钛矿,稀土镨掺杂能细化晶粒,煅烧温度达700℃时有金红石相出现。
2) 氧化剂双氧水能有效抑制电子和空穴的复合,提高样品光催化活性。
3) 400℃下煅烧,最佳掺杂量为0.2%的样品,无灯源照射条件下,降解碱性品红120 min,降解率达到100%,实现TiO2的工业应用。
| [1] |
周娟, 王博, 张新磊, 等.
Fe3+/La3+共掺杂纳米TiO2制备及其性能研究[J]. 河南师范大学学报:自然科学版, 2012, 40(1): 89–92.
ZHOU Juan, WANG Bo, ZHANG Xinlei, et al. Preparation and Properties of Fe3+/La3+Codoped Nano-TiO2[J]. Journal of Henan Normal University:Natural Science Edition, 2012, 40(1): 89–92. (in Chinese) |
| [2] | Kralchevska R, Milanova M, Hristov D, et al. Synthesis, characterization and photocatalytic activity of neodymium, nitrogen and neodymium-nitrogen doped TiO2[J]. Mater Res Bull, 2012, 47(9): 2165–2177. DOI:10.1016/j.materresbull.2012.06.009 |
| [3] | Baiju K V, Periyat P, Shajesh P, et al. Mesoporous gadolinium doped titania photocatalyst through an aqueous sol-gel methed[J]. Journal of Alloys and Compounds, 2010, 505(1): 194–200. DOI:10.1016/j.jallcom.2010.06.028 |
| [4] | Xiong Zhigang, Ma Jizhen, Ng W J, et al. Silver-modified mesoporous TiO2 photocatalyst for water purification[J]. Water Research, 2011, 45(5): 2095–2103. DOI:10.1016/j.watres.2010.12.019 |
| [5] | YU Jiaguo, YUE Lin, LIU Shengwei, et al. Hydrothermal preparation and photocatalytic activity ofmesoporous Au-Ti02 nanocomposite microspheres[J]. Journal of Colloid and Interface Science, 2009, 334(1): 58–64. DOI:10.1016/j.jcis.2009.03.034 |
| [6] | Dai K, Peng T, Chen H, et al. Photocatalytic degradation of commercial phoxim over La-doped TiO2nanoparticles in aqueous suspension[J]. Environmental Science & Technology, 2009, 43(5): 1540–1545. |
| [7] | XIAO Qi, SI Zhichun, YU Zhiming, et al. Characterization and photocatalytic activity of Sm {Sup3+}-do ped TiO2 {Sub2}nanocrystalline prepared by low temperature combustion method[J]. Journal of Alloys and Compounds, 2008, 450(1/2): 426–431. |
| [8] |
郭立新, 王九思, 文卓琼, 等.
稀土元素掺杂纳米TiO2材料的应用[J]. 广州化工, 2010(1): 36–37.
GUO Lixin, WANG Jiusi, WEN Zhuoqiong, et al. Application of Nano-TiO2 Doped Rare Earth Mateials[J]. Guangzhou Chemical Industry, 2010(1): 36–37. (in Chinese) |
| [9] |
卢维奇, 王德清, 王欢, 等.
钇掺杂TiO2介孔材料可见光催化降解甲基橙的研究[J]. 稀土, 2008, 29(5): 36–39.
LU Weiqi, WANG Deqing, WANG Huan, et al. Studies of preparation of TiO2 mesoporous meterials doped with Y3+ and their photocatalytic degradation activities of methyl orange in visible light[J]. Chinese Rare Earths, 2008, 29(5): 36–39. (in Chinese) |
| [10] |
曹怀宝, 王剑波.
钇氮共掺杂纳米TiO2光催化降解染料废水研究[J]. 化工新型材料, 2010, 38(8): 97–98.
CAO Huaibao, WANG Jianbo. Study on photodegradation of methyl orange using co-doped TiO2 with Y3+ and N[J]. New Chemical Materials, 2010, 38(8): 97–98. (in Chinese) |
| [11] | Ferdov S, Fereira R A S, Lin Z. Hydro thermal synthesis, structural investigation, photo luminescence features, and emission quantum yield of Eu and Eu-Gd silicates with apatite-type structure[J]. Chem Mater, 2006, 18(25): 5958–5964. DOI:10.1021/cm0617384 |
| [12] |
吴晶, 周文芳, 高攀, 等.
Pr-TiO2光催化剂的制备与性能研究[J]. 功能材料, 2010, 41(4): 562–565.
WU Jing, ZHOU Wen fang, GAO Pan, et al. Preparation and properties on rare-earth element praseodymium doped nano-titanium dioxide photo catalyst[J]. Journal of Functional Materials, 2010, 41(4): 562–565. (in Chinese) |
| [13] | Xie Y, Yuan C. Characterization and photocatalysis of Eu3+-TiO2 sol in the hydrosol react ion system[J]. Materials research bulletin, 2004, 39(4/5): 533–543. |
| [14] |
刘丽静.
Eu3+/TiO2光催化剂降解罗丹明B[J]. 信阳师范学院学报:自然科学版, 2014, 27(1): 96–99.
LIU Lijing. Photocatalyst degradation of rhodamine B by Eu3+ dope TiO2[J]. Journal of Xinyang Normal University:Natural Science Edition, 2014, 27(1): 96–99. (in Chinese) |
| [15] | Yu C H, Wu C H, Ho T H, et al. Decolorization of C. I. Reactive Black 5 in UV/TiO2, UV/oxidant and UV/TiO2/oxidant systems :A comparative study[J]. Chemical Engineering Journal, 2010, 158(3): 578–583. DOI:10.1016/j.cej.2010.02.001 |
 2015, Vol. 38
2015, Vol. 38

