我国高磷鲕状赤铁矿已探明储量达37.2亿t,约占我国铁矿石资源总量的10%,通常含铁41.95%~52.60%,含磷0.3%~1.8%,含二氧化硅10%~15%,较高的磷含量使其不能用作高炉的炼铁原料[1]。
高磷鲕状赤铁矿中特殊的鲕状结构和嵌布形式,使得磷难以从矿石中脱除。上海梅山铁矿采用立环脉动高梯度强磁选机的弱磁选-强磁选降磷工艺[2-3]取得了较好指标,虽然用传统的物理分选方法处理高磷鲕状赤铁矿时因磷灰石、胶磷矿等的嵌布粒度极细,要使其单体解离,往往需要细磨,细磨后使用物理分选方法会面临捕集困难、回收率低,磷脱除难的问题;卢尚文等[4]采用解胶酸式浸矿实现了乌石山宁乡式鲕状嵌布式高磷铁矿的抗盐保铁脱磷,有效地脱除了乌石山铁矿中40%~50%的磷,并提高铁品位4~6百分点,但是化学选矿的方法成本高,二次污染大;Anyakwol等[5-6]探索了用Aspergillus Terreus、Bacillus Subtilis 2种细菌脱除尼日利亚AGBAJA高磷铁矿中磷的可行性。7周的时间,2种细菌的脱磷率分别是58%和66%,用另外2个菌种在10周的时间内获得的累计脱磷率分别61.48%、69.20%,微生物脱磷的效率太低,周期长,不便于大规模的生产。
碳化铁作为一种新型的多功能材料在磁性材料、催化剂等诸多领域都有广泛的利用,特别是可以用作废钢的替代物炼钢,而采用纯氧化铁或高品位铁矿石通过气体还原渗碳反应法制备碳化铁已经得到了广泛的研究[7-8]。制备碳化铁的温度较低,高磷鲕状赤铁矿中的磷酸盐很难被还原,因此有机会通过选矿的方法将碳化铁与未被还原的含磷脉石分离。根据Zhang等[9]的研究,碳化铁在1 023 K下最不容易发生分解,这有利于碳化铁的稳定。Li等[10]研究了多种氧化物添加剂对铁矿石制备碳化铁的影响,发现V2O5对还原反应和碳化反应均有明显的促进作用。何强等[11]进一步研究了V2O3、Al2O3添加剂对铁矿石制备碳化铁的影响,结果表明:V2O3对还原反应和碳化反应均有明显的促进作用,有利于碳化铁的生成率和稳定性,V2O3的最佳添加量在1%以内,Al2O3对还原和碳化有一定的促进作用,但对碳化铁的稳定性有不利影响。而利用劣质铁矿之一的高磷鲕状赤铁矿制备碳化铁的研究尚未见报道。以往对铁矿石制备碳化铁的研究,仅分析了温度、添加剂等外在因素对铁矿石制备碳化铁的速率的影响,没有考虑矿石破碎后粉末粒度的影响。粒度不同的矿粉所制成的球团显气孔率和体积密度会有所不同。在试样的还原和碳化过程中,球团的显气孔率和体积密度的大小必然对气体进入球团内部进行反应产生影响,显气孔率过小、体积密度过大会阻碍反应气体扩散至球团内部与之反应,气体产物也不易从空隙逸出,造成反应缓慢,所以,研究矿粉粒度对高磷鲕状赤铁矿制备碳化铁的影响具有重要意义。
笔者前期对高磷鲕状赤铁矿采用H2-CH4先还原后碳化的试验方法,得到了碳化铁[12],并进一步对高磷鲕状赤铁矿的矿相进行分析。在前期工作的基础上,研究了温度和矿粉粒度对高磷鲕状赤铁矿制备碳化铁过程的影响。为下一步从反应产物中分离碳化铁和脉石的研究提供理论依据,如果脉石中的磷能与碳化铁分离,将为劣质铁矿石的利用开发开辟新的途径。
1 实验条件和方法 1.1 实验原料实验以鄂西高磷鲕状赤铁矿为原料,其主要成分见表 1。将矿石经破碎机破碎后筛分得到80~100目、100~120目、120~160目、160~200目4种不同粒度的粉状样,利用蒸馏水为粘接剂在造球机中批量制作球团,然后在温度为373 K的烘干箱中烘干,最后在马弗炉中在1 173 K温度下烧结成型。
| 表 1 高磷鲕状赤铁矿主要化学成分 Table 1 Chemical composition of the High Phosphorus Oolitic Hematite |
实验所用氢气、氮气、甲烷均采用钢瓶装高纯气体(99.999%)。
1.2 实验装置实验在立式电阻炉内进行,炉管为莫来石管,在莫来石管内放置底部封闭的石英玻璃管作为反应管。炉膛温度由CHINO KP1000程序控温仪控制(精度为±0.1 K),反应区温度用K型铠装热电偶和数字电压表测量;连续称量试样在还原和碳化过程中重量变化的天平为METLER MS系列(感量为0.01 mg)。
1.3 实验方法将试样吊入石英玻璃管中,通氮气驱赶石英玻璃管内的空气,将炉膛温度升到预定温度,再将球团用Ni-Cr合金丝链吊入反应管,改通还原反应气体H2,开始称量试样重量变化,待试样失重达到理论的最大失重后,改通碳化反应气体CH4;热天平实时测定试样的重量由计算机连续记录,当球团达到预定的氧化铁全部生成碳化铁的质量后,改通氮气,将石英玻璃管连同试样从炉膛取出快速冷却,待试样冷却到室温后用X射线衍射仪对其进行物相分析,用扫描电镜进行形貌与结构观察。
2 实验结果和讨论 2.1 高磷鲕状赤铁矿的矿物学分析高磷鲕状赤铁矿中赤铁矿含量占68 wt%左右,大多呈鲕粒状分布,鲕粒大小为0.2~0.7 mm之间, 鲕粒赤铁矿大多呈正圆或椭圆形,少部分叠加呈不规则形态;另有少量粗粒状赤铁矿分布在鲕粒间及石英晶粒间,如图 1所示。石英在高磷鲕状赤铁矿中含量占25 wt%左右,粒状,颜色很深,多分布在鲕粒间及鲕核中,石英裂隙中可见赤铁矿分布,粒径一般为0.1~0.3 mm之间,最大0.4 mm左右,如图 1(a)所示。矿石中磷灰石含量占2 wt%左右,多呈自形颗粒状分布在鲕状赤铁矿之间的含铝硅酸盐中,或呈胶状(胶磷矿)零散分布在鲕粒圈层中,粒径0.001~0.05 mm之间,如图 1(b)所示。
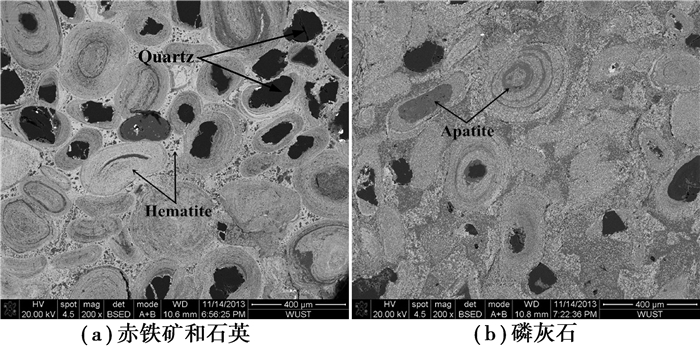
|
图 1 高磷鲕状赤铁矿中赤铁矿和石英(a),磷灰石(b)的扫描电镜照片 Figure 1 SEM images of Quartz and Hematite (a), apatite (b) in High Phosphorus Oolitic Hematite |
在制备碳化铁的反应过程中,氧化铁被还原成金属铁是失氧过程,试样质量逐渐减少,金属铁生成碳化铁是碳化过程,试样质量逐渐增加。因此,反应的失重率曲线可以较好地反映整个反应的各种特征[13]。失重率w的定义为
| w=ΔmmFe2O3 × 100 | (1) |
式中:Δm为试样的失重量;mFe2O3为试样中实际参加反应的氧化铁重量(假定试样中Fe含量全部来自于Fe2O3);m为试样原始重量;k为试样中Fe2O3的质量分数。
利用H2-CH4气氛对高磷鲕状赤铁矿先还原后碳化制备碳化铁的过程中,碳化铁只有在矿粉被还原到一定的还原度后才能出现。试样在整个过程中先后发生还原反应和碳化反应,因此不同阶段反应进度表达式不同。假设还原过程中参加反应的铁氧化物全部为Fe2O3,碳化阶段反应生成的铁碳化物为Fe3C。
还原阶段发生的反应:
| Fe2O3(s)+3H2(g)=2Fe(s)+3H2O(g), | (2) |
还原反应进度
| xr=还原失重量理论完全还原的失重量=ΔmrmFe2O3 × 16 × 3160=10Δmr3mFe2O3. | (3) |
碳化阶段发生的反应为
| CH4(g)+3Fe(s)=Fe3C(s)+2H2(g), | (4) |
碳化反应进度
| xc=碳化增重量理论完全碳化的增重量=ΔmcmFe2O3 × 56 × 2160=20ΔmcmFe2O3. | (5) |
式中:Δmr为还原过程中减少的质量;mFe2O3为球团试样中Fe2O3的质量;Δmc为碳化过程中增加的质量。
2.3 温度对试样失重的影响在H2-CH4气氛下,不同温度对试样重量变化的影响如图 2所示。图中4条曲线分别对应不同的反应温度,每条曲线先上升后下降,分别对应试样反应过程中的还原阶段和碳化阶段,曲线的最高点表示试样中的氧化铁全部还原为金属铁,此时还原反应达到最大还原度,同时代表碳化反应的开始, 图中箭头表示气氛由H2换为CH4的时间。4条曲线对比可知,在923~1 023 K温度范围内,随着温度的升高,试样达到最大还原点的时间依次由923 K时的4 800 s减少到1 023 K时的2 480 s,还原速度明显加快,试样失重曲线斜率的增加幅度也越大,但温度升高到1 073 K时,试样达到最大还原点的时间为2 340 s,与1 023 K达到最大还原点的时间2 480 s相比,改变并不明显,试样失重曲线斜率与1 023 K的曲线斜率相比,增加幅度较小;而在碳化阶段,随着温度的升高,试样失重曲线的倾斜度变化规律有所不同:973 K下曲线的倾斜度与923 K相比有较大的减小幅度,而高于973 K后,碳化阶段失重曲线的倾斜度基本不变。因此,升高温度有利于铁矿石的还原反应,但不利于碳化反应的进行。
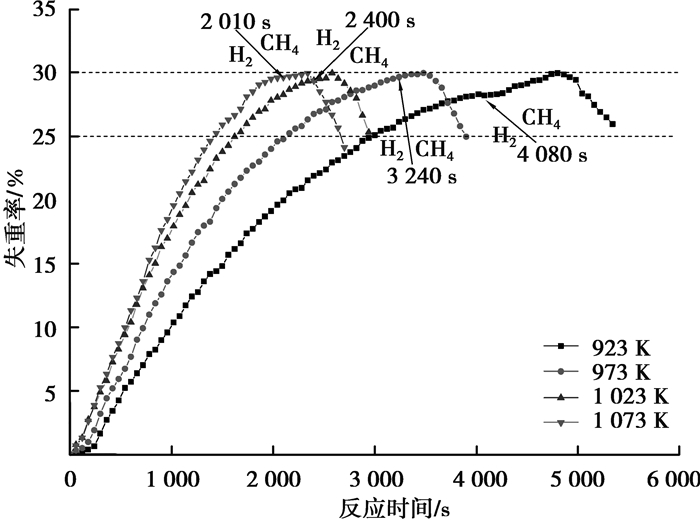
|
图 2 不同温度下(923~1 023 K)矿球在H2和CH4气氛中的重量变化曲线 Figure 2 Weight change curves of pellets at different temperature in H2 and CH4 atmosphere (923~1 023 K) |
图 3为873 K下试样在H2-CH4气氛中的失重曲线。可以看出,反应温度为873 K时,纯高磷鲕状赤铁矿试样可发生还原反应并达到最大还原度,但反应110 min后两者仍未能碳化。表明发生碳化反应有最低温度要求,低于873 K碳化反应将不能发生。综合上述考虑,反应的最佳温度为1 023 K。
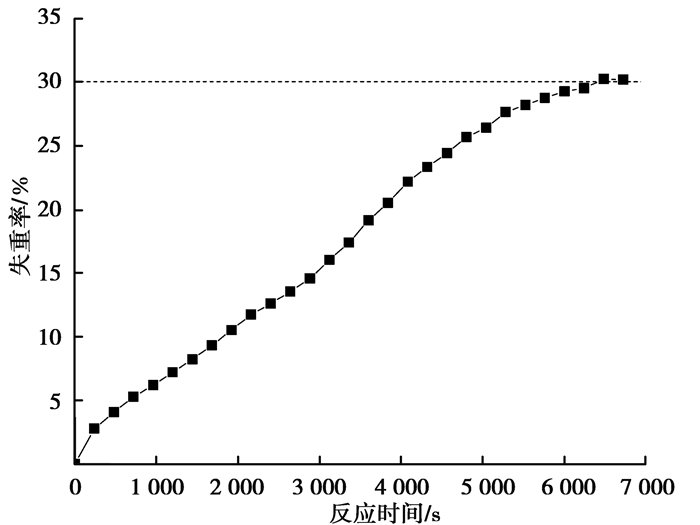
|
图 3 873 K温度下矿球在H2和CH4气氛中的重量变化曲线 Figure 3 Weight change curves of pellets at 873 K inH2 and CH4 atmosphere |
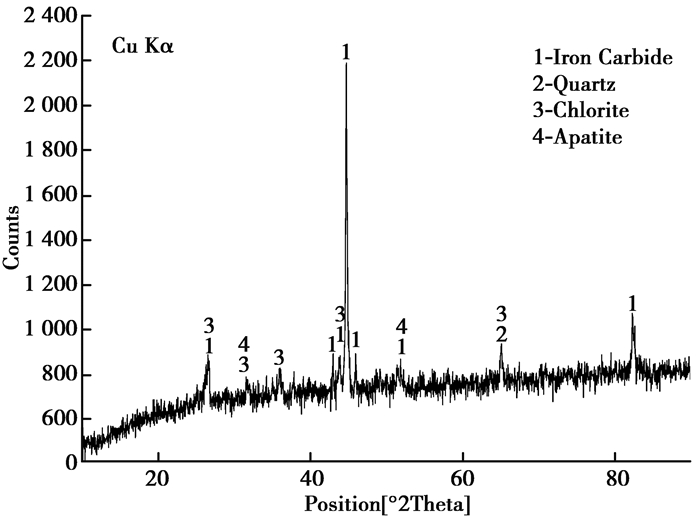
将还原碳化反应后的球团用玛瑙研钵细磨,再用扫描电镜(SEM)观测并做能谱(EDS)分析,用X-射线粉末衍射(XRD)仪检测反应终产物的物相。实验产物的扫描电镜图和能谱分析如图 4所示。图 4包括亮色絮状物质和暗色物质,亮色絮状物质最大的颗粒尺寸在5.5 μm左右,最小颗粒尺寸在1 μm左右,平均颗粒尺寸在2.5 μm左右,通过对EDS能谱分析得到产物的元素成分,主要是Fe和C,二者所占比例达到了86.32%,推断有碳化铁生成, 但两者质量比接近,可能是由于实验过程中的游离碳吸附导致。从图 5可以看出,终产物主要由碳化铁、石英、绿泥石和磷灰石组成,这说明矿石中的铁氧化物生成了碳化铁,而脉石基本未发生反应。进一步证明了高磷鲕状赤铁矿可以制备出碳化铁,而磷仍保留在磷灰石中。这和较高温度下的直接还原不同,薛正良等[14]报道了1 300~1 400 ℃碱性内配碳团块自还原过程可以脱去30%的磷,但铁粒中磷仍有0.12%~0.14%,很难除去,而赵志龙等[15]研究了在还原温度为800 ℃时,高磷铁矿在H2还原前后P是以Ca3(PO4)2的形式存在。升高温度对脱磷不利,磷灰石被还原后可溶解到铁中。文中的试验是在低温(600~800 ℃)下进行的,很好地避免了磷被还原的问题。
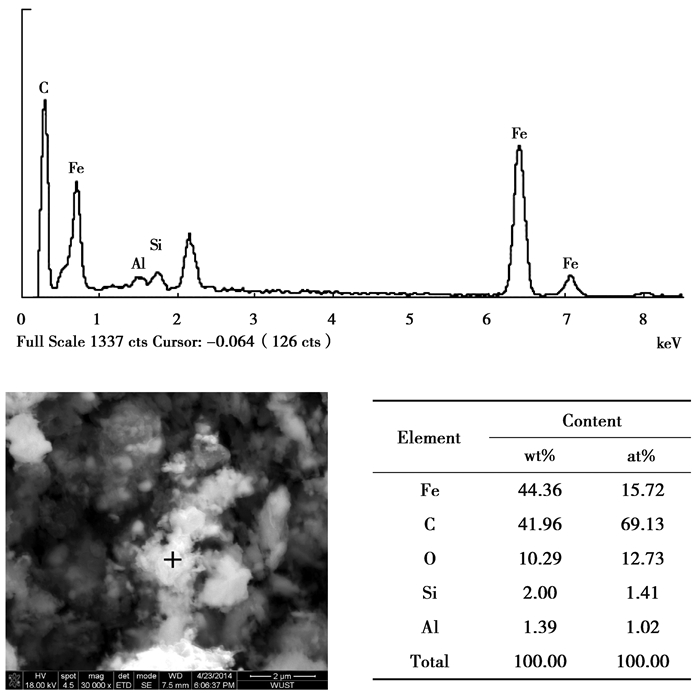
|
图 4 实验产物的扫描电镜图和能谱分析图 Figure 4 SEM image and EDS spectra of products |
|
图 5 实验产物的X射线衍射图谱 Figure 5 XRD patterns of products |
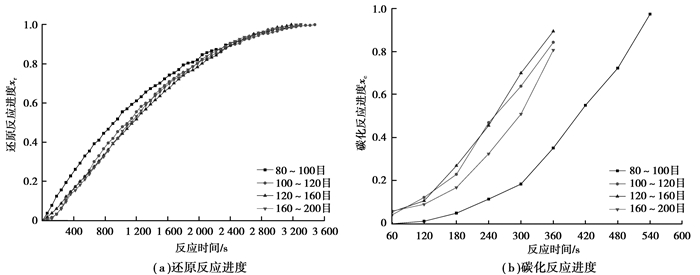
反应温度为973 K、1 023 K时,不同矿粉粒度对试样还原、碳化反应进度的影响如图 6、7所示。在图 6(a)中,随着反应时间的增加,4条曲线均呈上升状态,表明试样在此过程中不断被还原直到还原完全,在0~2 200 s内,80~100目的试样还原反应进度在4种粒度中最大,说明在前2 200 s内,80~100目试样的还原速度最快,反应时间大于2 200 s时,4条曲线的还原反应进度相差不大,说明4种粒度试样的还原速度在反应时间大于2 200 s时相差不大,但120~160目试样的还原进度曲线最快达到最大还原度,说明120~160目试样的还原速度最快;在图 6(b)中,随着反应时间的增加,4条曲线呈上升状态,表明试样在此过程中不断被碳化直到达到预定的碳化点,在4条曲线中,120~160目试样的曲线上升速度最快,碳化反应进度最大。碳化时间为360 s时,120~160目试样的碳化反应进度为0.90;100~120目试样的碳化反应进度为0.84;160~200目试样的碳化反应进度为0.81;80~100目试样的碳化反应进度为0.35,说明120~160目试样的碳化速度最快。综合图 6(a)、(b)考虑,利用高磷鲕状赤铁矿制备碳化铁的最佳粒度为120~160目。
|
图 6 在973 K温度下不同粒度矿粉制成的矿球的还原反应进度和碳化反应进度曲线 Figure 6 Reduction reaction degree curves (a) and carburization reaction degree curves (b) ofpellets prepared by ore powders with different size at 973 K |
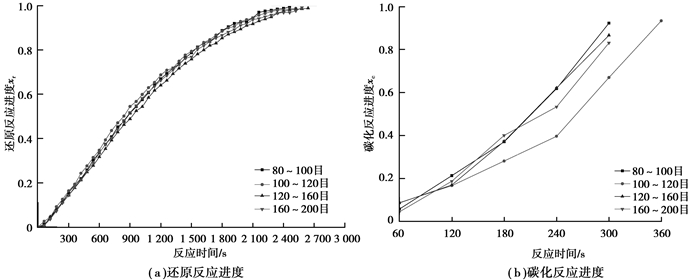
图 7是1 023 K温度下不同粒度矿球的还原反应进度(a)、碳化反应进度(b)曲线图。在图 7(a)中,随着试样矿粉粒径的减小,试样的还原速度基本保持不变,但矿粉粒度在120~160目的试样到达最大还原反应进度的时间最短,矿粉粒度在80~100目、100~120目、160~200目的试样到达最大还原点的时间基本相同;在图 7(b)中,在前180 s内,80~100目、120~160目、160~200目3种粒度试样的碳化反应进度差别不大,100~120目试样的碳化反应进度最慢,反应时间大于180 s时,160~200目试样的碳化反应进度逐渐减慢,80~100目、120~160目2种粒度试样的碳化反应进度差别不大,100~120目试样的碳化反应进度最慢。与图 6相比可知,在最佳反应温度1 023 K的条件下比973 K反应温度时的试样达到最大还原进度和最大碳化进度的时间有所减小,说明温度对试样失重的影响比矿粉粒度对失重的影响要大得多。
|
图 7 在1 023 K温度下不同粒度矿粉制成的矿球的还原反应进度和碳化反应进度曲线图 Figure 7 Reduction reaction degree curves (a) and carburization reaction degree curves (b) ofpellets prepared by ore powders with different particle size at the temperature of 1 023 K |
在实验中,球团的还原和金属铁的碳化都属于气固相反应。反应的具体特征根据参考文献[15],可以对还原反应采用有固体产物层的未反应核模型进行动力学分析。假定实验所用的氧化铁球团是无孔颗粒,发生的是一级不可逆等温反应;假定反应过程处于稳态,其化学反应速度、气体外扩散速度和向内传质速度相等;忽略颗粒体积变化。碳化过程采用随机成核和随后生长模型进行动力学分析,n=1/3的Avrami-Erofeev方程为最概然机制函数。
还原过程中的限速环节为界面化学反应,由文献[16]导出的公式经过推导得到还原反应表观速率常数:
| 1−(1−x)1/3=Krt, | (6) |
| Kr=krCH2, b3ρFe2O3r0; |
式中:kr为还原反应速率常数;CH2, b为氢气流主体浓度,mol/cm3;ρFe2O3为氧化铁密度,kg/m3;r0为球团初始半径,cm。
碳化过程的限速环节为甲烷气体的扩散,碳化反应表观速率常数为
| [−ln(1−x)]1/3=Kct. | (7) |
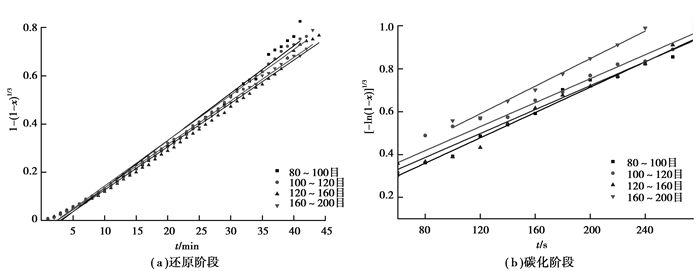
根据反应进度的定义,按照图 6、图 7的数据和相关的参数,可以得到不同条件下反应进度1-(1-x)1/3、[-ln (1-x)]1/3与时间的关系,如图 8、9所示。从图 8(a)、图 9(a)中可以看出,各试样的实验点呈现良好的线性关系,说明了在此阶段试样按照未反应核模型发生还原反应;从图 8(b)、图 9(b)中各试样的实验点也呈现良好的线性关系,说明了在此阶段试样的碳化反应主要由Avrami-Erofeev方程控制的随机成核和随后生长模型控制的。

|
图 8 在反应温度973 K不同粒度矿粉制成的矿球在还原阶段1-(1-x)1/3和碳化阶段[-ln (1-x)]1/3与t的关系图 Figure 8 Relationship between 1-(1-x)1/3, [-ln (1-x)]1/3and t in reduction step and carburization step atthe temperature of 973 K for pellet specimens made from particles with different size distribution |
|
图 9 在反应温度1 023 K不同粒度矿粉制成的矿球在还原阶段1-(1-x)1/3和碳化阶段[-ln (1-x)]1/3与t的关系图 Figure 9 Relationship between 1-(1-x)1/3, [-ln (1-x)]1/3 and t in reduction step and carburization step atthe temperature of 1 023 K for pellet specimens made from particles with different size distribution |
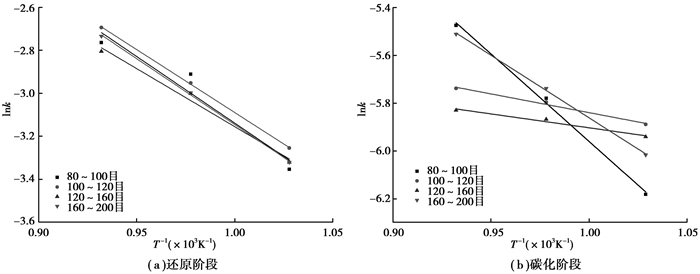
利用图 8、图 9直线的斜率得到化学反应表观速率常数Kr、Kc,再利用推导出的公式(6)及相关数据计算得到还原阶段化学反应速率常数k,用还原阶段lnk,碳化阶段lnK对1/T作图,如图 10所示。根据图中各阶段lnk,lnK对1/T直线的斜率k′和K1,可求出各阶段还原反应的活化能E,碳化反应的表观活化能E′,见表 3。
| 表 3 不同粒度矿粉制成的球团的还原和碳化阶段的反应活化能 Table 3 Activation energy of pellets made from iron oreparticles with different size distribution |
|
图 10 还原阶段lnk及碳化阶段lnK与1/T的关系 Figure 10 Relationship between lnk, lnK and 1/T in reduction step and carburization step |
由表 3知,在4种矿粉粒度中,120~160目粒度矿球反应活化能最低,还原反应活化能为44.95 kJ/mol,碳化阶段表观活化能为9.71 kJ/mol。随着粒径的减少,还原、碳化阶段的反应活化能、表观活化能均减少。随着粒径的继续减小,当矿粉粒度达到160~200目时,矿球的反应活化能和表观活化能均升高。矿粉粒度影响表观活化能与矿球的体积密度相关是一定的,这主要是由于矿粉粒度影响其成球团后的体积密度,从而影响了气体扩散的难易程度。碳化阶段,CH4裂解得到的碳沉积会堵塞矿球中气孔,阻碍气体的传输,从而影响了反应过程,这在动力学数据中的表观活化能得到了体现。
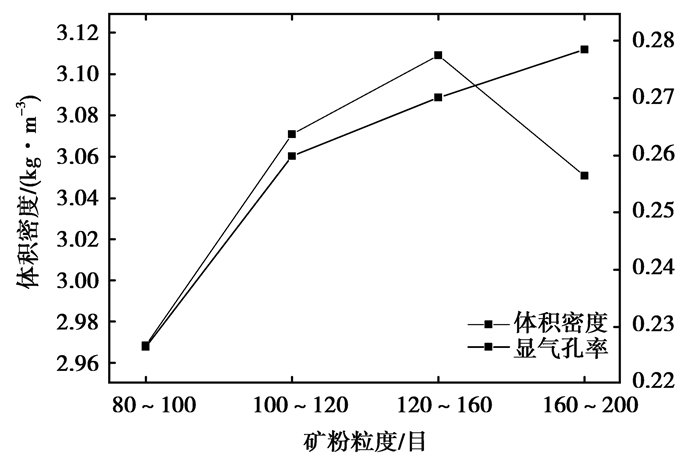
对不同矿粉粒度的80~100目、100~120目、120~160目、160~200目样品进行了体积密度和显气孔率的测定,结果如表 4所示,随着矿粉粒径的减小,体积密度越来越大,但是当试样矿粉粒度到160~200目,粒径达到74~98 μm时,矿粉的体积密度减小;样品的显气孔率随着样品粒径的减小而增加。体积密度和显气孔率的大小对还原速度和碳化速度的快慢有明显影响,在图 6中,可以看到120~160目试样达到最大还原点的时间最短,可以从图 11得到解释。图 11是不同粒度球团的体积密度显气孔率,120~160目试样的体积密度在4种不同粒度属于最大,显气孔率较之160~200目试样的显气孔率略小,还原性气体H2更容易扩散到矿球内部发生还原反应,甲烷裂解产生的碳也不容易堵塞气孔,造成反应的缓慢;虽然100~120目试样的体积密度和显气孔率均大于80~100目试样,但两者达到最大还原点的时间几乎相同,可能是由于100~120目试样在反应过程中,气孔部分堵塞,造成反应缓慢,最后导致达到最大还原度的时间与80~100目试样的没有明显区别,两者的碳化速度也没有明显差别。
| 表 4 不同粒度球团的体积密度(kg/m3)、显气孔率 Table 4 Bulk density and apparent porosity withdifferent mineral powder particle size |
|
图 11 不同粒度球团的体积密度显气孔率 Figure 11 Bulk density and apparent porosity of pellet specimensmade from ore powders with different particle size distribution |
1)温度在923~1073 K时,先利用H2还原后再利用CH4碳化高磷鲕状赤铁矿这一难选矿石可以成功制备出碳化铁,碳化铁的平均粒径在2.5 μm左右; 温度低于873 K时,高磷鲕状赤铁矿可以被还原,但不能被碳化。
2)利用高磷鲕状赤铁矿制备碳化铁时,温度越高,还原越快;在碳化阶段,碳化速度随着温度的升高也有明显的增加。但当温度在1 023 K以上时,还原速率随温度再升高增加不是很大,碳化速率基本没有发生明显变化。综合考虑, 高磷鲕状赤铁矿制备碳化铁的最佳温度为1 023 K。温度对反应速率的影响要大于矿粉粒度。
3)温度在973~1 023 K时,高磷鲕状赤铁矿制备碳化铁的最佳粒度为120~160目。矿粉粒度在120~160目矿粉的反应活化能最低,还原反应活化能为44.95 kJ/mol,碳化阶段表观活化能为9.71 kJ/mol。
| [1] |
毕学工, 周进东, 黄治成, 等.
高磷铁矿脱磷工艺研究现状[J]. 河南冶金, 2007, 15(6): 3.
BI Xuegong, ZHOU Jindong, HUANG Zhicheng, et al. Present investigation situation of dephosphorization process for high phosphorus content iron ores[J]. Henan Metallurgy, 2007, 15(6): 3. (in Chinese) |
| [2] |
陈禄玫, 任南琪, 熊大和.
海钢尾矿强磁-离心分离再选试验[J]. 金属矿山, 2006(10): 75.
CHEN Lumei, REN Nanqi, XIONG Dahe. Test research on reconcentration of hainan steels tailings by high intensity magnetic separation-centrifugal separator[J]. Metal Mine, 2006(10): 75. (in Chinese) |
| [3] |
郝先耀, 戴惠新, 赵志强.
高磷铁矿石降磷的现状与存在[J]. 金属矿山, 2007(1): 7.
HAO Xianyao, DAI Huixin, ZHAO Zhiqiang. State Quo of phosphorous reduction of high phosphorus iron ore and discussion on its problems[J]. Metal Mine, 2007(1): 7. (in Chinese) |
| [4] |
卢尚文, 张邦家, 熊道仁, 等.
宁乡式胶磷铁矿用解胶浸矿法降磷的研究[J]. 金属矿山, 1994(8): 30.
LU Shangwen, ZHANG Bangjia, XIONG Daoren, et al. Investigation on the dephosphorization of lingxiang type colloidal phosphorous iron ore by decolloidization leaching[J]. Metal Mine, 1994(8): 30. (in Chinese) |
| [5] | Obot C N A W. Phosphorus Removal Capability of Aspergillus Terreus and Bacillus Subtilis from Nigeria's Agbaja Iron Ore[J]. Journal of Minerals & Materials Characterization & Engineering, 2010, 9(12): 1131–1138. |
| [6] | Obot O W, Anyakwo C N. Comparative Phosphorus Removal Capabilities of Eurotium Herbarorium and Clostridium Species on Nigeria'S Agbaja Iron Ore[J]. Journal of Minerals & Materials Characterization & Engineering, 2012, 11(8): 848–852. |
| [7] | Bahgat M. Technology of Iron Carbide Synthesis[J]. Journal of materials science and technology, 2006, 22(3): 423–432. |
| [8] |
中川大, 村山武昭, 小野陽一.
CH4-H2混合ガスによるアイアンカーバイドの製造[J]. 鉄と鋼, 1996, 82(4): 261–265.
Hiroshi N, Takeaki M, Yoichi O. Production of Iron Carbide in CH4-H2 Mixtures[J]. The Iron and Steel Institute of Japan, 1996, 82(4): 261–265. (in Chinese) |
| [9] | Zhang J Q, O Ostrovsk. Cementite formation in CH4-H2-Ar gas mixture and cementite stability[J]. ISIJ International, 2001, 41(4): 333. DOI:10.2355/isijinternational.41.333 |
| [10] | Li G Q, Ma J H, Ni H W, et al. Influences of oxide additions on formation reaction of iron carbide at 1 023 k[J]. ISIJ International, 2006, 46(7): 981–986. DOI:10.2355/isijinternational.46.981 |
| [11] |
何强, 李光强, 吴仕慈, 等.
V2O3、Al2O3添加剂对碳化铁生成的影响[J]. 钢铁钒钛, 2008, 29(2): 28.
HE Qiang, LI Guangqiang, WU Shici, et al. Effect of V2O3 and Al2O3 addition on iron carbide formation[J]. Iron Steel Vandium Titanium, 2008, 29(2): 28. (in Chinese) |
| [12] | Li G Q, Wang H H, Yang J, et al.Preparation of iron carbide from high phosphorus oolitic hematite[C]//Chemical, Material and Metallurgical Engineering Ⅲ.Zhuhai, December 10-11, 2013. |
| [13] |
何强, 李光强, 马江华, 等.
添加V2O5催化剂制备碳化铁的动力学[J]. 过程工程学报, 2008, 8(suppl): 194.
HE Qiang, LI Guangqiang, MA Jianghua, et al. Study on reaction kinetics of promoting iron carbide formation by V2O5 additive[J]. The Chinese Journal of Process Engineering, 2008, 8(suppl): 194. (in Chinese) |
| [14] |
薛正良, 赵栋楠, 杨叠, 等.
高碱度内配煤团块自还原过程中脱硫和脱磷[J]. 北京科技大学学报, 2010, 32(12): 1532–1536.
XUE Zhengliang, ZHAO Dongnan, YANG Die, et al. Desulfurization and dephosphorization during self-reduction of high-basicity coal-bearing iron oxide briquettes[J]. Journal of University of Science and Technology Beijing, 2010, 32(12): 1532–1536. (in Chinese) |
| [15] |
赵志龙, 唐惠庆, 郭占成, 等.
高磷铁矿气基还原冶炼低磷铁[J]. 北京科技大学学报, 2009, 31(8): 964–969.
ZHAO Zhilong, TANG Huiqing, GUO Zhancheng, et al. Dephosphorization of high-level phosphorus iron ore by gas-based reduction and melt separation[J]. Journal of University of Science and Technology Beijing, 2009, 31(8): 964–969. (in Chinese) |
| [16] |
华一新. 冶金过程动力学导论[M]. 北京: 冶金工业出版社, 2004.
HUA Yixin. An introduction to kinetics of metallurgical processes[M]. Beijing: Metallurgical Industry Press, 2004. (in Chinese) |
 2015, Vol. 38
2015, Vol. 38


