2. 重庆大学 汽车工程学院,重庆 400044
2. College of Automotive Engineering, Chongqing University, Chongqing 400044, P.R.China
Power MEMS即基于MEMS的微型动力能源系统,它通过利用燃烧化学反应能量来实现超高能量密度。液态烃类燃料低,热值可达105 kJ/kg,采用液态烃类燃料的Power MEMS能量密度比当今最好的LiSO2电池高20~30倍,能满足远距离传输要求,且液态燃料充装方便,在便携式能源系统领域具有重要的研究价值[1]。MIT的Epstein最早提出微型涡轮发动机概念,并在微流体力学、微燃烧和微气体轴承等基础领域取得了很多进展,但仍未见完整样机的实际稳定运行[2]。其他典型的Power MEMS研究还包括:汪克尔转子发动机[3]、微型外热机[4]、NASA的微型蒸汽轮机[5]及微热电系统等[6]。其中,微热电系统无运动部件,运行平稳,但转换效率较低。相比其他Power MEMS,微型内燃机结构相对简单,热功转换原理成熟,更易于微型化,采用液态烃类燃料微型活塞式内燃机应当是最有可能实用化的超高能量密度微能源系统。
基于发展微动力能源系统的要求,微燃烧研究得到重视。欧盟研究人员采用详细化学反应和质量传输方程通过多维数值模拟方法对环境压力燃空当量比0.5稀预混合氢空气在内径1.0和1.5 mm管内燃烧火焰进行了研究[7]。俄克拉何马州立大学Olinger对管道式微燃烧器氢氧燃烧过程进行了模拟,并通过简单的传热模拟对淬息条件进行了计算[8]。马里兰大学帕克分校Leach采用一维连续方程与能量方程并结合充分化学机理,数值模拟了壁面传热和管壁导热对微通道氢氧燃烧的影响[9]。上述研究主要针对微型管道式燃烧器具有过程连续性和开口热力系特性的准稳态燃烧过程开展研究,指出微燃烧具有相对热损大,驻留时间短的特征。
鉴于此,为了研究当量比和转速对微型活塞式内燃机带有移动边界的闭口热力系的强时变性瞬态微燃烧过程的影响规律和机理,采用层流有限速率模型和甲醇氧化反应机理以及动网格技术,对其瞬态预混层流燃烧过程开展仿真研究,探讨当量比和转速对微燃烧特性的影响规律及临界运行参数。在此基础上,提出采用热着火理论和化学反应动力学理论探索当量比对微燃烧特性的影响机理。
1 层流有限速率模型及甲醇氧化机理 1.1 层流有限速率模型对于微型发动机,要求缸内具有较短的停留时间和较快的燃烧速度。而甲醇具有较大的层流火焰传播速度(0.327 m/s),燃烧持续期较短,燃烧效率较高,适应于微型燃烧要求。分析微型燃烧室内混合气体流动状态,发现雷诺数为568~1 840(随转速变化),流动状态为层流。对于层流预混燃烧,化学反应时间尺度远大于微混合时间尺度,燃烧反应速率受化学反应控制。因此,将层流有限速率模型应用于微型内燃机甲醇预混瞬态燃烧过程的数值仿真。
燃烧过程数学模型包括质量守恒方程、动量守恒方程、能量守恒方程和组分质量守恒方程,其守恒方程通用形式为
| $\frac{\partial }{{\partial t}}\left( {\rho \varphi } \right) + \nabla \cdot \left( {\varepsilon v\varphi } \right) = \nabla \cdot \left( {{\mathit{\Gamma }_\varphi }\nabla \varphi } \right) + S, $ | (1) |
式中:φ为通用求解变量;Γφ为广义扩散系数;S为广义源项;ρ为混合物密度;v为速度,为散度。φ、Γφ和S在特定方程中具体代表如表 1。
| 表 1 符号在特定方程的意义 Table 1 Sense of symbol in control equation |
表 1中:μ为气体粘度;k为气体导热系数;cp为气体比热容;T为气体温度;Yi为组分质量分数;Di, m为组分扩散系数;Ri为组分化学反应源项。
在求解组分i的质量守恒方程时,层流有限速率模型采用Arrhenius公式计算化学反应源项。组分i的化学反应净源项通过有组分i参加的NR个化学反应的Arrhenius反应源的和计算得到:
| ${R_i} = {M_{{\rm{w, }}i}}\sum\limits_{i = 1}^{{N_r}} {{{\hat R}_{i, r}}}, $ | (2) |
式中:Mw, i是组分i的分子量;
| $\sum\limits_{i = 1}^N {{{v'}_{i, r}}} {M_i}\mathop \rightleftharpoons \limits_{{k_{{\text{b, }}r}}}^{{k_{{\text{f, }}r}}} \sum\limits_{i = 1}^N {{{v''}_{i, r}}{M_i}, } $ | (3) |
式中:N为系统中化学组分数目;ν′i, r为反应r中反应物i的化学计量系数;ν″i, r为反应r中生成物i的化学计量系数;Mi为组分i的符号;kf, r为反应r的正向速率常数;kb, r为反应r的逆向速率常数。
第r个反应中,组分i的产生或分解摩尔速度为
| ${{\hat R}_{i, r}} = \lambda \left( {{{\upsilon ''}_{i, r}}- {{\upsilon '}_{i, r}}} \right)\left( {{k_{{\text{f, }}r}}\prod\limits_{j = 1}^{Nr} {\left[{{C_{j, r}}} \right]{{\eta '}_{j, r}}} - {k_{{\text{b, }}r}}\prod\limits_{j = 1}^{Nr} {\left[{{C_{j, r}}} \right]{{\eta ''}_{j, r}}} } \right), $ | (4) |
式中:Nr为反应r的化学组分数目;Cj, r为反应r中每种反应物或生成物j的摩尔浓度;η′j, r为反应r中每种反应物或生成物j的正向反应速度指数;η″j, r为反应r中每种反应物或生成物j的逆向反应速度指数;λ为第三体对反应速率的净影响。反应r的正向速率常数kf, r通过Arrhenius公式计算:
| ${k_{{\text{f, }}r}} = {A_r}{T^{\beta r}}{{\text{e}}^{-\frac{{Er}}{{RT}}}}, $ | (5) |
式中:Ar为指数前因子;βr为温度指数;Er为反应活化能;R为气体常数。逆向速率常数kb, r计算式为:
| ${k_{{\text{b, }}r}} = \frac{{{k_{{\text{f, }}r}}}}{{{k_r}}}, $ | (6) |
式中kr为平衡常数。对于反应速率常数基于压力变化的处理采用Troe方法。
1.2 详细甲醇氧化反应机理Tsang[10]系统研究整理了甲醇反应相关的数据, 为构建甲醇反应机理提供了完善的数据基础。Held等[11]基于分级构建的方法构建了一个比较完善的甲醇氧化详细反应机理。Li等[12]以Held和Dryer机理为基础, 采用部分新的反应速率常数和热力学数据, 利用CO /H2O /H2/O2、CH2O、CH3OH的反应机理分级构建了一个甲醇氧化详细反应机理,与Held和Dryer机理相比,该机理更加完善,适用范围更宽广。Li机理被国内学者广泛采用[13-14],这里也采用Li机理,共84步基元反应,17个组分。另外再加上高温NO热生成机理。
2 微燃烧过程动态仿真模型建立仿真对象为微型二冲程活塞式发动机,缸径10.8 mm, 行程10 mm,压缩比为7.6。燃料为甲醇[15],甲醇十六烷值低,不易着火,所以采用电热丝助燃点火。燃烧室由下半部的圆柱体和上半部的圆锥体构成,助燃热丝位于燃烧室中心,所以燃烧室结构中心轴对称。仿真从进气结束的上止点前105°曲轴转角开始,结束于开始排气的上止点后105°曲轴转角。由于仿真时缸内处于封闭状态,此时缸内流场主要在径向和轴向上变化,忽略进排气流动对流场初始条件的影响,这里假定缸内流场轴对称。又考虑到仿真时采用详细化学反应机理,为了节约计算时间,所以只对缸内一个二维轴对称平面内的流场进行仿真。对燃烧室建立二维轴对称几何模型,燃烧室几何空间由顶面、热丝火头、壁面、对称轴和表现为可移动边界的活塞构成。
采用四边形和三角形混合网格划分方案,壁面施加边界层网格,经过网格独立性检查,最终取网格尺寸为0.2 mm,网格总数约2 100。采用动态分层动网格技术划分动网格,动态分层分割因子取为0.4,压缩合并因子取为0.1。
对于微型燃烧室,壁面热边界对燃烧过程的影响远大于宏观尺度,较为合理和可行的处理是施加第三类热边界条件,而固体材料内部导热则按一维假设处理。燃烧室外壁面平均对流换热系数采用强制横掠管外对流换热关系式
将仿真结果与实验结果进行对比,对比时工况初始压力为7.0E+04 Pa,初始温度为370 K,转速为6 000 r/min,当量比为1.8,压缩比为7.6。图 1显示仿真结果与实验结果比较吻合。数值仿真结果误差主要由数值误差和建模误差组成,数值误差主要由网格产生的离散误差和时间步长产生的离散误差以及控制方程离散所产生的截断误差组成。为了控制离散误差,在划分网格时,比较了不同网格尺寸的模型,发现当网格尺寸为0.2 mm时,再进一步细化网格,数值解已基本不再变化,所以最终取网格尺寸0.2 mm,获得网格独立的解。对于时间步长的选取,也做了类似的处理,最终取0.1°CA一个时间步长。且经过对比发现,当每步长最大迭代数为100次时,进一步增大迭代数结果已基本不再变化,所以每步长最大迭代取100次,获得时间步长独立的解。为了控制截断误差,控制方程中对流项和扩散项都采用二阶离散格式。综合上述比较和分析,仿真结果有效。
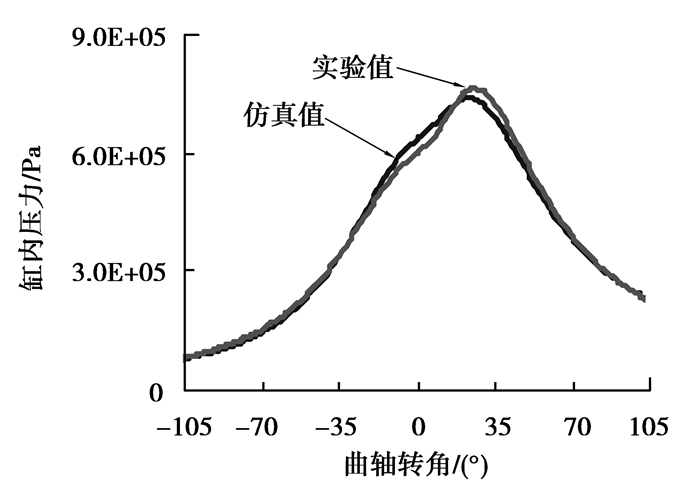
|
图 1 仿真与实验结果对比 Figure 1 Comparison between simulation and experiment |
图 2为不同当量比下的燃烧性能图,工况起始压力为1.0E+05 Pa, 起始温度为370 K,转速为5 000 r/min,压缩比为7.6。压力变化图显示,当量比对燃烧过程的影响显著,在稀薄燃烧区域,当量比越小,即混合燃气越稀薄,同一曲轴转角下,缸内压力越低,特别是在上止点后,随当量比的减小,缸内压力下降非常明显,且峰值也有明显的下降。在浓燃区内,随当量比增加,同一曲轴转角下缸内压力先增大后减小,当量比为1.1时压力最大。浓燃区缸内压力随当量比的变化没有稀薄燃烧区敏感。
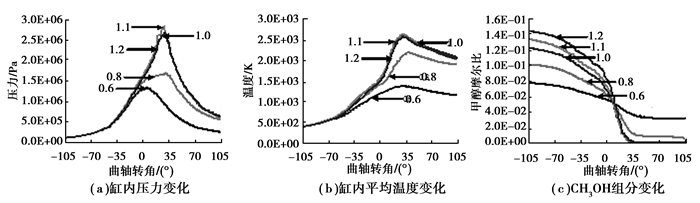
|
图 2 当量比对缸内燃烧特性的影响 Figure 2 Effect of equivalent ratio to combustion characteristics |
温度变化图显示,燃烧过程中缸内平均温度随当量比变化情况与压力随当量比变化类似。稀燃区随当量比减小,缸内平均温度显著减小,峰值也明显减小。在浓燃区内,随当量比增加,同一曲轴转角下缸内平均温度先增大后减小,当量比为1.1时缸内平均温度最大。浓燃区缸内平均温度随当量比的变化没有稀薄燃烧区敏感。CH3OH燃料消耗图显示,在稀薄燃烧区,当量比越小,混合气越稀薄,甲醇消耗速率越小,到排气开始时,当量比为0.6、0.8情况下燃料没有完全消耗。在浓燃区,1.1当量比时甲醇完全消耗所需时间最短,3个工况下甲醇最后都完全消耗。
应用热着火理论分析以上燃烧特性,在稀薄燃烧区内,随当量比的增加,燃料浓度增加,同一区域燃烧时释放的总热量增加,导致缸内平均温度和压力随之增加,从而缸内更多燃料温度达到燃料燃点进而开始燃烧,所以总的燃烧速率增大,缸内温度和压力也进一步增大。而且,由于0.6、0.8当量比下燃料浓度较小,燃烧所释放的热量较少;又微尺度发动机面积/体积比较大,相对散热量也较大,而甲醇燃料本身燃点较高,不易燃烧,所以部分区域燃料温度未达到燃点燃烧,导致整个缸内燃料未实现完全消耗。
应用化学反应动力学理论进一步分析以上燃烧特性,稀薄燃烧区内,一方面,随当量比的增加,燃料分子浓度增加;另一方面,随当量比的增加,同一区域燃烧时释放的总热量增加,将会有更多的反应热从火焰锋面传导入未燃区,导致未燃区有效活性基浓度增加,使得基元反应速率增加,整个燃烧过程加快,所以缸内温度和压力增加。鉴于反应15 H2O2(+M)=OH+OH (+M)具有最大的正温度敏感系数,以该基元反应为例,对5°CA曲轴转角时当量比0.6和1.0的缸内燃烧状况进行对比如图 3所示,自由基OH浓度对比图显示,随当量比的增加,缸内OH浓度增大。从基元反应15反应速率对比图显示,位于各自火焰前锋面中的反应速率随当量比的提高而增大,基元反应速率增大使燃料燃烧过程加快,所以缸内平均温度和压力随当量比的增大而增大。
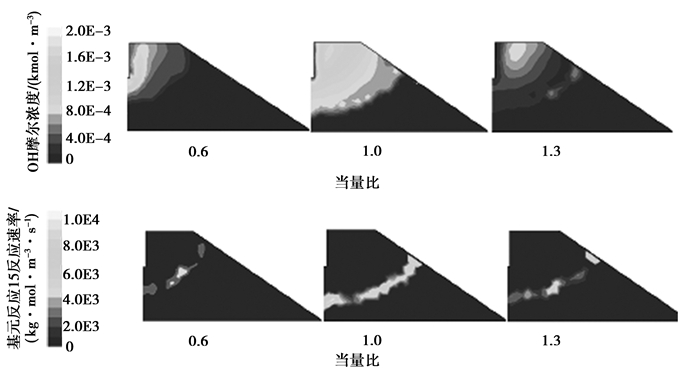
|
图 3 不同当量比下5°曲轴转角的缸内燃烧对比图 Figure 3 Combustion comparison at 5°Crack Angel under different equivalent |
浓燃区内,当量比大于1.1时,当量比越大,氧化有效活性基浓度越小,相应基元反应速率越小,总的燃烧速率越小,所以缸内平均温度和压力越小。图 3显示,OH摩尔浓度和基元反应15反应速率随当量比的增大而减小。
对当量比从1.0到1.1的浓燃区燃烧特性进行分析,为此对5°曲轴转角时当量比为1.1和1.0的燃烧数据进行统计。此时当量比为1.1的OH浓度为0.000 27 kmol/m3,CO摩尔浓度为0.001 6 kmol/m3, 基元反应23CO+OH=CO2+H反应速率为12.1 kg·mol/(m3·s),当量比为1.0的OH摩尔浓度为0.000 32 kmol/m3,CO摩尔浓度为0.001 1 kmol/m3, 基元反应23CO+OH=CO2+H反应速率为9.3 kg·mol/(m3·s)。虽然此时当量比为1.1的OH摩尔浓度小于当量比为1.0的OH浓度,但由于前者的CO摩尔浓度大于后者,使得前者的基元反应23反应速率大于后者,而反应23是整个燃烧过程最主要的放热反应,所以此时当量比为1.1时缸内温度和压力大于当量比为1.0时的情况。即在浓燃区内,虽然整体上氧气含量相对不足,但当量比为1.1情况下,缸内OH浓度并不呈均匀分布,更多的OH提前与CO反应,所以在燃烧后期,OH含量更加不足,导致图 2(b)中当量比为1.1时温度下降幅度比当量比为1.0时大。
3.2 转速对燃烧性能的影响图 4为不同转速下的燃烧性能图,仿真时参数起始压力为1.0E+05 Pa, 起始温度370 K,当量比为1.0,压缩比为7.6。平均温度变化图显示,随发动机转速提高,温度上升阶段缸内平均温度减小,平均温度峰值也减小。温度下降阶段,转速越低,平均温度下降幅度越大,结果到达排气开始时,转速最大和最小两个工况平均温度最低。压力变化图显示,随转速提高,缸内压力减小,且压力峰值也减小。转速对缸内压力的影响与对平均温度的影响类似。9 000 r/min时由于缸内未燃燃料量较大,所以稍有不同。CH3OH燃料消耗图显示,7 000 r/min和9 000 r/min下燃料未完全消耗, 转速越低,燃料完全消耗时刻越接近于上止点。
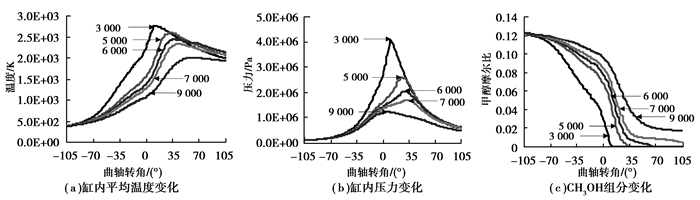
|
图 4 转速对燃烧特性的影响 Figure 4 Effect of rotational speed to combustion characteristics |
由于转速越低,同一转角下所对应的实际经历时间越长,留给缸内燃料燃烧时间越长,反应更加充分,释放出的反应热更多,所以温度上升阶段同一转角下转速越低,缸内平均温度和压力越高。而温度下降阶段,转速越低,对环境散热时间越长,散热总量越大,所以到排气开始时,平均温度下降幅度越大。7 000 r/min和9 000 r/min时由于留给燃料燃烧时间过短,所以最终燃料未完全燃烧。
4 结论1) 当量比对微燃烧特性影响显著,当量比从0.6增加到1.1时,燃烧速率增加,压力和温度都增加,最大压力值增加约1.5E+6 Pa,温度最大值增加约1 300 K。当量比进一步增大时,燃烧速率减小,压力和温度转而下降。
2) 运用热着火理论和化学反应动力学理论对以上燃烧特性进行了探讨,进一步揭示了当量比影响微燃烧特性的机理:稀燃区,当量比主要通过缸内温度变化来影响微燃烧特性,随当量比增加,由于燃料浓度增加,燃烧释放的总热量增加,所以温度和压力增加,使得有效活性基浓度增加,导致基元反应速率增加,燃烧速率增加。浓燃区当量比主要通过氧气量变化来影响微燃烧特性,氧气量不足,当量比越大,氢氧活性基团浓度越小,基元反应速率越小,所以燃烧速率越小,温度和压力越低。
3) 转速对微燃烧具有显著影响,转速越高,留给燃料燃烧时间越少,燃烧越不充分,释放总热量越少,所以温度和压力越低。
4) 受微燃烧相对热损大、驻留时间短的特征影响,微型发动机实现完全燃烧的运行区域较窄,文中实现完全燃烧的稀燃极限约0.9,最高转速约6 000 r/min。这在设计微型内燃机时值得关注。
| [1] | Chou S K, Yang W M, Chua K J, et al. Development of micro power generators: A review[J]. Applied Energy, 2011, 88(1): 1–16. DOI:10.1016/j.apenergy.2010.07.010 |
| [2] | Epstein A H, Epstein A H. Millimeter-scale, micro-electro-mechanical systems gas turbine engines[J]. Journal of Engineering for Gas Turbines and Power, 2004, 126(2): 205–226. DOI:10.1115/1.1739245 |
| [3] | Fernandez-Pello A C, Pisano A P, Fu K. MEMS rotary engine power system[J]. IEEJ Transactions on Sensors and Micromachines, 2003, 123(9): 326–330. DOI:10.1541/ieejsmas.123.326 |
| [4] | Whalen S, Richards R, Bahr D, et al.Operation and testing of a micro heat engine[C]//Proceedings of 2003 Nanotechnology Conference and Trade Show -Nanotech 2003.San Francisco, CA:Computational Publications, February 2003:404-407. |
| [5] | Frechette L G, Lee C, Arslan S, et al.Design of a microfabricated Rankine cycle steam turbine for power generation[C]//ASME 2003 International Mechanical Engineering Congress and Exposition, November 15-21, 2003, Washington, DC, USA.[S.L.]:ASME, 23(3):335-344. |
| [6] | Xue H, Yang W M, Chou S K, et al. Microthermophotovoltaics power system for portable MEMS devices[J]. Microscale Thermophysical Engineering, 2005, 9(1): 85–97. DOI:10.1080/10893950590913431 |
| [7] | Pizza G, Frouzakis C E, Mantzaras J, et al. Three-dimensional simulations of premixed hydrogen/air flames in microtubes[J]. Journal of Fluid Mechanics, 2010, 658(9): 463–491. |
| [8] | Olinger D.Modeling of pressure and temperature development in micro-scale combustion [C]//43rd AIAA Aerospace Sciences Meeting and Exhibit.January 10-13, Reno, Nvada.[S.L.]:Aiaa Journal, 2005. |
| [9] | Leach T T, Cadou C P, Jackson G S. Effect of structural conduction and heat loss on combustion in micro-channels[J]. Combustion Theory and Modeling, 2006, 10(1): 85–103. DOI:10.1080/13647830500277332 |
| [10] | Tsang W. Chemical kinetic data base for combustion chemistry.Part 2.Methano[J]. Journal of Physical and Chemical Reference Data (S0047-2689), 1987, 16(3): 471–620. DOI:10.1063/1.555802 |
| [11] | Held T J, Dryer F L. A comprehensive mechanism for methanol oxidation[J]. International Journal of Chemical Kinetics, 1998, 30(11): 805–830. DOI:10.1002/(ISSN)1097-4601 |
| [12] | Li J, Zhao Z, Andrei K, et al. A comprehensive kinetic mechanism for CO, CH2O, and CH3OH combustion[J]. International Journal of Chemical Kinetics, 2007, 39(3): 109–136. DOI:10.1002/kin.20218 |
| [13] |
冉景煜, 秦昌雷, 吴晟.
壁面参数对甲烷微尺度催化燃烧的影响[J]. 重庆大学学报, 2012, 35(2): 1–9.
RAN Jingyu, QIN Changlei, WU Shen. The effects of wall parameters on CH4 catalytic combustion in microchannel[J]. Journal of Chongqing University, 2012, 35(2): 1–9. (in Chinese) |
| [14] |
王刚, 刘训标, 袁春, 等.
一个新的甲醇氧化简化化学动力学机理[J]. 燃烧科学与技术, 2009, 15(6): 557–564.
WANG Gang, LIU Xunbiao, YUAN Chun, et al. A new reduced chemical kinetic mechanism for methanol oxidation[J]. Journal of Combustion Science and Technology, 2009, 15(6): 557–564. (in Chinese) |
| [15] |
蒋德明, 黄佐华. 内燃机替代燃料燃烧学[M]. 西安: 西安交通大学出版社, 2007.
JIANG Deuming, HUANG Zuohua. Internal combustion engine alternative fuel combustion[M]. Xi'an: Xi'an Jiaotong University Press, 2007. (in Chinese) |
 2015, Vol. 38
2015, Vol. 38

