2. 中国科学院青海盐湖研究所 中国科学院盐湖资源与化学重点实验室,西宁 810008;
3. 中铁第一勘察设计院集团有限公司,西安 710043
2. Key Laboratory of Salt Lake Resources and Chemistry, Qinghai Institute of Salt Lakes, Chinese Academy of Sciences, Xining 810008, P.R.China;
3. China Railway First Survey and Design Institute Group Ltd., Xi'an 710043, P.R.China
混凝土硫酸盐腐蚀破坏是最常见的影响混凝土耐久性的因素之一,它是一种膨胀性破坏,使混凝土开裂、剥落,从而降低混凝土的强度,导致工程结构往往达不到预期的使用要求[1-2]。硫酸盐侵蚀破坏多发于水质中离子含量较高的地区。由于土壤或海水和某些地下水中硫酸盐含量较高,混凝土受硫酸盐侵蚀比较严重[3]。混凝土工程都因为硫酸盐侵蚀而不能达到设计的耐久寿命,所以有必要研究混凝土硫酸盐腐蚀问题。
根据规范GB 50082-2009《普通混凝土长期性能和耐久性能的实验方法标准》规定的硫酸盐试验方法,即采用硫酸盐溶液对混凝土试件进行干湿循环实验。硫酸盐溶液对混凝土的侵蚀不会在一开始就使混凝土破坏,而是一个循序渐进的过程,由于混凝土试件是固体,硫酸盐溶液是液体状态,这个过程应该包括固-液界面的表面吸附、硫酸盐溶液的扩散过程以及硫酸盐在混凝土试件内部化学反应和物理结晶等物理化学过程[4-6]。文中将从3个方面来分析硫酸盐溶液对混凝土试件腐蚀的机理。
1 试验原材料及试验方案 1.1 试验原材料及其性能水泥:试验采用甘肃永登水泥厂生产的祁连山牌42.5级普通硅酸盐水泥,性能指标合格,化学成分如表 1所示。
| 表 1 水泥的化学成分 Table 1 Chemical composition (by mass) of cement |
粉煤灰:兰州二热厂产性能良好的I级粉煤灰。其化学成分如表 2所示。
| 表 2 粉煤灰化学成分 Table 2 Chemical composition (by mass) of cement |
试验设计使用混凝土试件强度等级为C40, 其实际配合比,即水泥、粉煤灰、水、砂、石的质量比为:1:0.1:0.48:2.08:3.12。将成型后的试件放入标准条件下的养护室内养护28 d,然后开始进行实验。
1.3 试验方案考虑到一般盐类侵蚀, 选择5%的硫酸钠溶液, 其中的硫酸根含量相当于35 000 mg/L。根据GB/T 50082-2009《普通混凝土长期性能和耐久性能试验方法》,在试验室进行混凝土硫酸盐腐蚀试验,混凝土试件尺寸为100×100×400,混凝土试件在Na2SO4溶液中浸泡(15±0.5) h,进入烘箱烘干6 h, 进行干湿循环。观察其现象并研究分析在此过程中的离子的扩散规律。
2 模型原理 2.1 混凝土试件在硫酸盐溶液中的表面吸附在硫酸盐溶液中浸泡的混凝土试件是多孔性材料,硫酸盐溶液能渗透到混凝土试件中,对混凝土进行腐蚀破坏[7],这种渗透的机理其实是多孔性材料在固-液相界面的吸附。处在混凝土试件表面上的原子,由于周围的原子对它的作用力不对称,原子所受的力不饱和,因而有剩余力场,可以吸附硫酸盐溶液的液体分子。混凝土试件表面和硫酸盐溶液表面有一个重要的共同点,即表面上的力场是不饱和的,表面分子都处于非均匀力场之中,有表面张力存在[8]。混凝土试件的表面现象与硫酸盐溶液的不同,液体能够自动地缩小表面积降低表面吉布斯自由能,同时硫酸盐溶液表面还能对溶液中的溶质产生表面吸附,进一步降低表面吉布斯自由能。混凝土试件表面上的分子几乎是不能移动的,固体表面上原子和分子的位置就是在表面形成时它们所处的位置。无论经过多么精心抹平的混凝土试件表面,实际上都是凹凸不平的。正是由于固体表面的不均匀性,表面上可能没有2个原子或分子所处的情况是完全一样的。尽管混凝土试件表面和硫酸盐溶液表面不同,但它们产生吸附作用的实质都是趋向于使表面吉布斯自由能降到最低[9]。
为了降低表面张力,混凝土试件表面能够从表面外部空间吸附硫酸盐溶液的液体分子。当无规则热运动的液体分子碰撞到固体表面时,就有可能被吸附到表面上。混凝土试件表面吸附硫酸盐溶液的液体分子以后,表面上的不均匀力场就会减弱,从而使表面张力降低。固体在溶液中的吸附较为复杂,迄今尚未有完满的理论。因为既要吸附溶剂,又要吸附溶质,溶质和溶剂之间还有相互作用。
在混凝土试件表面吸附硫酸盐溶液的过程中,既存在物理吸附又存在化学吸附[10]。物理吸附是硫酸盐溶液分子借助混凝土试件表面浓集,这种浓集作用无任何选择性;混凝土试件表面依靠其表面分子的分子间力,把周围临近的硫酸盐溶液分子拉到混凝土试件表面上浓集。化学吸附是由于混凝土试件表面存在的水泥水化后的Ca (OH)2产物与硫酸盐溶液中的溶质Na2SO4发生化学反应,形成新的反应产物;混凝土试件表面依靠化学键力吸附周围临近的硫酸盐溶液中的分子和离子。在混凝土试件对硫酸盐溶液的吸附过程中,既存在物理吸附也存在化学吸附。硫酸盐溶液分子首先通过物理吸附到混凝土试件表面上,然后再与表面发生化学反应,所以物理吸附是化学吸附的前奏,如果没有物理吸附,化学吸附将变得很慢,甚至不会发生。
混凝土试件表面对硫酸盐溶液的物理吸附和化学吸附的本质区别是:在物理吸附中被吸附的硫酸盐溶液分子与混凝土试件表面之间的作用力是范德华力,而化学吸附则为化学键力,形成吸附键。试验中的Na2SO4溶液是一种电解质溶液,溶液在水中表现为离子形式:
| $ {\rm{N}}{{\rm{a}}_2}{\rm{S}}{{\rm{O}}_4} \Rightarrow {\rm{2N}}{{\rm{a}}^ + } + {\rm{SO}}_4^{2 - }。 $ |
固体在电解质溶液中对离子的吸附通常有2种[11]:离子选择性吸附和离子交换吸附。固体在电解质溶液中优先吸附某种电荷的离子(正离子或负离子)而使固体带有电荷(正或负),这种现象称为离子的选择性吸附;离子交换吸附与选择性吸附不同,它不是固体直接从溶液中吸附离子,而是固体本身的组成离子与溶液中的同号离子发生交换,即固体吸附剂在溶液中吸附了某种离子的同时,将另一种相同符号电荷的离子释放到溶液中。
混凝土试件对Na2SO4溶液的吸附应该是离子交换吸附,混凝土试件表面存在的部分Ca (OH)2接触到Na2SO4电解质溶液后,吸附了溶液中的SO42-离子,将自身的OH-释放到溶液中,离子交换过程如图 1所示,此过程仅考虑了混凝土试件表面存在的少量Ca (OH)2与Na2SO4电解质溶液的离子交换过程,混凝土试件表面存在的其他水化产物与Na2SO4溶液的离子吸附形式尚不清楚,在混凝土试件表面Na2SO4溶液同时进行了物理吸附和化学吸附之后,Na2SO4溶液在混凝土试件内部应该进行扩散。
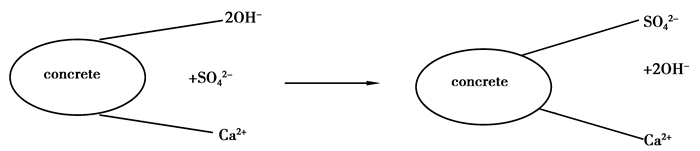
|
图 1 离子交换过程 Figure 1 Ion exchange process |
固-液相界面处的Na2SO4溶液不断深入到混凝土试件内部,把这个过程也叫做Na2SO4溶液的离子迁移,这种离子迁移的机理应该是以布朗运动为理论基础的Na2SO4溶液分子在固体混凝土试件中的扩散[12]。
根据分子运动论[13]的基本概念,不管是硫酸盐溶液还是混凝土试件,都是由大量分子组成的,而组成物质的分子在不停地做布朗运动,布朗运动的剧烈程度与物体的温度有关。根据分子的热运动理论,混凝土试件是固体,分子的无规则运动不够剧烈,分子在相互作用力的影响下被束缚在各自的平衡位置附近做微小的振动;硫酸盐溶液是液体状态,分子的无规则运动加剧,分子力的作用已不能把分子束缚在各自的平衡位置附近做微小的振动,也不能使分子分散远离。由于硫酸盐溶液的分子运动比混凝土试件的分子运动更加剧烈,最终结果就是硫酸盐溶液扩散到混凝土试件内部[14]。
外部硫酸钠溶液经过一段时间的自扩散之后,应该不存在浓度梯度,溶液中浓度处处相同,混凝土试件表面吸附了硫酸钠溶液,达到吸附平衡,也就是说混凝土试件表面应该具有和Na2SO4溶液中相同的浓度;混凝土试件内部无Na2SO4,可以认为在一开始的时候混凝土试件内部Na2SO4浓度为0,此时混凝土试件的表面和内部存在浓度差,浓度差是引起的Na2SO4溶液分子扩散的驱动力,这时假定扩散服从Fick第一定律。
采用Fick定律[15]适用条件:在定温、定压的条件下,二元扩散体系中任意组元的分子扩散通量与该组元的浓度梯度成正比,如式(1)所示。
| $ {J_A}{\;^*} = - {D_{AB}}\frac{{{\rm{d}}{c_A}}}{{{\rm{d}}z}}, $ | (1) |
式中:JA*为Na2SO4溶液沿混凝土试件z轴的通量,kmol/(s·m2);DAB为比例系数,称为扩散系数;dcA/dz为Na2SO4溶液沿混凝土试件z轴的浓度梯度。负号表示分子扩散通量沿浓度减小的方向,混凝土试件z轴指的是混凝土试件表面到混凝土深处的距离。由式(1)有
| $ {\dot D_{{\rm{AB}}}} = - {J_A}{\;^*}/\frac{{{\rm{d}}{c_A}}}{{{\rm{d}}z}}。 $ | (2) |
可见,扩散系数DAB表示单位浓度梯度下的通量,它反映分子扩散的强度,取决于A组元和B组元的物性、体系的状态以及混合物的成分,这里的A组元是Na2SO4溶液,B组元是混凝土试件。式(1)通常使用于气体分子扩散过程,若用于混凝土试件中,因为混凝土试件是固体,应改写成固体的稳态传质方程
| $ {N_{\rm{A}}} = - {D_{{\rm{AB}}}}\frac{{{\rm{d}}{c_A}}}{{{\rm{d}}z}}, $ | (3) |
式中DAB表示Na2SO4溶液通过混凝土试件的扩散系数,在混凝土试件沿z轴方向,两点1和2之间积分得通量公式
| $ {N_{\rm{A}}} = \frac{{{D_{AB}}\left( {{c_{{\rm{A1}}}} - {c_{{\rm{A2}}}}} \right)}}{{{z_2} - {z_1}}}。 $ | (4) |
式(3)的固体稳态传质方程考虑了混凝土试件是固体,Na2SO4溶液的扩散过程没有考虑混凝土试件的结构,而是把混凝土试件按均匀物质处理;由于混凝土是多孔性、非均质固体材料,多孔材料中充满了空隙或孔洞,其空隙的尺寸和类型极大地影响着固体中的扩散[16-17]。图 2示意的混凝土试件为多孔固体,混凝土试件内部空隙中充满水,在边界1处为混凝土试件外表面,Na2SO4浓度为cA1,在边界2处为混凝土试件内部某一点,Na2SO4浓度为0,因而Na2SO4将由1向2扩散。在扩散过程中,Na2SO4分子必须通过图 1中虚线所示的曲折路径,虽然该路径的长度不知,但该路径一定比z2-z1长。
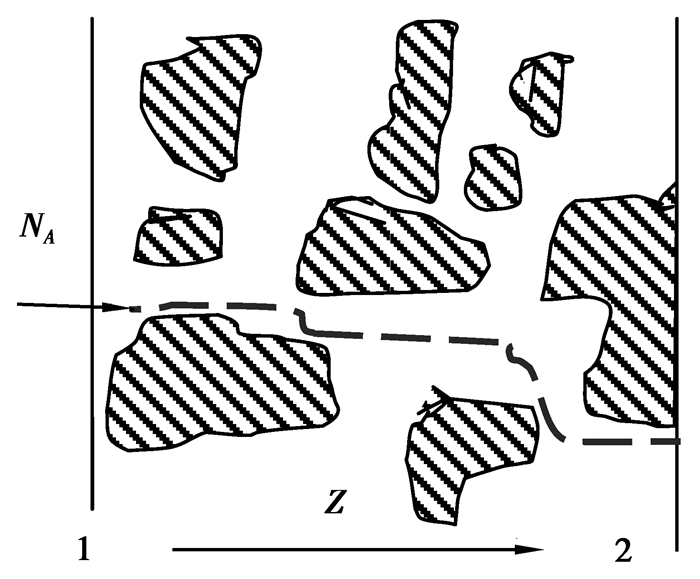
|
图 2 多孔固体示意图 Figure 2 schematic diagram of porous solid |
假定曲折路径为z2-z1的kt倍,kt称为曲折度,必须由实验确定。由式(4)可知,Na2SO4在混凝土试件中的稳态扩散通量公式可写为
| $ {N_{\rm{A}}} = \frac{\varepsilon }{{k_t^2}} \cdot {D_{{\rm{AB}}}}\frac{{{c_{{\rm{A1}}}} - {c_{{\rm{A2}}}}}}{{{z_2} - {z_1}}}, $ | (5) |
式中:ε为空隙分数;DAB为Na2SO4的扩散系数;kt2,其中一个kt修正比z2-z1长的扩散路径,另一个kt修正在固体表面的孔洞与表面所构成的角度,kt的实验值在1.2~2.5范围内。通常把ε、kt、DAB写在一起,即
| $ {D_{{\rm{Aeff}}}} = \frac{\varepsilon }{{k_t^2}}{D_{{\rm{AB}}}}。 $ | (6) |
上述推导未考虑Na2SO4溶液在扩散过程中浓度随时间的变化,若Na2SO4溶液在混凝土试件中扩散时dc/dt≠0,假定图 1中进入界面1和流出界面2的扩散通量为J1和J2,则在单元体积中溶质积累速率为
| $ \frac{{\partial c}}{{\partial t}} \cdot {\rm{d}}z = {J_1} - {J_2}, $ | (7) |
进入界面1的扩散通量:
| $ {J_1} =-D{\left( {\frac{{\partial c}}{{\partial z}}} \right)_z}, $ | (8) |
流出界面2的扩散通量:
| $ {J_2} =- D{\left( {\frac{{\partial c}}{{\partial z}}} \right)_{z + {\rm{d}}z}} = {J_1} + \frac{\partial }{{\partial z}}{\left[{-D\frac{{\partial c}}{{\partial z}}} \right]_{{\rm{d}}z}}, $ | (9) |
则有
| $ \frac{{\partial c}}{{\partial z}} \cdot {\rm{d}}z = D\frac{{{\partial ^2}c}}{{\partial {z^2}}} \cdot {\rm{d}}z, $ | (10) |
| $ \frac{{\partial c}}{{\partial t}} = D\frac{{{\partial ^2}c}}{{\partial {z^2}}}。 $ | (11) |
即Fick第二定律。式中:t为时间; z为距混凝土表面的距离; D为SO42-离子扩散系数; c为距混凝土表面z处的SO42-离子浓度。
此时对混凝土采用的假定是:混凝土是半无限均匀介质; SO42-离子扩散时不与混凝土结合, SO42-离子扩散系数是一个常数,但事实上,SO42-离子在扩散时会与混凝土内部水泥水化产物发生化学反应,必须考虑Na2SO4在混凝土试件内部的消耗量。同时,在混凝土试件中生成的各种反应物会在一定时间内填充混凝土孔隙,这也将影响Na2SO4溶液的扩散过程和扩散速度;伴随电解质溶液进入混凝土试件内部的Na+和混凝土水化产物释放的OH-的脱附过程也应该被考虑[18],可以按照Fick第二定律描述硫酸盐溶液在混凝土试件中的扩散过程。
3 试验现象及化学机理分析 3.1 干湿循环过程对Na2SO4溶液扩散的影响干湿循环过程对硫酸盐溶液中的混凝土试件产生较大的影响[19-20]。在循环初期,混凝土失水/吸水速率最大,之后大幅减小,同时离子的存在不影响混凝土水分的传输方式,但会大大降低其毛细吸附和扩散传输效果[21]。同时在循环过程中高温和低温不断反复作用,更加促进硫酸根离子的扩散[22-23]。通过实验可以观察到混凝土在硫酸盐溶液进行干湿循环过程中Na2SO4在混凝土试件表面的白色结晶产物,符合研究中设计的腐蚀模型[24]。试验前、后的混凝土试件如图 3、图 4所示。

|
图 3 试验前混凝土试件 Figure 3 Concrete specimen before test |

|
图 4 试验中的混凝土试件 Figure 4 The concrete specimen in the process of test |
Na2SO4溶液扩散进入混凝土试件之后,混凝土试件烘干的过程中,内部失水,有较大部分Na2SO4并未和混凝土试件内部的水泥水化产物发生化学反应,混凝土内部孔溶液盐浓度增大析出晶体,即:
| $ {\rm{N}}{{\rm{a}}_2}{\rm{S}}{{\rm{O}}_4} + 10{{\rm{H}}_2}{\rm{O}} \Leftrightarrow {\rm{NaS}}{{\rm{O}}_4} \cdot 10{{\rm{H}}_{\rm{2}}}{\rm{O}}。 $ |
在混凝土试件内部孔溶液高度饱和时,上述可逆反应会在混凝土内部孔壁上产生相当大的析晶渗透压;同时从可逆反应左边的无水硫酸钠到右边的10水硫酸钠,体积增大较多,在混凝土内部的孔隙也会产生较大的膨胀压力,这两种压力作用在混凝土的孔壁上,使混凝土毛细孔壁承受较大的环向拉伸应力,如果这个拉应力超过混凝土孔壁上自身的抗拉强度,混凝土内部的孔隙将破坏[25]。
如果在混凝土试件孔隙内温度超过32.4 ℃时,上述可逆反应向左进行,10水硫酸钠分解为无水硫酸钠,此时,由10水硫酸钠体积增大引起的作用在混凝土孔壁上的膨胀压力大大减小,水分变为水蒸气,作用在混凝土孔壁上的膨胀压力转化为蒸汽对毛细孔壁的压强,水蒸汽浓度增加,压强增大,同时气体温度也高于10水硫酸钠时的温度,气体分子扩散速度加快,大量气体会快速扩散到混凝土孔隙外,混凝土孔壁上承受的压力快速减小,混凝土孔壁上的拉应力快速下降[26]。
混凝土试件烘干6 h后,会再一次浸泡在Na2SO4溶液中,溶液再一次扩散进入混凝土试件内部的孔隙中,上述过程重复发生,混凝土孔壁上再次承受拉应力以及拉应力的快速卸载,这种过程的重复发生,混凝土孔壁上也会发生疲劳破坏[27-28],从而使材料丧失一定的强度和粘性,达不到正常使用要求[29-30]。
盐渍土地区实际混凝土结构的腐蚀[31]实例也符合上述分析,图 5、6、7为甘肃省某盐渍土地区被硫酸盐腐蚀的电线杆。

|
图 5 电线杆阳面 Figure 5 The sunny side of pole |

|
图 6 电线杆阴面 Figure 6 The dark side of pole |

|
图 7 加固处理的电线杆 Figure 7 Corrosion of the pole |
由于该地区干旱少雨,年降雨量小于年蒸发量,所以盐渍土中的硫酸盐对混凝土电线杆的腐蚀是在有水的情况下才会发生[31]。如果降雨后,混凝土电线杆的阳面由于太阳辐射强,会很快干燥,硫酸盐腐蚀能够发生的时间很短,机会很少,所以看到图 5中的电线杆阳面几乎未受腐蚀,表面完好;而电线杆的阴面由于水分蒸发速度慢,盐渍土中的硫酸盐会随着水分通过电线杆表面扩散到电线杆内部,随着水分蒸发,电线杆阴面的硫酸盐浓度增加,达到过饱和状态时硫酸盐结晶析出,在电线杆阴面内部孔隙结晶的硫酸盐体积增大,会破坏混凝土电线杆的内部结构,在表面结晶的硫酸盐附着在电线杆阴面外部,如图 4中看到的白色晶体;等电线杆阴面水分蒸发完全干燥后,硫酸盐大部分结晶在电线杆表面和内部(在有水的条件下部分硫酸盐参与化学反应),完成一次干湿循环,如果下次降雨,硫酸盐扩散和结晶过程重复进行,完成第二次干湿循环,所以处于盐渍土地区的混凝土电线杆的阴面受到干湿循环作用下硫酸盐的腐蚀,破坏速度很快,而阳面往往还处于完好状态,单面破坏最终导致混凝土电线杆的保护层脱落,钢筋外露,如图 7所示。
这种形式的干湿循环常见于电线杆的1.5 m以下的位置,高于1.5 m后,由于电线杆的阴阳面差别不大,并且距离盐渍土较远,硫酸盐扩散影响很少而不存在这样硫酸盐腐蚀破坏。在实际环境中的电线杆和试验中的混凝土试件均证明了干湿循环试验制度符合盐渍土地区混凝土的硫酸盐腐蚀破坏机理,Na2SO4的直接结晶是硫酸盐腐蚀破坏的主要因素,所以研究的混凝土试件在硫酸盐溶液中的腐蚀模型符合混凝土破坏的实际情况。
3.2 混凝土受硫酸盐腐蚀的物相化学平衡及机理分析1)混凝土是强亲水性多孔材料,且内部存在对硫酸盐溶液不稳定的物相,当混凝土试件浸入Na2SO4溶液中,在其界面就会发生化学侵蚀反应,本质是物相化学平衡问题,即使硫酸盐溶液不渗入混凝土内,也可从表面开始发生化学侵蚀反应,如图 8、图 9所示。

|
图 8 表层混凝土试件孔隙中的硫酸钙SEM照片 Figure 8 the SEM calcium sulfate in the surface layer concrete specimen pore |

|
图 9 混凝土试件20 mm深度的SEM照片 Figure 9 The SEM concrete specimen 20 mm depth |
2)硫酸根离子在混凝土中的扩散是一个复杂的问题,它比氯离子在混凝土中的扩散更复杂。部分原因是硫酸根离子可与混凝土中的氢氧化钙反应,形成较难溶的硫酸钙,会直接结晶到混凝土孔隙中
| $ {\rm{SO}}_4^{2-} + {\rm{Ca}}{\left( {{\rm{OH}}} \right)_2} = {\rm{CaS}}{{\rm{O}}_4} + 2{\rm{O}}{{\rm{H}}^-}, $ |
还有一部分扩散进入混凝土内部的硫酸根离子会与水泥中水化铝酸三钙生成钙矾石
| $ 3\left( {{\rm{CaS}}{{\rm{O}}_4} \cdot 2{{\rm{H}}_2}{\rm{O}}} \right) + 3{\rm{CaO}} \cdot {\rm{A}}{{\rm{l}}_2}{{\rm{O}}_3} \cdot {{\rm{H}}_2}{\rm{O = }}3{\rm{CaO}} \cdot {\rm{A}}{{\rm{l}}_2}{{\rm{O}}_3} \cdot 3{\rm{CaS}}{{\rm{O}}_4} \cdot 31{{\rm{H}}_2}{\rm{O}} $ |
综上所述,在该腐蚀模型中,化学反应是存在的,但是在干湿循环状态下,物理腐蚀占主要作用。
4 结论1)混凝土试件在硫酸盐溶液中浸泡时,它们的固液相界面处发生物理吸附和化学吸附,也存在表面化学反应。
2)混凝土在硫酸盐溶液中的腐蚀模型符合现场盐渍土地区混凝土结构物硫酸盐腐蚀破坏实例,可以参考采用Fick第二扩散定律来描述硫酸盐在混凝土中的扩散过程。
3)混凝土试件干湿循环作用下,孔壁上承受更快速的疲劳破坏,因此在这种试验条件下混凝土试件破坏速度更快,破坏程度更严重。
4)混凝土是强亲水性多孔材料,且内部存在对硫酸盐溶液不稳定的物相,试验现象分析也符合物相化学平衡问题。
| [1] |
高原, 张君, 韩宇栋.
硫酸盐侵蚀环境下混凝土断裂参数衰减规律[J]. 建筑材料学报, 2011, 14(4): 465–472.
GAO Yuan, ZHANG Jun, HAN Yudong. Decay of fracture parameters of concrete under sulfate environments[J]. Journal of building materials, 2011, 14(4): 465–472. (in Chinese) |
| [2] | Gao R, Li Q, Zhao S. Concrete Deterioration Mechanisms under Combined Sulfate Attack and Flexural Loading[J]. Journal of Materials in Civil Engineering, 2013, 25(1): 39–44. DOI:10.1061/(ASCE)MT.1943-5533.0000538 |
| [3] | Detwiler R J, Taylor P C, Powers L J, et al. Assessment of concrete in sulfate soils[J]. Journal of Performance of Constructed Facilities, 2000, 14(3): 89–96. DOI:10.1061/(ASCE)0887-3828(2000)14:3(89) |
| [4] |
邓德华, 刘赞群, GeertDe Schutter, 等.
关于"混凝土硫酸盐结晶破坏"理论的研究进展[J]. 硅酸盐学报, 2012, 40(2): 175–185.
DENG Dehua, LIU Zanqun, Schutter G D, et al. Research Progress on Theory of "Sulfate Salt Weathering on Concrete"[J]. Journal of the Chinese ceramic society, 2012, 40(2): 175–185. (in Chinese) |
| [5] |
刘赞群, 邓德华, GeertDe Schutte, 等.
"混凝土硫酸盐结晶破坏"微观分析(Ⅰ)-水泥净浆[J]. 硅酸盐学报, 2012, 40(2): 186–193.
LIU Zanqun, DENG Dehua, Schutter G D, et al. Micro-analysis of "sulfate salt weathering distress on concrete": I. cement paste[J]. Journal of the Chinese Ceramic Society, 2012, 40(2): 186–193. (in Chinese) |
| [6] |
刘赞群, 邓德华, GeertDe Schutter, 等.
"混凝土硫酸盐结晶破坏"微观分析(II)-混凝土[J]. 硅酸盐学报, 2012, 40(5): 631–637.
LIU Zanqun, DENG Dehua, Schutter G D, et al. Micro-analysis of "sulfate salt weathering distress on concrete": II. concrete[J]. Journal of the Chinese Ceramic Society, 2012, 40(5): 631–637. (in Chinese) |
| [7] | Hartell J A, Boyd A J, Ferraro C C. Sulfate Attack on Concrete: Effect of Partial Immersion[J]. Journal of Materials in Civil Engineering, 2011, 23(5): 572–579. DOI:10.1061/(ASCE)MT.1943-5533.0000208 |
| [8] |
李孟, 郭金仓.
固/液界面上腐殖酸吸附机理的探讨[J]. 腐植酸, 2010(4): 83–89.
LI Meng, GUO Jincang. Adsorption mechanism of humic acid on solid/ liquid interface[J]. Humic Acid, 2010(4): 83–89. (in Chinese) |
| [9] |
林智信, 安从俊, 刘义, 等. 物理化学[M]. 武昌: 武汉大学出版社, 2003: 362-370.
LIN Zhixin, AN Congjun, LIU Yi, et al. Physical Chemistry[M]. Wu chang: Wuhan University Press, 2003: 362-370. (in Chinese) |
| [10] |
韩德刚, 高盘良. 化学动力学基础[M]. 北京: 北京大学出版社, 1998: 339-341.
HAN Degang, GAO Panliang. Fundamentals of Chemical Kinetics[M]. Beijing: Peking University Press, 1998: 339-341. (in Chinese) |
| [11] |
董元彦, 李宝华, 路福绥. 物理化学[M]. 北京: 科学出版社, 2004: 221-223.
DONG Yuanyan, LI Baohuan, LU Fusui. Physical Chemistry[M]. Beijing: Science Press, 2004: 221-223. (in Chinese) |
| [12] | Fatima T, Arab N, Zemskov E P, et al. Homogenization of a reaction-diffusion system modeling sulfate corrosion of concrete in locally periodic perforated domains[J]. Journal of Engineering Mathematics, 2011, 69(2): 261–276. |
| [13] |
李椿, 章立源, 钱尚武. 热学[M]. 北京: 高等教育出版社, 1992: 45-69.
LI Chun, ZHANG Liyuan, QIAN Shangwu. Thermology[M]. Beijing: Higher Education Press, 1992: 45-69. (in Chinese) |
| [14] |
张柬, 浦海, 张连英.
硫酸盐在混凝土中扩散过程研究[J]. 徐州工程学院学报:自然科学版, 2012, 27(2): 57–62.
ZHANG Jian, PU Hai, ZHANG Lianying. Research on sulfate solution diffusion in concrete[J]. Journal of Xuzhou Institute of Technology: Natural Sciences Edition, 2012, 27(2): 57–62. (in Chinese) |
| [15] |
李汝辉. 传质学基础[M]. 北京: 北京航空学院出版社, 1987: 11-13.
LI Ruhui. Fundamentals of mass transfer theory[M]. Beijing: Beijing aviation institute press, 1987: 11-13. (in Chinese) |
| [16] | Long G C, Xie Y J, Tang X G. Evaluating deterioration of concrete by sulfate attack[J]. Journal of Wuhan University of Technology-Mater. Sci. Ed, 2007, 22(3): 572–576. DOI:10.1007/s11595-006-3572-6 |
| [17] | Long G C, Xie Y J, Deng D H. Deterioration of concrete in railway tunnel suffering from sulfate attack[J]. Journal of Central South University of Technology, 2011, 18(3): 881–888. DOI:10.1007/s11771-011-0777-4 |
| [18] |
肖佳, 邓德华, 张文恩, 等.
硫酸盐侵蚀下石膏形成引起的水泥净浆破坏[J]. 建筑材料学报, 2006, 9(1): 19–23.
XIAO Jia, DENG Dehua, ZHANG Wenen, et al. Formation of gypsum leading to the destruction of cement paste under the external sulfate attacking[J]. Journal of Building Materials, 2006, 9(1): 19–23. (in Chinese) |
| [19] |
梁咏宁, 袁迎曙.
硫酸钠和硫酸镁溶液中混凝土腐蚀破坏的机理[J]. 硅酸盐学报, 2007, 35(4): 504–508.
LIANG Yongning, YUAN Yingshu. Mechanism of Concrete Destruction Under Sodium Sulfate and Magnesium Sulfate Solution[J]. Journal of The Chinese Ceramic Society, 2007, 35(4): 504–508. (in Chinese) |
| [20] | Lee S T. Performance deterioration of Portland cement matrix due to magnesium sulfate attack[J]. Ksce Journal of Civil Engineering, 2007, 11(3): 157–163. DOI:10.1007/BF02823896 |
| [21] |
高原, 张君, 韩宇栋.
干湿交替下混凝土内部相对湿度变化规律[J]. 建筑材料学报, 2013, 16(3): 375–381.
GAO Yuan, ZHANG Jun, HAN Yudong. Experimental study on the internal relative humidity in concrete under dry-wet cycles[J]. Journal of Building Materials, 2013, 16(3): 375–381. (in Chinese) |
| [22] |
庞超明, 徐剑, 王进, 等.
混凝土干湿过程及循环制度的研究[J]. 建筑材料学报, 2013, 16(2): 315–320.
PANG Chaoming, XU Jian, WANG Jin, et al. Investigation of the process and regime of drying and wetting of concrete[J]. Journal of Building Materials, 2013, 16(2): 315–320. (in Chinese) |
| [23] | GAO Rundong, LI Qingbin, ZHAO Shunbo, et al. Deterioration mechanisms of sulfate attack on concrete under alternate action[J]. Journal of Wuhan University of Technology-Mater. Sci. Ed, 2010, 25(2): 355–359. DOI:10.1007/s11595-010-2355-2 |
| [24] | Skaropoulou A, Kakali G, Tsivilis S. A study on thaumasite formof sulfate attack (TSA) using XRD, TG and SEM[J]. Journal of Thermal Analysis and Calorimetry, 2006, 84(1): 135–139. DOI:10.1007/s10973-005-7198-2 |
| [25] |
高润东, 赵顺波, 李庆斌, 等.
干湿循环作用下混凝土硫酸盐侵蚀劣化机理试验研究[J]. 土木工程学报, 2012, 43(2): 48–54.
GAO Rundong, ZHAO Shunbo, LI Qingbin, et al. Experimental study of the deterioration mechanism of concrete under sulfate attack in wet-dry cycles[J]. China Ccivil Engineering Journal, 2012, 43(2): 48–54. (in Chinese) |
| [26] |
石明霞, 谢友均, 刘宝举.
水泥粉煤灰复合胶凝材料抗硫酸盐结晶侵蚀性[J]. 建筑材料学报, 2003, 6(4): 350–355.
SHI Mingxia, XIE Youjun, LIU Baoju. Resistance to sulfate salt crystallization of cement pastes containing ultra-fine flyash[J]. Journal of Building Materials, 2003, 6(4): 350–355. (in Chinese) |
| [27] |
方祥位, 申春妮, 杨德斌, 等.
混凝土硫酸盐侵蚀速度影响因素研究[J]. 建筑材料学报, 2007, 10(1): 89–96.
FANG Xiangwei, SHEN Chunni, YANG Debin, et al. Investigations of influence factor on the rate of concrete sulfate attack[J]. Journal of Building Materials, 2007, 10(1): 89–96. (in Chinese) |
| [28] | Bassuoni M T, Nehdi M L. Durability of self-consolidating concrete to different exposure regimes of sodium sulfate attack[J]. Materials and Structures, 2009, 42(8): 1039–1057. DOI:10.1617/s11527-008-9442-2 |
| [29] | Shazali M A, Baluch M H, Al-Gadhib A H. Predicting residual strength in unsaturated concrete exposed to sulfate attack[J]. Journal of Materials in Civil Engineering, 2006, 18(3): 343–354. DOI:10.1061/(ASCE)0899-1561(2006)18:3(343) |
| [30] | Güneyisi E, Gesoĝlu M, Mermerdaş K. Strength deterioration of Plain and metakaolin concretes in aggressive sulfate environments[J]. Journal of Materials in Civil Engineering, 2010, 22(4): 403–407. DOI:10.1061/(ASCE)MT.1943-5533.0000034 |
| [31] | Marchand J, Samson E, Maltais Y, et al. Predicting the performance of concrete structures exposed to chemically aggressive environment-Field validation[J]. Materials and Structures, 2002, 35(10): 623–631. DOI:10.1007/BF02480355 |
 2015, Vol. 38
2015, Vol. 38

