在煤矿开采和煤炭储运过程中,煤自燃现象频发,不仅造成了大量人员财产损失,也对自然环境产生巨大的影响。为减少损失,探究煤自燃的反应机理,国内外学者做了大量的研究[1-5],表明煤自燃主要是由于低温阶段煤表面官能团与氧气的反应所引起。
一般认为煤自燃全过程分为3个阶段:潜伏期,自热期和燃烧期。在潜伏期煤体积聚热量,温度上升缓慢,进入自热期后温度已经不可控制,迅速升高,很快达到煤的燃点进入燃烧期。煤自燃临界点主要指潜伏期进入自热期的温度点,该温度点对预测煤自燃发火期,改善中国煤矿安全具有重大意义[6]。但是目前对于煤自燃临界温度的确定并没有一个权威的方法。各学者对煤自燃临界温度的研究主要通过煤自燃过程中的宏观现象如升温速率、耗氧速率和指标气体的变化等方法来确定煤自燃临界温度点,如戴广龙等[7]通过绝热低温自热氧化试验方法发现煤样温度大于80 ℃后自热速率突然增大;Zhu等[8]对不同温度段煤自燃的特征温度和耗氧速率的变化进行了研究,发现在150 ℃左右耗氧速率变化明显;Wang等[9]通过煤热分解实验,通过实验产物确定分解门槛温度是50~70 ℃;邬剑明等[10]用程序升温法测得指标性气体CO产生的临界温度是60~70 ℃。以上学者通过煤自燃的宏观现象发生突变得到煤自燃临界温度,但是煤的自燃临界温度属于煤的内在特性,所得出的临界温度不能反映自燃反应内在机理。而且以上临界温度得出主要通过在图中直接用作图法确定[11-12],受主观影响大,因此临界点误差也较大。
通过煤绝热氧化实验,得出煤自然属性动力参数活化能E的计算图来反映煤自燃低温氧化内在反应特征,然后利用回归分析中F检验来确定临界温度,避免了以上不足,对完善煤自燃理论和矿区防灭火管理具有一定的参考价值。
1 活化能计算理论原理假设不考虑煤低温氧化反应向环境散发的热量,煤自燃过程动力学方程可以简化为绝热氧化动力学方程[13-15],即
| $ c\partial T/\partial t=QA\ \ {\rm{exp}}\left[-E/\left( RT \right) \right], $ | (1) |
式中:c为比热容,J/(kg·K);T为温度,K;t为时间,s;Q为标准状态下单位质量的氧化热,kJ/kg;A为指前因子,1/s;E为活化能,kJ/mol;R为气体普适常数,8.314 kJ/(K·mol)。
对式(1)两边取自然对数并整理得
| $ \rm{Ln}(\rm{d}\mathit{T}/\rm{d}\mathit{t})=\rm{Ln}\left( \mathit{QA}/\mathit{c} \right)-\mathit{E}/\left( \mathit{RT} \right), $ | (2) |
进而化简为
| $ \rm{Ln}(\rm{d}\mathit{T}/\rm{d}\mathit{t})=-\mathit{E}/\left( \mathit{RT}\right)+\mathit{B}。$ | (3) |
从式(3)不难看出,B为常数,所以活化能E是以-1/(RT)为横坐标,Ln(dT/dt)为纵坐标作图所得直线的斜率。
2 煤绝热氧化实验 2.1 实验装置模拟煤自燃实验过程应尽可能消除外界环境的影响,使煤体仅依靠自身低温氧化产生的热量致其温度不断上升,以此来研究煤自燃过程。本实验采用的绝热实验装置见图 1所示, 由预热管、绝热反应器皿、程序控制温度箱、温度控制系统和计算机数据采集统组成。
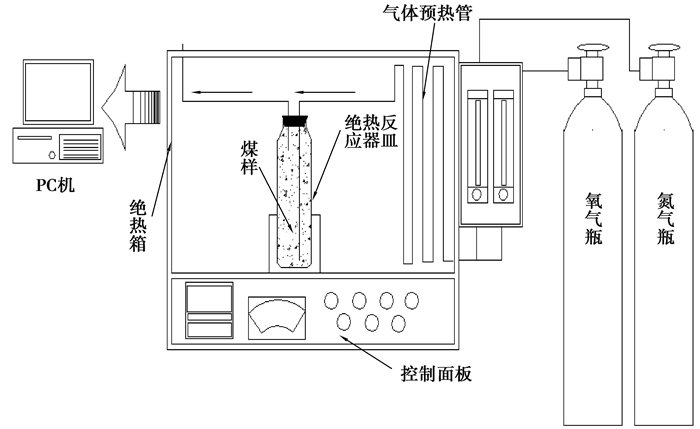
|
图 1 绝热氧化反应装置示意图 Figure 1 Schematic of adiabatic oxidation reactivity apparatus |
为实现绝热环境,实验装置使用绝热性煤样罐作为煤低温氧化反应器,绝热罐为双层石英玻璃构造,内外表面光洁镀银防止辐射,减少热量损失。同时通过温度控制,绝热箱体内部环境温度始终跟踪煤样内的温度而上升,使煤低温氧化系统与环境之间温度差值尽可能小,从而使煤低温氧化产生的热量尽可能不向环境散失。并且采用预热气路,进入煤样罐内的气体先经过炉膛内的长钢管进行预热,使进入煤样的气体与煤样温度一样,避免气体流动产生热损失。通过采取绝热措施,煤低温氧化过程向散失的热量就可以忽略,保证煤绝热氧化实验实现。
2.2 实验过程为防止煤样氧化影响实验结果,所有的煤样从工作面现场取出后立即用保鲜膜包裹,然后用锡箔脂包裹,最后用胶带缠裹。煤样包装完毕后立即放入冰箱,运送到实验室后立即转移到实验室冰箱里面保存。
本次实验选取5种自燃倾向较大的烟煤和褐煤做为实验煤样,编号为1-5号,其中1-2号为高灰分烟煤,3-5号为褐煤。表 1为工业分析的结果。
| 表 1 煤样工业分析 Table 1 Element analysis of coal samples |
将150 g实验煤样(约200目)在氮气保护的环境下加热至105~110 ℃进行干燥,保持16 h,确保煤样完全干燥,以消除水分的影响[15]。等待煤样温度稳定在40 ℃后,立即将煤样送入绝热反应器皿,并将绝热箱调至监控模式(该模式能够跟踪煤样氧化反应的温度变化),同时通入恒定流量的氧气(50 mL/min)。计算机将记录并保存煤样温度随时间的变化数据。当温度达到180 ℃时,绝热箱将自动关闭,同时停止氧气的供给,实验结束。
3 实验结果分析 3.1 绝热氧化升温数据分析图 2所示为5种煤样的升温曲线,由图可以发现:1)任一实验中,在绝热反应前期,煤样升温速率较为稳定;随温度升高,升温速率会迅速增大,可以推测此后较短时间内便可达到燃点;2)由于煤样内在属性的差异性,各煤样发生温度突变的范围不同,所以针对不同煤样的储存管理应该区别对待。以上都说明临界温度点的判定具有重要意义。
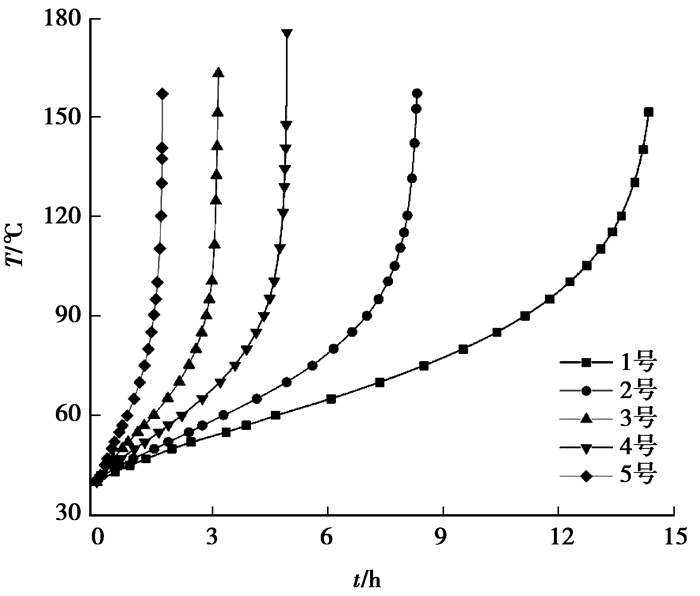
|
图 2 煤自热升温曲线 Figure 2 Relation curves of time and temperature |
澳大利亚采用R70值来鉴定煤的自燃倾向性[14],R70(℃/h)为40~70 ℃阶段升温速率,该判别方法已经过工程实践检验,大多数情况下R70与煤自燃倾向性具有高度的一致性。表 2为5种煤样的R70值。由此法所得煤自燃倾向性为:5号煤样>3号煤样>4号煤样>2号煤样>1号煤样。
| 表 2 各煤样R70值 Table 2 R70 of coal samples |
将实验所测数据,以-1/(RT)为横坐标,ln(dT/dt)为纵坐标作图,其斜率即为活化能。需要说明煤低温氧化反应并非基元反应,而是一个复杂的总包反应过程[13]。因而所求得的活化能为总包反应的表观活化能,并没有实际的物理意义,在此用来反映氧化过程的内在能量的变化特征。
为更客观反映煤低温氧化过程中的反应特征,所以选取固定时间段来计算其对应活化能。在此以20 min为间隔时间段。由于各煤样在规律性上具有内在的一致性,故活化能计算图以自燃倾向性居中的4号煤样为例。
由于实验时间过长:在几小时到十几小时不等,故在此选取计算过程的典型图样来反映绝热氧化主要特征变化。图 3为活化能计算过程的代表图,图 3(a)、图 3(b)和图 3(c)分别为实验0~20 min,40~60 min和140~160 min活化能计算图。可以发现(a)中活化能计算点大致落在一条直线附近;随着反应的进行点逐渐分散,(b)中计算点已经杂乱无章,离散性很大;此后计算点又逐渐趋于一条直线如图 3(c)。
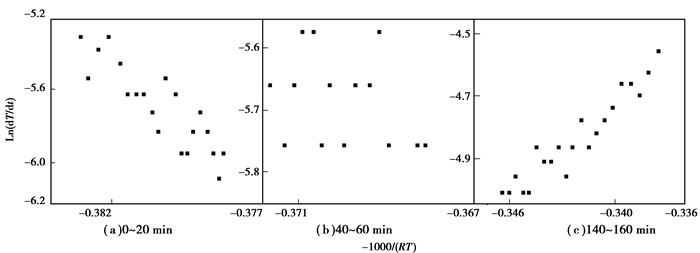
|
图 3 4号煤样活化能计算图 Figure 3 The relation of Ln(dT/dt) and-1000/(RT) |
煤低温氧化中包括物理吸附氧、官能团不稳定反应阶段和官能团稳定反应3个过程[16],与图 3有良好的对应关系。所以(a)中对应的反应过程是物理吸附,图中点相对连续,说明在煤自燃的起始阶段物理吸附为主,其他反应还不明显。同时由于吸附反应并不稳定,因此没有严格在一条直线上。将图中的点拟合成一条直线,所得斜率为此时间段表观活化能。表 3为各煤样反应前20 min活化能,发现此阶段表观活化能较低,且为负数,表明煤自燃氧化反应的开始阶段所需能量较低,反应容易发生,如若此时放出的热量积聚将为后续反应的发生提供能量[17],这是煤自燃能够自发开始的根本原因。
| 表 3 各煤样开始20 min活化能 Table 3 The activation energy of coal samples in initial 20 minutes |
随着能量的积累,煤表面官能团结构[9, 14, 18-21]被激活参与反应。由于煤表面官能团复杂性,至今已经有超过130种煤结构模型被学者提出[22],煤的微观反应过程更是没有一个统一模型。目前已被证实的有,在化学反应中首先形成不稳定中间产物如过氧化物(—OO—)、过氧化氢物(—O—OH)和羟基官能团(—OH)。然后这些不稳定的中间产物被分解,并形成稳定的官能团,如羰基(—C=O)和羧基(—COOH)等,这些官能团可以生产CO2和CO等,以及新的自由基来重复上述反应。可知内在化学反应是由不稳定到稳定发生的过程。
图 3(b)和图 3(c)分别表示官能团反应由不稳定到稳定的过程。由于官能团被激活的时间不一致和基团氧化反应的不稳定性,表现在图中就是点的极度混乱,如(b),说明煤低温氧化过程的复杂性与不确定性。此后随着反应进行,反应逐渐稳定,后续时间段活化能计算图中的点逐渐由混乱到逐渐趋于一条直线,如(c)。
由于煤自燃反应的复杂性,对于具体某个链式反应虽然可以明确分为几步,但是在某一时刻其实各步都有发生。所以从微观反应来进行判定临界点难度很大。活化能计算图避免了直接从反应过程判定,同时结合煤自燃低温氧化内在反应特征,与微观过程相对应,这为判定临界点提供了依据。
图 4为各煤样在绝热反应的最后20 min活化能计算图。各煤样计算图中的点已基本在一条直线上,且用直线拟合后拟合度都大于0.9。表明此时间段官能团的反应已经相对稳定。表 4为各典型煤样本次实验最后20 min的活化能值。各煤样活化能值差异并不大,集中在55~70 kJ/mol。图 4中各煤样计算点组成的直线近似相平行,推测各煤样低温氧化的后期阶段主导反应相近。
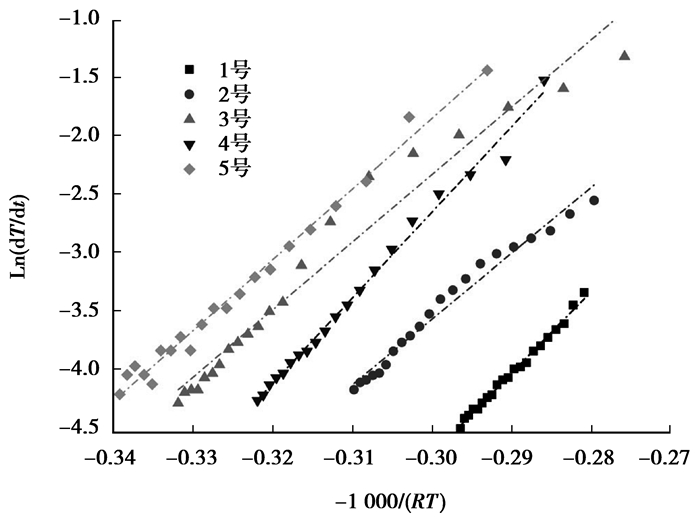
|
图 4 各煤样最后20 min活化能计算图 Figure 4 The relation of Ln(dT/dt) and-1000/(RT) last 20 minutes |
| 表 4 各煤样最后20 min活化能 Table 4 The activation energy of coal samples in last 20 minutes |
图 5为各煤样在实验过程的活化能变化图。因为各煤样完成实验所用时间不同,将活化能对应时间进行归一化处理,即对应时间段与该煤样完成实验的总时间之比作为横坐标,用0-1表示实验全过程。从图中可以看出各煤样在以负活化能开始反应后,在低温氧化前期活化能波动很大,随着反应进行活化能逐渐稳定并趋于一致,与前面分析相符。通过比较煤自燃的倾向性,发现自燃倾向性低的1-2号煤样在反应中活化能波动范围更大,更晚的进入到稳定阶段,说明不易自燃煤样低温氧化过程更复杂。
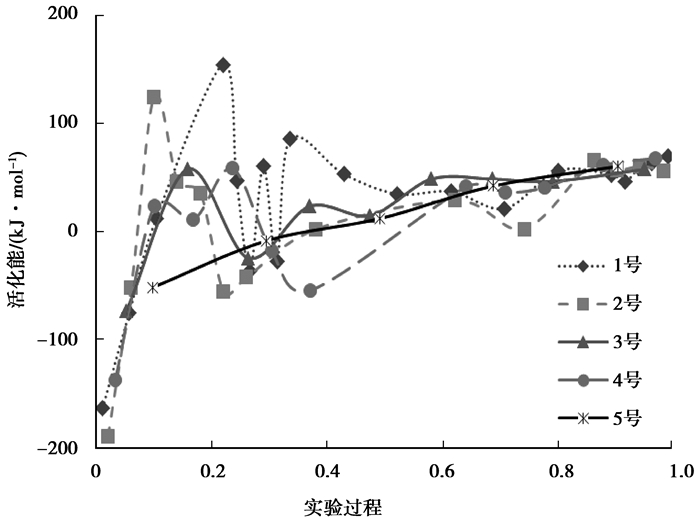
|
图 5 煤样全过程活化能变化 Figure 5 Activation energy of the whole process |
煤低温氧化总体上是由氧化反应的不稳定到相对稳定的过程,表现在活化能计算图中为各计算点由杂乱无章到趋于一条直线,期间必有一个过渡。但是煤低温氧化是一个非线性的连续反应过程,倘若直接找临界点必然十分困难,误差较大。采用对-1 000/(RT)和Ln(dT/dt)的实验数据关系建立线性回归模型,并对其线性关系进行显著性检验来找临界点。
令-1 000/(RT)为x,Ln(dT/dt)为y,构成数据(xi,yi)。可以假设-1 000/(RT)与Ln(dT/dt)满足如下的线性模型[23]
| $ y={{\beta }_{0}}+{{\beta }_{1}}x+\varepsilon, $ | (4) |
式中:β0截距;β1为回归系数;ε为随机误差。
对后20 min的x与y是否存在线性关系显著性进行检验。提出检验假设:原假设H0:β1=0,备择假设H1:β1≠0。如果样本数据推断得出拒绝原假设,采纳备择假设即x与y存在线性关系,表明反应处于相对稳定阶段,反之相反。具体过程为
构造统计量F
| $ F=\frac{S_{R}^{2}~}{S_{E}^{2}/\left( n-2 \right)}, $ | (5) |
式中:SR为回归模型的回归平方和;SE为残差平方和,n为样本量。
将公式展开,F的具体为表达式为
| $ F=\frac{{{\left( \sum\limits_{i=1}^{n}{{{x}_{i}}{{y}_{i}}-n\overline{xy}} \right)}^{2}}}{\left( \sum\limits_{i=1}^{n}{x_{i}^{2}-n{{\overline{x}}^{2}}} \right)\left( \sum\limits_{i=1}^{n}{y_{i}^{2}-n{{\overline{y}}^{2}}} \right)-{{\left( \sum\limits_{i=1}^{n}{{{x}_{i}}{{y}_{i}}-n\overline{xy}} \right)}^{2}}}, $ | (6) |
式中
所构造的F统计量服从F(1,n-2)分布,将数据带入求得F值。在显著性水平α下,当F大于分位数Fα(1,n-2)时,拒绝原假设H0,即认为各数据点满足线性关系。一般认为α大于0.01时有较强的判定性,故显著性水平定为0.01。对各煤样的每分钟以后20 min的-1 000/(RT)和Ln(dT/dt)数据关系进行检验,直到某时间点后所有20 min时间段的数据都通过检验,表明-1 000/(RT)和Ln(dT/dt)进入直线段。并将该时间点对应的温度点规定为临界温度,用Tc表示,其物理意义为煤低温氧化反应由不稳定过渡到了相对稳定阶段。
5 计算结果及分析用Spss软件中回归线分析中统计量p值来完成以上检验。其中p值为求得的F值发生时对应的概率。当计算得p小于α即0.01时表示具有线性关系。表 5为用该模型所求得临界点(取整)。
| 表 5 各煤样临界点 Table 5 Critical point temperature of coal samples |
将求得临界温度与图 2对比,各煤样Tc都恰好位于稳定升温到急速升温的过渡范围内,符合对临界温度的定义[12, 24],表明所建立模型是准确的。
将实验中温度达到160 ℃所需要的时间用t0来表示,建立t0与Tc关系,如图 6所示。两者之间有良好的对应关系,间接反映模型的准确性。图 6表明临界点温度越高,煤自燃潜伏期越长,煤自燃的风险也越低。Tc与t0自发呈线性关系,拟合关系为:Tc=3.45t0+56.68。因此可以用绝热氧化实验测得t0即可预测不同煤样的临界温度Tc,简化确定临界点的过程,为防灭火管理提供参考。
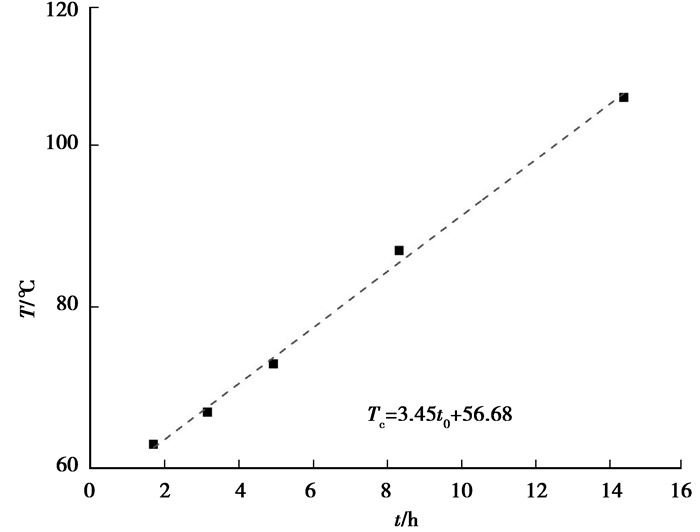
|
图 6 Tc与t0关系 Figure 6 The relationship of Tc and t0 |
通过绝热氧化实验中活化能指标变化分析了煤低温氧化内在反应过程并得出临界点预测方法,得出以下结论:
1) 活化能计算图可以反映煤低温氧化的内在反应特征:煤自燃过程由物理吸附氧引发,后续的化学反应是由前期的极度不稳定过渡到相对稳定的过程,期间活化能由变化极大到相对稳定并趋于一致;自燃倾向较低的煤样,活化能波动范围更大。
2) 在低温氧化后期,所求活化能都在55~70 kJ/mol范围内,表明反应后期主导反应相近。
3) 用线性显著性检验中F检验确定的临界点Tc,该方法结合了煤自燃宏微观特性,且Tc与升温突变范围有良好的符合性,表明模型的准确性。
4) Tc与t0有良好的线性对应关系,可以用绝热氧化实验测得t0来预测煤自燃临界点,简化临界点确定过程,为矿区防灭火和煤炭储运管理提供预警。
| [1] |
徐精彩. 煤自燃危险区域判定理论[M]. 北京: 煤炭工业出版社, 2001.
XU Jingcai. Determination theory of coal spontaneous combustion zone[M]. Beijing: China Coal Industry Publishing House, 2001. (in Chinese) |
| [2] | Ran V K S. Spontaneous heating and fire in coal mines[J]. Procedia Engineering, 2013, 62: 78–90. DOI:10.1016/j.proeng.2013.08.046 |
| [3] | Kam A Y, Hixson A N, Perlmutter D D, et al. The oxidation of bituminous coal-I development of a mathematical model[J]. Chemistry Engineer Science, 1976, 31(9): 815–819. DOI:10.1016/0009-2509(76)80055-3 |
| [4] | Marinov V N. Self-ignition and mechanisms of interaction of coal with oxygen at low temperatures, changes in weight and thermal effects on gradual heating of coal in air in the range 20-300℃[J]. Fuel, 1977, 56(2): 158–164. DOI:10.1016/0016-2361(77)90137-5 |
| [5] | Zhang Y L, Wu J M, Chang L P, et al. Changes in the reaction regime during low-temperature oxidation of coal in confined spaces[J]. Journal of Loss Prevention in the Process Industries, 2013, 26: 1221–1229. DOI:10.1016/j.jlp.2013.05.008 |
| [6] |
李林, BeamishB B, 姜德义.
煤自然活化反应理论[J]. 煤炭学报, 2009, 34(4): 505–508.
LI Lin, Beamish B B, JIANG Deyi. Self-activation theory of spontaneous combustion of coal[J]. Journal of China Coal Society, 2009, 34(4): 505–508. (in Chinese) |
| [7] |
戴广龙, 王德明, 陆伟, 等.
煤的绝热低温自热氧化试验研究[J]. 辽宁工程技术大学学报, 2005, 24(4): 485–488.
DAI Guanglong, WANG Deming, LU Wei, et al. Adiabatic study on low-temperature self-heating oxidation of coal[J]. Journal of Liaoning Technical University, 2005, 24(4): 485–488. (in Chinese) |
| [8] | Zhu J F, He N, Li D J. The relationship between oxygen consumption rate and temperature during coal spontaneous combustion[J]. Safety Science, 2012, 50: 842–845. DOI:10.1016/j.ssci.2011.08.023 |
| [9] | Wang H, Dlugogorski B Z, Kennedy E M. Analysis of the mechanism of the low temperature oxidation of coal[J]. Combustion and Flame, 2003, 134: 107–117. DOI:10.1016/S0010-2180(03)00086-5 |
| [10] |
邬剑明, 彭举, 吴玉国.
平朔矿区煤自然发火指标气体选择的试验研究[J]. 煤炭科学技术, 2012, 40(2): 67–69.
WU Jianming, PENG Ju, WU Yuguo. Experiment study on index gas selection of coal spontaneous combustion in Pingshuo mining area[J]. Coal Science and Technology, 2012, 40(2): 67–69. (in Chinese) |
| [11] |
谭波, 朱红青, 王海燕, 等.
煤自燃绝热氧化阶段特征及临界点预测模型[J]. 煤炭学报, 2013, 38(1): 38–43.
TAN Bo, ZHU Hongqing, WANG Haiyan, et al. Prediction model of coal spontaneous combustion critical point and the characteristics of adiabatic oxidation phase[J]. Journal of China Coal Society, 2013, 38(1): 38–43. (in Chinese) |
| [12] |
仲晓星, 王德明, 尹晓丹, 等.
基于程序升温的煤自燃临界温度测试方法[J]. 煤炭学报, 2010, 35(8): 128–131.
ZHONG Xiaoxing, WANG Deming, YIN Xiaodan, et al. Test method of critical temperature of coal spontaneous combustion based on the temperature programmed experiment[J]. Journal of China Coal Society, 2010, 35(8): 128–131. (in Chinese) |
| [13] | Chen X D, Chong L V. Some characteristics of transient self-heating in an exothermically reactive porous solid slab[J]. Trans. Ⅰ Chem E 73(Part B), 1995: 101–107. |
| [14] | Barnabe N J, Edwin v S, James A, et al. Estimating activation energy from a sulfide selfheating test[J]. Minerals Engineering, 2011, 24(15): 1645–1650. DOI:10.1016/j.mineng.2011.08.019 |
| [15] |
陆伟, 王德明, 仲晓星, 等.
基于活化能的煤自燃倾向性研究[J]. 中国矿业大学学报, 2006, 35(3): 201–205.
LU Wei, WANG Deming, ZHONG Xiaoxing. Tendency of spontaneous combustion of coal based on activation energy[J]. Journal of China University of Mining&Technology, 2006, 35(3): 201–205. (in Chinese) |
| [16] | Yuan L M, Alex C. CO and CO2 emissions from spontaneous heating of coal under different ventilation rates[J]. International Journal of Coal Geology, 88(2011): 24–30. |
| [17] |
屈丽娜. 煤自燃阶段特征及其临界点变化规律的研究[D]. 北京: 中国矿业大学(北京), 2013. QU Lina. The study on the characteristics of coal stage and the critical point variation of the spontaneous combustion[D].Beijing:China University of Mining and Technology(Beijing), 2013.(in Chinese) http://cdmd.cnki.com.cn/Article/CDMD-11413-1013292910.htm |
| [18] |
李林, 姜德义, BeamishB B.
基于绝热实验活化能解算自然发火期[J]. 煤炭学报, 2010, 35(5): 802–805.
LI Lin, JIANG Deyi, Beamish B B. Calculation of ignition times under adiabatic conditions by activation energy[J]. Journal of China Coal Society, 2010, 35(5): 802–805. (in Chinese) |
| [19] | Shi T. The mechanism at the initial stage of the room-temperature oxidation of coal[J]. Combustion and Flame, 2005, 140(4): 332–345. DOI:10.1016/j.combustflame.2004.10.012 |
| [20] | Wang H, Dlugogorski B Z, Kennedy E M, et al. Coal oxidation at low temperatures:Oxygen consumption, oxidation products, reaction mechanism and kinetic modelling[J]. Program Energy Combustion Science, 2003, 29: 487. DOI:10.1016/S0360-1285(03)00042-X |
| [21] |
王德明, 辛海会, 戚绪尧, 等.
煤自燃中的各种基元反应及相互关系:煤氧化动力学理论及应用[J]. 煤炭学报, 2014, 39(8): 1667–1674.
WANG Deming, XIN Haihui, QI Xuyao, et al. Mechanism and relationships of elementary reactions in spontaneous combustion of coal:The coal oxidation kinetics theory and application[J]. Journal of China Coal Society, 2014, 39(8): 1667–1674. (in Chinese) |
| [22] | Zhan J H, Wu R C, Liu X X, et al. Preliminary understanding of initial reaction process for subbituminous coal pyrolysis with molecular dynamics simulation[J]. Fuel, 2014, 134: 283–292. DOI:10.1016/j.fuel.2014.06.005 |
| [23] |
王黎明, 陈颖, 杨楠. 应用回归分析[M]. 上海: 复旦大学出版社, 2008.
WANG Liming, CHEN Ying, YANG Nan. Application regression analysis[M]. Shanghai: Fudan University Press, 2008. (in Chinese) |
| [24] |
王兰云, 蒋曙光, 邵昊, 等.
煤自燃过程中自氧化加速温度研究[J]. 煤炭学报, 2011, 36(6): 989–992.
WANG Lanyun, JIANG Shuguang, SHAO Hao, et al. Self accelerating oxidation temperature during the spontaneous combustion of coal[J]. Journal of China Coal Society, 2011, 36(6): 989–992. (in Chinese) |
 2017, Vol. 40
2017, Vol. 40

