2. 鄂州汉衍新材料公司, 湖北 鄂州 436000
2. Ezhou Han Yan New Materials Company, Ezhou 436000, Hubei, P. R. China
近年来,随着科技的发展,传统的工业纯铁、雾化铁粉等纯度及性能已经无法满足各种高新产业的需求。而高纯电解铁不仅具有良好的延展性,还具有很好的软磁性能、导电性能、热性能和耐腐蚀性能等。超高纯电解铁更是很难被盐酸和硫酸腐蚀,且超高纯电解铁具有硬度大和韧性好等独特性能[1]。因此,以低成本湿法冶金制备高纯铁的研究越来越受到人们的广泛关注[3-4]。高纯铁主要被应用于原子工业、军工用品以及高张力合金零部件的加工等。
如今,高纯铁的制备技术层出不穷[5-7]。在高纯铁制备过程中,一般要先对原料进行溶液萃取、离子交换等除杂操作,然后再进行电解制取高纯铁粉,后续还可以通过区域熔炼进一步对电解铁提纯。在以往的文献中[8-16],利用上述方法制备电解铁时,阳极所使用的材料均为惰性电极或废弃铁屑,通过电解在阴极板析出纯铁。由于考虑到阳极板使用工业纯铁板时,可减少阳极中Fe3+的产生及外来杂质的影响,因此,使用工业纯铁取代惰性阳极进行电解精炼。运用工业纯铁作为阳极电解精炼制备高纯铁不仅能很大程度上简化操作,节约成本,还有利于进行工业化生产。因此,研究如何使用纯铁作为阳极板,高效的电解制备出高纯铁越来越重要。考虑到在实际生产过程中,诸多电解因素[13, 14, 16]会对电沉积速率、电流效率以及电解铁性能有很大影响。因此,实验需研究出最佳因素组合方案使满足在提高生产效率、节约生产成本的同时能生产出性能优良的高纯铁。此外,由于电解铁中杂质元素对其各种性能影响明显[17-21],实验还对电解铁杂质进行分析和除杂。实验运用正交设计来确定其最佳因素组合方式,使用ICP-AES及SEM对电解铁进行纯度分析,后续还对主要杂质氧、硫的存在形式进行了分析研究[22-23]。
1 实验材料及方法 1.1 正交实验为了电解出形貌和性能优良的纯铁产品,提高电解纯铁的生产效率和降低生产成本。实验考虑到电流密度、温度、Fe2+离子浓度以及溶液pH值都会影响电解铁的电解过程,因此,以电流效率、电沉积速率和电解铁外观作为实验结果指标,采用L18(37)正交表进行正交实验,分析各因素对电解铁的影响程度大小,并确定电解铁的最佳电解因素组合方式[9]。
1.1.1 实验材料实验电解液成分及电解条件见表 1,本实验所使用的Fe2+溶液是利用分析纯绿矾来配制含Fe2+浓度为30、50、70 g/L的电解液,溶剂选择二次去离子水。添加辅助电解质(NH4)2SO4的浓度为0.5 mol/L,用经稀释过的氨水和稀硫酸来调节溶液pH值。实验所用阴极为高度抛光后的不锈钢,阳极为工业纯铁,成分如表 2所示。实验电源由直流稳压稳流整流器提供,温度使用数显恒温水浴干锅HH-2型来控制[8]。
| 表 1 电解液成分及电解条件 Table 1 Electrolyte composition and electrolysis conditions |
| 表 2 太钢纯铁板成分 Table 2 TISCO pure iron composition |
由于研究的是多因素多水平实验,为了用最少的实验次数得出最佳试验方案,实验选择正交试验设计法进行研究。根据正交实验所需,对电流密度、温度、pH值和Fe2+浓度4个因素,每个因素分3个水平进行正交实验[25]。正交实验因素水平表如表 3所示。
| 表 3 正交实验水平因素表 Table 3 Orthogonal experiment level factor table |
从因素水平表可知,该试验为4因素3水平,应选择L18(37)正交表。
1.2 电解铁纯度的分析实验电解铁经洗涤,真空干燥等处理后,用ICP-AES检测其中的Si、Mn、P、S、Cu、Cr、Ni、Al等杂质元素含量,而电解铁中C、H、O等主要杂质元素分别用化学吸附、真空加热及退火还原来测量。
1.3 电解铁杂质的研究实验为了进一步提高电解铁的纯度,对电解铁进行了SEM能谱分析,研究了电解铁中主要杂质元素硫和氧的存在形式。结合电解实际条件,对电解铁进行氢还原实验,检测还原前后氧元素含量变化并结合能谱图来分析其中氧元素的存在形式。由于电解铁为多孔材料,实验电解体系中电解质主要为FeSO4,硫元素只会以硫酸根的形式存在。实验为了验证电解铁中硫元素主要是以FeSO4形式存在电解铁孔隙中,以在最佳实验组合条件下电解得到的铁片为试样,在800 ℃温度下通入H2还原90 min后,将其编号1~6个试样,取每个试样1 kg,在超声波条件下用蒸馏水配制的0.1 mol/L氢氧化钠溶液中浸泡3天,检测浸泡后溶液中硫酸根的含量。
2 结果与讨论 2.1 正交实验结果实验根据选择的L18(37)正交表进行了试验,得出各因素不同水平组合方式下的电沉积速率及电流效率结果见表 4,其中A、B、C、D分别表示Fe2+浓度、pH值、温度以及电流密度4个因素的水平效应,空白列5、6、7表示的是实验随机误差。
| 表 4 实验正交表 Table 4 Experimental orthogonal table |
其中,实验性能指标如下:
电沉积速率v=m/t,其中m为阴极板电解铁的质量(g),t为电解时间(h)。
电流效率η=m/m0×100%=mzF/ItM×100%,其中m为阴极板电解铁的质量(g),m0为按法拉第定律计算阴极板理论电解铁质量,z为电极反应转移电子数,F为法拉第常数(取96 500 C/mol),M为阴极所得金属的原子量,I为通电电流(A)。
2.1.1 各因素对电沉积速率的影响实验为了直观分析上述表 4的实验结果,计算电沉积速率各因素不同水平下的Ⅰj、Ⅱj、Ⅲj值,如表 5所示,其中S1-S4所表示的偏差平方和是各因素的效应平方和,而没有排列因素的S5-S7列表示的是随机误差引起的效应。
| 表 5 电沉积速率数据分析表 Table 5 Electrodeposition rate data analysis table |
为了进一步研究各因素对电沉积速率的影响规律,实验求出各因素的算术平均值,记为A1=IA/6=1.019,A2=1.116,A3=1.042;同理可求出:B1=1.025,B2=1.109,B3=1.043;C1=1.090,C2=1.083,C3=1.005;D1=0.523,D2=1.033,D3=1.622.实验数据统计如图 1所示。
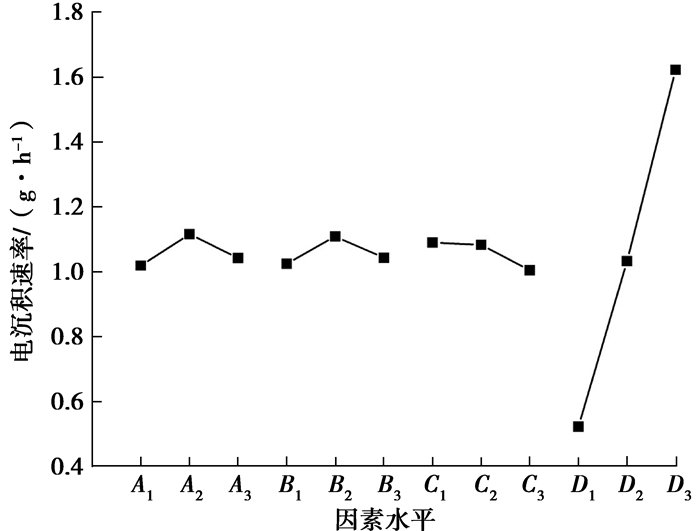
|
图 1 各因素对电沉积速率的影响 Figure 1 Effect of various factors on electrodeposition rate |
从图 1可知:
1) Fe2+浓度:电沉积速率随Fe2+浓度的增加先增加后减少,且波动范围不大。这是由于在电解过程中,Fe2+浓度需要维持在一定的浓度下,较高的浓度容易造成Fe2+的结晶析出且Fe2+在溶液中及表面附近容易被氧化形成氧化物,影响Fe2+在阴极板上的析出;浓度过低容易出现较大的极化,阴极得到的产品表面质量差,容易出现海绵状产品,甚至是晶粒细小的粉末。因本实验阳极使用纯铁板电解,能源源不断地向电解液中提供Fe2+,因此,本实验中Fe2+浓度为50 g/L左右时,电沉积速率达到最大值。
2) pH值:电沉积速率随pH值的升高先增大后减少。当pH值较低时,溶液中H+会在阴极板大量放电产生H2,在影响电解速率的同时也会使电解铁出现氢脆。溶液pH值过高时,溶液中会形成Fe(OH)3,甚至有Fe(OH)2的产生,这些胶状物会富集在阴极板周围,妨碍了电解铁的正常析出。具体Fe2+、Fe3+开始水解pH值如下:
| $ {\rm{F}}{{\rm{e}}^{{\rm{2 + }}}}{\rm{ + 2}}{{\rm{H}}_{\rm{2}}}{\rm{O = Fe}}{\left( {{\rm{OH}}} \right)_{\rm{2}}}{\rm{ + 2}}{{\rm{H}}^{\rm{ + }}}{\rm{, pH = 5}} \sim {\rm{6}}; $ | (1) |
| $ {\rm{F}}{{\rm{e}}^{{\rm{3 + }}}}{\rm{ + 3}}{{\rm{H}}_{\rm{2}}}{\rm{O = Fe}}{\left( {{\rm{OH}}} \right)_{\rm{3}}}{\rm{ + 3}}{{\rm{H}}^{\rm{ + }}}{\rm{, pH = 2}} \sim {\rm{3}}。$ | (2) |
又因本实验以纯铁板为阳极,阳极板主要是进行反应(4),因此,大大减少了电解过程中Fe3+的产生,且实验电解液表面被有机油覆盖,减弱了Fe2+的氧化。因此,实验过程中适当增加pH值,电解液中并不会大量产生Fe(OH)3沉淀,相反会急剧减少氢气的产生,进而提高电解沉积速率,本实验最佳pH值在4左右。阳极板具体放电电压如下:
| $ {\rm{F}}{{\rm{e}}^{{\rm{2 + }}}} - \mathit{e}{\rm{ = F}}{{\rm{e}}^{{\rm{3 + }}}}, {\mathit{E}^\mathit{\theta }}{\rm{ = 0}}{\rm{.75V}}; $ | (3) |
| $ {\rm{Fe}} - {\rm{2}}\mathit{e}{\rm{ = F}}{{\rm{e}}^{{\rm{2 + }}}}, {\mathit{E}^\mathit{\theta }}{\rm{ = 0}}{\rm{.44V}}; $ | (4) |
| $ {\rm{4O}}{{\rm{H}}^ - } - {\rm{4}}\mathit{e}{\rm{ = 2}}{{\rm{H}}_{\rm{2}}}{\rm{O + }}{{\rm{O}}_{\rm{2}}}, {\mathit{E}^\mathit{\theta }}{\rm{ = 0}}{\rm{.81V。}} $ | (5) |
3) 温度:电沉积速率随温度的上升而稍显下降。升高温度,电解过程中离子转移速率加快,阴极析出纯铁的同时,氢气产生速率更剧烈;且温度上升会促使Fe2+氧化成Fe3+,减少电解液中Fe2+浓度,因此,常温下更有利于电解铁的析出。
| $ \rm{4F}{{\rm{e}}^{\rm{2+}}}\rm{+4}{{\rm{H}}^{\rm{+}}}\rm{+}{{\rm{O}}_{\rm{2}}}\rightleftharpoons \rm{4F}{{\rm{e}}^{\rm{3+}}}\rm{+2}{{\rm{H}}_{\rm{2}}}\rm{O。} $ | (6) |
4) 电流密度:电沉积速率随电流密度的增加呈直线上升,且增长幅度很大。这是因为在电解过程中,电解密度的增加,电子转移速率大大提高,Fe2+在阴极板沉积速率增大。因此,本实验电流密度为300 A/m2时,电沉积速率最大。
综上可知,电解沉积速率实验最佳组合方案为A2B2C1D3,即Fe2+浓度为50 g/L,pH值为4,电解温度为25 ℃,电流密度为300 A/m2。
为了更好地了解各因素对电解结果是否显著,实验还对上述表 4数据进行方差处理,具体结果如表 6所示。
| 表 6 电沉积速率方差分析表 Table 6 Electrodeposition rate of variance table |
通过方差分析得知:因素A、B、C、D对实验结果都起显著性作用,其中因素D即电流密度起主导作用。对于因素A来讲,由于Ⅱj>Ⅲj>Ⅰj,因此,因素A在第二水平A2时,电沉积速率最大。类似可以分别得知B2、C1、D3,也可以得出实验因素最佳组合方式为A2B2C1D3。
2.1.2 各因素对电流效率的影响为了直观分析上述表 4的实验结果,计算电流效率在各因素不同水平下Ⅰj、Ⅱj、Ⅲj值如表 7所示。同理求出电流效率各因素不同水平下的平均值:
| $ \begin{array}{l} {\mathit{A}_{\rm{1}}}{\rm{ = 0}}{\rm{.819}}, {\mathit{A}_{\rm{2}}}{\rm{ = 0}}{\rm{.881}}, {\mathit{A}_{\rm{3}}}{\rm{ = 0}}{\rm{.821}};{\mathit{B}_{\rm{1}}}{\rm{ = 0}}{\rm{.812}}, {\mathit{B}_{\rm{2}}}{\rm{ = 0}}{\rm{.876}}, {\mathit{B}_{\rm{3}}}{\rm{ = 0}}{\rm{.833}};\\ {\mathit{C}_{\rm{1}}}{\rm{ = 0}}{\rm{.863}}, {\mathit{C}_{\rm{2}}}{\rm{ = 0}}{\rm{.847}}, {\mathit{C}_{\rm{3}}}{\rm{ = 0}}{\rm{.811}};{\mathit{D}_{\rm{1}}}{\rm{ = 0}}{\rm{.834}}, {\mathit{D}_{\rm{2}}}{\rm{ = 0}}{\rm{.825}}, {\mathit{D}_{\rm{3}}}{\rm{ = 0}}{\rm{.863。}} \end{array} $ |
| 表 7 电流效率数据分析表 Table 7 Current density data analysis table |
实验数据统计分析结果如图 2所示。
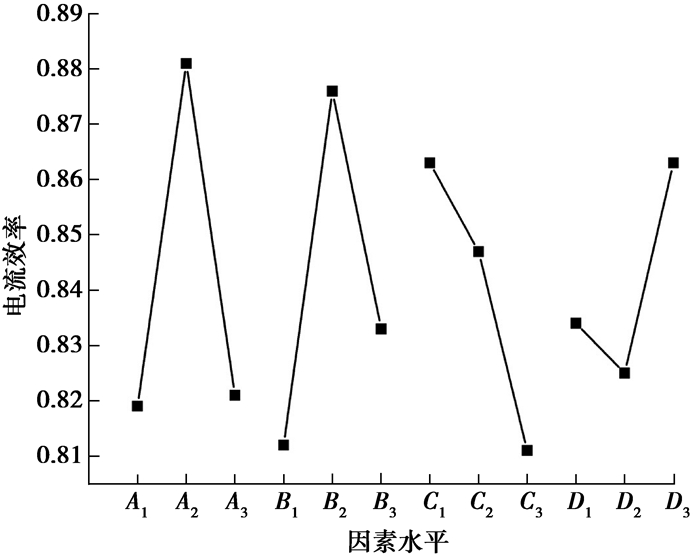
|
图 2 各因素对电流效率的影响 Figure 2 The impact of various factors on the current efficiency |
由图 2可知,实验Fe2+浓度、pH值以及温度对电流效率的影响曲线走势与对电沉积速率影响曲线走势相同。而电流效率随着电流密度的增大先减少后增大,这是因为当电流密度开始增大时,阴极板会有大量氢气析出。当电流密度达到一定值时,阳极纯铁的大量溶解使电解液中Fe2+浓度急剧上升,电解液中c(Fe2+)/c(H+)较大,阴极板中铁的析出能有效抑制氢气的析出。因此,各因素对电流效率影响的最佳实验组合为A2B2C1D3。
通过上表 8可知,除电流密度外,其他3种因素对电流效率的影响都是显著的。
| 表 8 电流效率方差分析表 Table 8 Current density analysis of variance table |
表 9描述了各因素各水平下阴极板镀层的外观。
| 表 9 各因素对电解铁外观的影响 Table 9 The impact of various factors on the appearance of electrolytic iron |
结合图 1、图 2和上表 9可知,Fe2+浓度、pH值对电沉积速率和电流效率的影响都是先增大后减少,且这两种因素中间水平对应下的电解铁外观较好。温度对电沉积速率、电流效率和电解铁外观的影响趋势相同,因此,低温更有利于电解。电流密度越大,电沉积速率和电流效率也近乎随之增大,但是电流密度过大时,所得电解铁的外观较差。图 3为不同电解条件下电解铁片的外观。

|
图 3 阴极板电解铁外观 Figure 3 Cathode plate electrolytic iron appearance (a)Fe2+浓度70 g/L,电解温度55 ℃,pH值为4,电流密度为200 A/m2; (b)Fe2+浓度50 g/L,电解温度25 ℃,pH值为4,电流密度为100 A/m2; (c)Fe2+浓度30 g/L,电解温度55 ℃,pH值为3,电流密度为300 A/m2; (d)Fe2+浓度30 g/L,电解温度85 ℃,pH值为5,电流密度为200 A/m2 |
综合以上各因素对电沉积速率、电流效率以及电解铁外观的影响,分析可确定实验最佳组合因素:Fe2+浓度为50 g/L,电解温度为25 ℃,pH为4.0,电流密度为100 A/m2。在最佳实验方案下,其电沉积速率为0.549 g/h,电流效率达到89.2%,且所得阴极电解铁表面光滑,呈银白色光泽,图 3(b)为其外观图。
2.2 电解铁纯度实验用化学分析法检测了在最佳因素组合下电解纯铁样品(具体电解条件见表 11)中主要杂质元素的含量,结果如表 10所示。
| 表 11 不同电解条件下电解铁的纯度比较 Table 11 Purity comparison of electrolytic iron under different electrolysis conditions |
| 表 10 电解铁中杂质元素的含量 Table 10 Electrolytic iron in the content of impurity elements |
由上表可知,电解铁杂质元素中,金属杂质元素除Al以外,含量都非常低,这些金属杂质主要是以共沉积的方式与亚铁离子共同在阴极板析出[26-27]。而电解铁中主要杂质为C、H、O、Si 4种非金属杂质。试样1中各杂质元素含量明显高于试样2、3,这是因为试样1电解铁电解完成后是用冷水直接清洗;而试样2、3在电解完成后先用热水清洗,然后冷水超声处理,且电解过程中使用隔膜将阴阳极隔开,以防止阳极区中的杂质元素,特别是防止Fe3+形成的胶状物进入阴极区,提高电解铁的纯度。此外,实验还采取对电解液进行预电解手段,进一步降低杂质元素的含量,很大程度上提高了电解铁的纯度,如表 11所示,试样3的纯度达到了99.992%。
2.3 电解铁杂质的分析及去除为了研究电解铁中主要杂质元素氧和硫的存在形式,对在最佳因素组合条件下电解得到的纯铁进行了SEM能谱分析,如图 4所示。
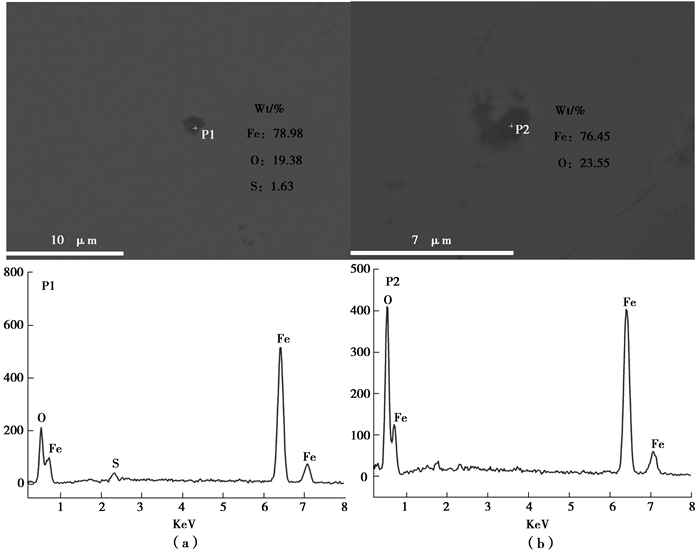
|
图 4 夹杂物形貌及其能谱分析 Figure 4 Inclusion morphology and energy spectrum analysis |
由表 10可知,电解铁中氧元素含量异常高,为了分析杂质氧的存在形式,以在最佳因素组合条件下电解得到的铁片为试样,经退火还原后,试样成分变化如表 12所示。
| 表 12 电解铁退火还原前后元素质量含量变化 Table 12 Electrolytic iron annealing before and after reduction of elemental mass content |
由表 12知,退火前后电解铁中氧含量大大减少,结合图 4(b)能谱分析可知电解铁中氧是以铁的氧化物形式存在的。其中非金属杂质含量也有明显的变化,这是由于在高温还原过程中,电解铁发生了脱氧、脱碳、脱硫等诸多固-气多相反应。
实验试样退火还原前后在金相显微镜下组织形貌如图 5所示。
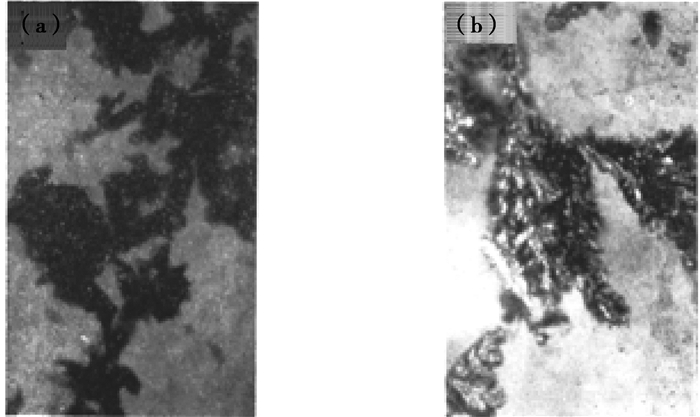
|
图 5 金相显微镜下的电解铁 Figure 5 Electrolytic iron under a metallographic microscope |
图 5(a)中黑颜色的组织是因为氧化物的影响,通过对比图 5(a)和(b),能发现图 5(b)中黑色物质明显减少,这是因为经退火还原后,电解铁表面铁的氧化物被氢气还原转化为铁,氧化物大大减少。
电解铁中杂质S元素对其整体性能有较大的影响,由表 12可知,试样退火后的硫含量为32 mg/L,实验用氢氧化钠溶液浸泡退火后的试样,发生的反应见式(7),浸出液硫酸根含量如图 6所示。
| $ {\rm{FeS}}{{\rm{O}}_{\rm{4}}}{\rm{ + NaOH = Fe(OH}}{{\rm{)}}_{\rm{2}}}{\rm{ + N}}{{\rm{a}}_{\rm{2}}}{\rm{S}}{{\rm{O}}_{\rm{4}}}。$ | (7) |
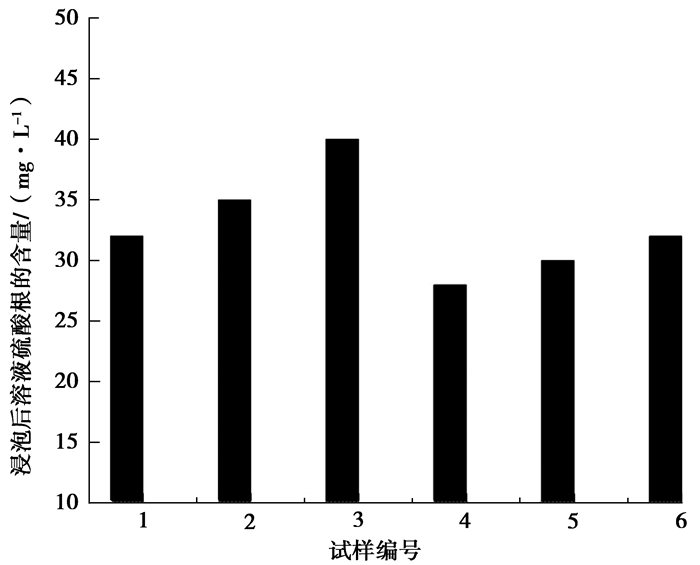
|
图 6 试样浸泡后溶液硫酸根的含量 Figure 6 Sample soaking solution sulfate content |
因整个电解体系所用的电解液主要成分为硫酸亚铁,硫元素不会以其他形式存在。且图 6显示试样经氢氧化钠溶液浸泡后,溶液中硫酸根离子的含量很高,因此,可以得出电解铁中硫元素主要是以硫酸亚铁的形式存在于铁片孔隙间的。后续实验对试样采用在500 ℃温度下真空加热处理,硫元素的含量由32 mg/L降低到10 mg/L以下,效果明显。
3 结论1) 实验通过正交设计,确定电解制备高纯铁的最佳组合因素为:Fe2+浓度50 g/L,电解温度25 ℃,pH为4.0,电流密度为100 A/m2,且在最佳实验方案下,其电沉积速率为0.549 g/h,电流效率达到89.2%,电解铁纯度达到99.98%以上。
2) 实验对电解液进行预电解,电解过程用中间隔膜隔离阴阳极以及对电解铁进行热水处理、冷水超声等处理,能很大程度上提高电解铁的纯度。
3) 电解铁中氧元素、硫元素是以铁的氧化物和硫酸亚铁形式存在,后续可分别通过氢气还原退火和真空加热方式有效去除。
| [1] | Abiko K. Why do we study ultra-high purity base metals?[J]. Materials Transactions Jim, 2000, 41(1): 233–237. DOI:10.2320/matertrans1989.41.233 |
| [2] | Takaki S. The characteristics of ultra high purity iron[J]. Bulletin of the Japan Institute of Metals, 1994, 33(1): 6–10. |
| [3] | Kunio Takada. Analysis of high purity iron-past and present[J]. Bulletin of the Japan of Metals, 1990, 29: 267–268. |
| [4] | Seiichi Takaki. The characteristics of ultra high purity iron[J]. Bulletin of the Japan Institute of Metals, 1994(33): 6–10. |
| [5] | Kimura H. Importance of the purification for the fundamental research of metallic materials[J]. Bulletin of the Japan Institute of Metals, 1994(33): 3–4. |
| [6] |
孙辉, 王力军, 张力, 等.
高纯铁制备技术综述[J]. 金属功能材料, 2009, 16(4): 42–45.
SUN Hui, WANG Lijun, ZHANG Li, et al. Review on preparation technology of high pure iron[J]. Metal Functional Materials, 2009, 16(4): 42–45. (in Chinese) |
| [7] |
李文良, 罗远辉.
区域熔炼制备高纯金属的综述[J]. 矿冶, 2010, 19(2): 57–62.
LI Wenliang, LUO Yuanhui. Preparation of high-purity metals by region melting[J]. Mining and Metallurgy, 2010, 19(2): 57–62. (in Chinese) |
| [8] |
温宏权.
超纯铁的制备技术综述[J]. 上海金属, 2002, 24(6): 32–35.
WEN Hongquan. Review on preparation technology of ultra pure[J]. Shanghai Metals, 2002, 24(6): 32–35. (in Chinese) |
| [9] |
曹为民, 印仁和, 严惠根, 等.
电解制备纯铁及其RRRH法研究[J]. 电化学, 2003, 9(3): 368–372.
CAO Weiming, YIN Renhe, YAN Huigen, et al. Preparation of pure iron by electrolysis and its RRRH method[J]. Electrochemistry, 2003, 9(3): 368–372. (in Chinese) |
| [10] |
董洪波, 侯明山, 刘超, 等.
利用太阳能在水溶液中电解制铁[J]. 电镀与涂饰, 2012, 31(6): 1–3.
DONG Hongbo, HOU Mingshan, LIU Chao, et al. Electrolysis of iron in aqueous solution by solar energy[J]. Electroplating and Finishing, 2012, 31(6): 1–3. (in Chinese) |
| [11] |
曹为民, 印仁和, 严惠根, 等.
从废铁屑电解制备纯铁及其腐蚀特性[J]. 电化学, 2003, 9(1): 93–97.
CAO Weiming, YIN Renhe, YAN Huigen, et al. Preparation of pure iron from waste iron scrap and its corrosion characteristics[J]. Electrochemistry, 2003, 9(1): 93–97. (in Chinese) |
| [12] |
李泰康, 黄小兵, 金建钢.
含铁酸洗废液中分离酸和提取电解铁粉的研究[J]. 粉末冶金工业, 2002, 12(4): 37–41.
LI Kangtai, HUANG Xiaobing, JIN Jiangang. Study on separation of acid and extraction of electrolytic iron powder from ferrous pickling waste liquid[J]. Powder Metallurgy Industry, 2002, 12(4): 37–41. (in Chinese) |
| [13] |
刘琼, 陈松.
电解法制备高纯铁的工艺研究[J]. 湿法冶金, 2013, 32(2): 105–108.
LIU Qiong, CHEN Song. Study on the preparation of high purity iron by electrolysis[J]. Hydrometallurgy, 2013, 32(2): 105–108. (in Chinese) |
| [14] | Grujicic D, Pesic B. Iron nucleation mechanisms on vitreous carbon during electrodeposition from sulfate and chloride solutions[J]. Electrochimica Acta, 2005, 50(22): 4405–4418. DOI:10.1016/j.electacta.2005.02.013 |
| [15] | Díaz S L, Calderón J A, Barcia O E, et al. Electrodeposition of iron in sulphate solutions[J]. Electrochimica Acta, 2008, 53(25): 7426–7435. DOI:10.1016/j.electacta.2008.01.015 |
| [16] | Carlos I A, Caruso C S. Electrodeposition of iron fragile layer on nickel substrate with emphasis on iron powder production[J]. Journal of Power Sources, 1998, 73(2): 199–203. DOI:10.1016/S0378-7753(97)02802-4 |
| [17] |
陈代明, 谷林, 陈培钰, 等.
利用清洁能源在水溶液中电解提取纯铁的预试验[J]. 钢铁研究学报, 2011, 23(4): 56–59.
CHEN Daiming, GU Lin, CHEN Peiyu, et al. Pretreatment of electrolytic extraction of pure iron in aqueous solution using clean energy[J]. Journal of Iron and Steel Research, 2011, 23(4): 56–59. (in Chinese) |
| [18] | Tarakci M, Korkmaz K, Gencer Y, et al. Plasma electrolytic surface carburizing and hardening of pure iron[J]. Surface & Coatings Technology, 2005, 199(2/3): 205–212. |
| [19] | Kekesi T, Mimura K, Isshiki M. Ultra-high purification of iron by anion-exchange in hydrochloric acid solutions[J]. Hydrometallurgy, 2002(63): 1–13. |
| [20] | Abiko K. The evolution of iron[J]. Physica Status Solidi, 1997, 160(2): 285–296. DOI:10.1002/(ISSN)1521-396X |
| [21] | Brossia C S, Kelly R G. The effects of impurities on the corrosion behavior of iron in methanolic solutions[C]//Summaries of technical papers of Annual Meeting Architectural Institute of Japan. E-1, Architectural planning and design I, Building types and community facilities, planning and design method building construction system human factor studies planning and design theory. Architectural Institute of Japan, 2005:32-68. |
| [22] | Abiko K, Liu C M, Ichikawa M, et al. Effect of phosphorus on hot ductility of high purity iron[J]. Journal De Physique Ⅳ, 1995, 5(C7): 335–340. |
| [23] |
刘英, 李宝成, 张金娥. 高纯金属分析技术[C]//全国有色金属理化检验学术报告会, 2012. LIU Ying, LI Bao Cheng, ZHANG Jine. Analytical technology of high purity metals[C]//National Conference on Physical and Chemical Testing of Nonferrous Metals, 2012. (in Chinese) |
| [24] |
赵玉珍, 薛进敏.
ICP-AES法同时测定纯铁中八种杂质元素[J]. 光谱实验室, 1999, 16(1): 79–82.
ZHAO Yuzhen, XUE Jingmin. Simultaneous determination of eight impurity elements in pure iron by ICP-AES[J]. Spectroscopy Laboratory, 1999, 16(1): 79–82. (in Chinese) |
| [25] |
孙荣恒, 伊亨云, 刘琼荪. 数理统计[M]. 重庆: 重庆大学出版社, 2000.
SUN Rongheng, YI Henyun, LIU Qiongsun. Mathematical statistics[M]. Chongqing: Chongqing University Press, 2000. (in Chinese) |
| [26] |
印仁和, 吕康, 曹为民, 等.
杂质钴、镍、铅、镉对提取高纯度电解铁的影响[J]. 华东理工大学学报自然科学版, 2000, 26(2): 183–187.
YIN Renhe, LYU Kang, CAO Weiming, et al. Effect of impurity Co, Ni, Pb and Cd on extraction of high purity electrolytic iron[J]. Journal of East China University of Science and Technology, 2000, 26(2): 183–187. (in Chinese) |
| [27] |
印仁和, 吕康, 曹为民, 等.
杂质Cu, Zn, Sn离子与Fe共沉积的电化学行为[J]. 过程工程学报, 2000, 21(2): 183–186.
YIN Renhe, LYU Kang, CAO Weiming, et al. Impurities Cu, Zn, Sn ions and Fe co-deposition of electrochemical behavior[J]. Chemical Metallurgy, 2000, 21(2): 183–186. (in Chinese) |
 2017, Vol. 40
2017, Vol. 40


