2. 中国科学院 重庆绿色智能技术研究院, 重庆 401122
2. Chongqing Institute of Green and Intelligent Technology, Chinese Academy of Sciences, Chongqing 401122, P.R.China
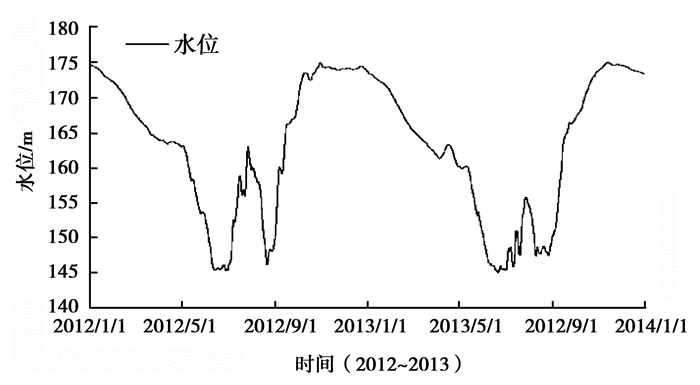
三峡库区消落带是三峡水库运行期间由水文调度引起的库区水位反季节变化,在库区周围形成的垂直落差达30 m,总面积348.93 km2的广阔区域[1]。图 1为2012~2013年三峡水库坝前水位变化图。由图 1可知,每年4月~9月水库处于低水位运行阶段,但在6月~9月,因为强降水的原因会使水库水位在145~160 m左右波动;9月~次年3月水库处于高水位运行阶段。因此,受三峡水库水位变化的影响,消落带处于周期性淹没出露状态,干湿交替的环境会对三峡库区消落带的土壤生态环境及水环境产生影响。
|
图 1 三峡水库坝前水位 (2012~2013) Figure 1 The water level of Three Gorges Reservoir Area (2012~2013) |
硝化作用是指在硝化细菌的作用下把氨 (或铵) 转化为硝酸盐的过程,它联系着矿化生物固氮等作用,在氮素循环过程中具有重要的意义。同时,硝化作用也是造成氮素损失或者氮素污染的重要原因[2]。目前,国内外对硝化作用的研究主要集中在农田、森林、湿地等生态系统中, 针对消落带土壤硝化作用的研究报道还比较少。消落带作为水库陆地生态系统和水生生态系统的过渡地带,硝化作用对消落带植被的氮素营养、土壤氮素的淋失及水库水质均有重要影响,研究消落带土壤硝化作用有利于认识氮素转化过程及有关信息。
不同土壤性质及不同土地利用方式下,影响土壤硝化作用的主要因素有较大差异。Dalias等[3]对不同温度下森林土壤硝化作用研究发现,不同类型土壤的硝化作用最适温度有较大差异;Jiang等[4]研究不同pH值条件下水稻田土壤硝化作用强度影响因素发现,在pH为5.6的弱酸性环境和pH为8.2的弱碱性环境中,对硝化作用起主要影响的细菌类型不同;牟晓杰等[5]研究表明,不同土地利用方式下,人为干扰会通过改变土壤理化性质等因素影响土壤硝化过程,进而影响生态系统氮循环。吴乘林等[6]对水库岸坡湿地土壤硝化作用的研究表明,农业面源径流会加强土壤硝化过程。
文中通过研究三峡库区长江支流澎溪河流域消落带土壤硝化强度,对澎溪河流域消落带土壤硝化作用强度的影响进行探讨,以期分析影响消落带土壤硝化作用的因素,为认识消落带生态系统独特的氮素循环特征提供依据。
1 材料与方法 1.1 研究区域概况澎溪河 (N30.84°~31.70°、E107.93°~108.90°) 是三峡库区腹心地带的一级支流,上游位于开县境内,下游位于云阳境内,在云阳县双江镇汇入长江。澎溪河流域气候温和,雨量充沛,年平均气温18.5 ℃,最高温度42.5 ℃,年降雨量1 100~1 500 mm,多集中于6月~9月,雨热同季。
澎溪河消落带总面积56.60 km2,占三峡库区消落带总面积的16.22%,是三峡库区消落带面积最大的次级支流。澎溪河消落带主要分布在开县和云阳县,且以坡度小于15°的缓坡型消落带为主。澎溪河流域消落带土地利用方式主要有耕地、草地、河滩地等。每年4月~9月,库区居民会利用部分出露的消落带进行农耕,主要种植玉米和花生等季节性作物,种植期间一般不施化肥或仅施少量农家肥,其作物产量略低于库区平均水平。
由图 1可知,消落带分布在水位高程145~175 m的库区两岸。每年4月~9月,不同高程段的消落带因出露时间不同,其土壤理化性质、土地利用方式和植被覆盖情况等均存在差异,故将其分为不同高程段进行研究。
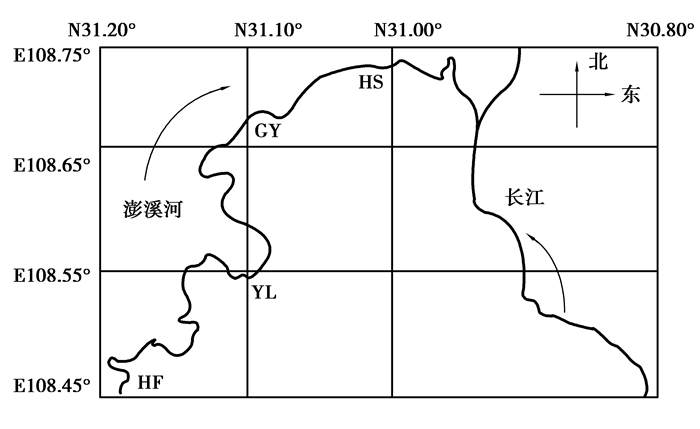
1.2 样品采集与处理2013年8月~9月采集澎溪河流域开县汉丰湖 (HF)、云阳县养鹿镇 (YL)、云阳县高阳平湖 (GY)、云阳县黄石镇 (HS)4个地区的145~155 m、155~165 m、165~175 m 3个高程段共15个点位的消落带土壤。采样点位置概况如表 1和图 2所示。采样点贯穿整个澎溪河流域消落带,涵盖了主要的土地利用方式。汉丰湖消落带位于开县县城附近,该区域人口密集,受人为干扰较多;养鹿消落带远离集镇,受人为干扰较小;高阳、黄石消落带位于集镇附近,农业人口相对集中,农垦活动较强烈。用总长为50 cm,钻头直径38 mm且外标有刻度值的不锈钢柱状采样器,采集0~20 cm深度的土壤,该采样器自带推土块,可以将土样顺利从钻头内推出。每个采样点采用网格法采集20~30个重复土样,混合后采用四分法留取供试土壤,并将新鲜土壤装入聚乙烯封口袋中,立即带回实验室。将采集的土壤样品分成2份,一份新鲜土样经冷冻干燥—磨碎—过100目筛等处理后进行理化性状的测定;另一份新鲜土壤放入冰箱于4 ℃下保存,进行硝化强度的测定。样品采集时同时测定各采样点的经纬度、pH值。
| 表 1 采样点位置概况 Table 1 The location of sampling sites |
|
图 2 采样点位置分布图 Figure 2 Sampling sites of WLFZ |
土壤化学性质参照《土壤农化分析》测定[7],有机质采用重铬酸钾-硫酸氧化法,全氮采用碱性过硫酸钾氧化分光光度法,无机氮测定采用2 mol/L的KCl溶液振荡浸提,静置离心取上清液,铵态氮采用靛酚蓝比色法,硝态氮采用紫外分光光度法。亚硝化细菌数量的测定采用最大可能计数法[8]。
采用周桦等[9]改进的Cater等[10]传统培养法,以克服传统培养法中存在的NO3-测定方法繁琐、耗时长等弊端。该方法通过在土壤悬浮培养液中加入定量的KClO3和NaClO3抑制NO2-氧化为NO3-,25 ℃下培养24 h后用KCl浸提土壤中的NO2-;过滤后,采用分光光度法测定滤液中的NO2-含量,以培养前后NO2-含量差值代表土壤硝化作用强度。相比于传统方法,具有重复性好、重现性高、简单易行等优点。
土壤硝化强度计算公式:
| ${{N}_{R}}=S\cdot 24\left( 0.1+v \right)\cdot {{m}^{-1}}$ |
式中:NR为硝化强度,mg·N/kg·d; S为斜率,即单位时间内NO2--N含量的增长速率,mg·N/L·h;v为土壤含水量,L;v=m水·ρ水-1,25 ℃下ρ水=0.998 2 g·m-3;m为干土质量,g。
1.4 数据处理与分析所有数据录入Excel 2013、Spss 19.0和Origin 8.5.1进行数据处理、统计分析和图表制作。数据间相关性采用Pearson相关性进行分析;不同数据组间采用单因素方差分析 (ANOVA) 中的多重比较法 (least significant difference,LSD) 进行显著性差异分析。
2 结果与分析 2.1 消落带土壤硝化强度概况土壤硝化强度反映的是硝化微生物将铵态氮转化为硝态氮的能力,硝化强度对土壤营养水平和生态环境均有重要影响。较低的硝化强度易使土壤中因氨挥发而造成的氮损失量增加,而较高的硝化强度易造成硝态氮淋失进入水体,引起水环境污染。表 2为澎溪河流域消落带土壤硝化强度与国内部分地区土壤硝化强度。由表 2可知,澎溪河流域消落带土壤硝化强度为0.76~9.76 mg/kg·d,和国内其他研究区域相比处于较低水平。
| 表 2 消落带与国内部分地区土壤硝化强度 Table 2 The nitrification intensity of the WLFZ soil and other domestic researches |
澎溪河流域消落带土壤硝化强度较低,一方面可能是因为库区消落带周期性的淹水使土壤较长时间趋向于厌氧状态,抑制了氨氧化细菌的活性和生长,即使4月~9月消落带出露后氨氧化细菌的活性和数量也难以大幅度增长,不利于硝化作用的进行。另一方面,三峡库区水动力相对较强,消落带的水土侵蚀导致土壤有机质和营养元素流失[14],消落带土壤相对贫瘠,不利于硝化作用的进行。相比之下,农耕地定期的翻耕提高了土壤透气性,大量地施肥提高了土壤硝化作用所需基质铵[6];而沉积物和湿地中枯落物大量聚集在地表,表层水热条件和通气状况较好,有利于硝化微生物的生存[11-13]。
2.2 不同地区消落带土壤硝化强度| 表 3 不同地区消落带土壤化性质 Table 3 Basic chemical properties of soils in study area |
|
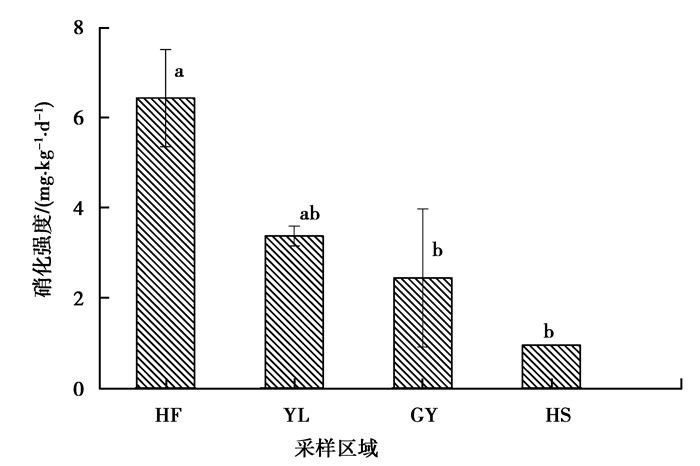
图 3 不同地区消落带土壤硝化作用强度 Figure 3 Soil nitrification intensity of WLFZ in different Sampling area |
由表 3可知,澎溪河消落带土壤整体略偏酸性,不同区域消落带土壤有机质、铵态氮、硝态氮、全氮含量存在显著差异 (P < 0.05),上游汉丰 (HF) 的亚硝化菌数量显著大于下游高阳 (GY) 和黄石 (HS) 的亚硝化菌数量 (P < 0.05)。澎溪河流域从上游汉丰 (HF) 到下游黄石 (HS),土壤有机质含量依次递减,这可能是因为上游汉丰湖消落带受人为干扰强,含高有机物的污水及其它面源污染物经消落带流入湖中后,有机物被消落带泥沙吸附;而其余几个地区受人为干扰相对较弱。
如图 3所示,澎溪河消落带从上游汉丰湖到下游黄石,土壤硝化强度呈现递减的趋势,且汉丰湖消落带土壤硝化强度显著大于高阳、黄石土壤硝化强度 (P < 0.05)。结合表 3数据分析,从澎溪河消落带上游汉丰湖到下游黄石,有机质含量逐渐降低,其他土壤理化性质变化没有呈现出一定的规律性。已有研究表明[15-16],土壤中大量可利用的有机质降解可为硝化作用提供基质铵态氮,使土壤硝化作用强度显著增大。因此,有机质含量和亚硝化菌数量随澎溪河流域流向表现出的显著变化可能是澎溪河上游到下游消落带土壤硝化强度呈现递减现象的主要原因。
2.3 不同高程段消落带土壤硝化强度表 4和图 4分别为澎溪河不同高程段消落带土壤化学性质及硝化强度。
| 表 4 澎溪河不同高程段消落带土壤化学性质 Table 4 chemical properties of WFLZ with different elevations |
|
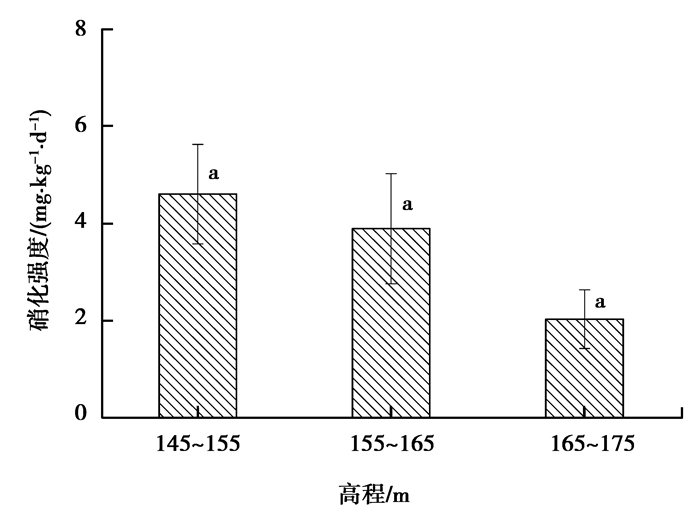
图 4 澎溪河不同高程段消落带土壤硝化度 Figure 4 Nitrification intensity of WFLZ with different elevations |
由表 4可知,不同高程段间土壤pH值、氨态氮、全氮含量和亚硝化菌数量没有显著差异 (P > 0.05),有机质和硝态氮存在显著差异 (P < 0.05)。随着高程的降低,pH值逐渐增大。这是因为淹水使土壤pH值趋于中性,随着高程的降低消落带淹水时间逐渐增长,淹水时间越长,土壤pH值越接近7.0[17]。145~155 m高程段消落带土壤有机质含量略高于155~165 m高程段,显著高于165~175 m高程段 (P < 0.05),杨洪昇等[18]研究也表明,随着淹水强度的增强,土壤有机质表现为逐渐增加的趋势。这可能是因为4月~9月三峡水库削峰调洪及降雨等原因,使145~155 m高程段消落带经常处于淹没或淹没—出露交替状态,土壤频繁的干湿交替有利于外来植物残渣的分解,使低水位土壤有机质含量增大。此外,研究发现[19-21],频繁的干湿交替引起土壤收缩和膨胀,破坏土壤团聚体,使一些微生物难以接近的有机质暴露出来,增加了土壤可溶性有机碳的含量。
图 4为澎溪河不同高程段消落带土壤硝化强度。消落带土壤硝化强度随高程增大而减小,但三者之间差异不显著 (P > 0.05)。由表 4可知,不同高程间pH值、有机质含量等理化性质之间存在较大的差别,这可能是造成消落带不同高程土壤的硝化强度存在差异的原因。
Staik等[22]研究发现,土壤pH值对土壤养分的存在状态和有效性、土壤中酶活性、微生物与植物生长等生物作用过程都有很大的影响;Seongjun等[23]研究表明,硝化细菌的最适pH值为7.9±0.4,弱碱性或碱性土壤适宜硝化作用的进行;De等[24]研究表明土壤pH值直接影响硝化细菌细胞内的电解质平衡,酸性环境抑制硝化细菌活性,从而影响硝化作用。由表 4可知,消落带不同高程段土壤pH值均略偏酸性,相比之下,145~155 m高程段的土壤pH值高于155~165 m、165~175 m高程段的土壤pH值,更加接近土壤硝化微生物生存的最适pH值,这与不同高程段亚硝化菌数量基本一致。
由表 4可知,随着高程的增加,土壤有机质含量逐渐减小,145~155 m高程段土壤有机质含量显著大于165~175 m高程段土壤有机质含量 (P < 0.05)。土壤有机质降解可为硝化作用提供基质铵态氮,因而较高的有机质含量更加有利于硝化作用的进行。此外,145~155 m高程段受水位波动的影响而干湿交替更加频繁,有利于外来植物残渣的分解。Nguyen等[25]认为,干湿交替有利于土壤微生物量以及种类的增多。微生物数量及种类的增多可以使生物过程增加,有助于硝化作用的进行。
2.4 不同土地利用方式下消落带土壤硝化强度表 5和图 5分别为澎溪河不同土地利用方式下消落带土壤化学性质及硝化强度。
| 表 5 不同土地利用方式下消落带土壤化性质 Table 5 chemical properties of WFLZ with different land utilization type |
|
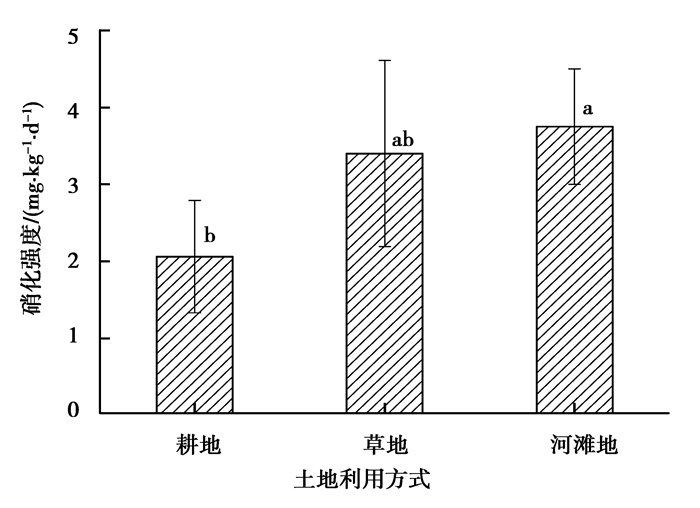
图 5 不同土地利用方式下消落带土壤硝化强度 Figure 5 Soil nitrification intensity with different land utilization type |
由表 5可知,不同土地利用方式下,消落带土壤均为偏酸性土壤,消落带土壤pH值、有机质含量、硝态氮含量、全氮含量均没有显著差异 (P > 0.05),铵态氮含量和亚硝化菌数量存在显著差异 (P < 0.05)。
如图 5所示,河滩地和耕地土壤硝化强度差异显著 (P < 0.05),河滩地土壤硝化强度是耕地土壤硝化强度的1.82倍。结合表 5可知,土壤中相对较高的pH值以及较多可利用的有机质可能是导致河滩地土壤硝化强度高于草地土壤硝化强度和耕地土壤硝化强度的原因之一;河滩地和草地亚硝化菌数量显著高于耕地亚硝化菌数量,而亚硝化菌数量的多少能够很好地反映土壤硝化强度的大小,是影响硝化强度的重要因素。
此外,河滩地和草地相对较高的硝化强度还可能与耕作方式和植被覆盖有关。Li等[26]研究发现,随着耕作年限增加,土壤的供氮能力降低,氮的可利用性下降,相反,弃耕和免耕能提高土壤的供氮能力,增加土壤氮的可利用性及有机质的积累。土壤有机质的降解可为硝化作用反应提供底物铵态氮,有利于硝化作用的进行。由表 5可知,草地土壤亚硝化菌数量显著高于耕地土壤亚硝化菌数量,这是因为草地的草本植物拥有大量的较细根系,植物根部的好氧环境及根系分泌物有利于硝化微生物的生长,进而加强了硝化过程。
2.5 消落带土壤硝化强度与土壤化学性质相关性分析表 6为澎溪河消落带土壤化学性质与硝化强度的相关性分析。通过分析消落带土壤化学性质与硝化强度之间的相关性,可以推测出影响消落带土壤硝化强度的主要因素。
| 表 6 澎溪河消落带土壤化学性质与硝化强度的相关系数 (n=45) Table 6 Correlation coefficients bteween nitrification intensity and properties in soil samples |
由表 6可知,消落带土壤硝化强度与pH值呈显著正相关 (P < 0.05),表明pH值对土壤硝化强度有较大的影响。对实验数据做进一步的分析处理后发现,当消落带土壤pH值介于4.5~6.0之间时,硝化强度平均值为2.29 mg/kg·d;土壤pH值介于6.0~7.5时,硝化强度平均值为4.28 mg/kg·d,增加了86%。可见,消落带土壤pH值介于4.5~7.5之间时,土壤硝化强度随着pH值的增大而提高。
相关性分析表明,土壤硝化强度与有机质、亚硝化菌数量呈极显著正相关 (P < 0.01)。消落带频繁的干湿交替增大了土壤中有机质的含量,对土壤微生物活性有很大促进作用,大量有机物尤其是可溶性的有机质输入到消落带后,土壤硝化过程有加强的趋势,较高的有机质含量明显提高了土壤硝化强度。亚硝化菌在有氧条件下把铵态氮氧化为亚硝态氮,通常铵态氮转化为亚硝态氮的过程是整个硝化作用过程中至关重要的一环,是整个硝化作用的限速步骤[26],故亚硝化菌数量的多少能够很好地反映硝化强度的大小。
3 结论三峡库区澎溪河消落带土壤硝化强度为0.76~9.76 mg/kg·d,平均值为3.76±0.79 mg/kg·d,明显低于国内其他研究区域耕地、沉积物、湿地土壤的硝化强度。澎溪河消落带从上游汉丰湖到下游的黄石,土壤硝化强度呈现递减的趋势,且汉丰湖土壤硝化强度显著高于高阳、黄石 (P < 0.05);随着高程的增加,消落带土壤硝化强度逐渐降低;不同土地利用方式间土壤硝化强度大小依次为河滩地、草地、耕地,且河滩地硝化强度显著大于耕地硝化强度 (P < 0.05)。
土壤硝化强度与土壤pH值呈显著正相关 (P < 0.05),与有机质含量、亚硝化菌数量呈极显著正相关 (P < 0.01)。周期性的淹水使消落带土壤理化性质发生了改变,淹水使土壤pH值趋于中性,消落带随着高程的降低淹水时间增长,故土壤pH值随高程降低而增大;而频繁的干湿交替有利于消落带外来植物残渣的分解,因此,有机质含量随高程降低而增大。此外,消落带周期性的淹没出露改变了消落带原有的土地利用方式,也影响了消落带土壤硝化强度。
| [1] |
苏维词, 赵纯勇, 杨华.
三峡库区消落区自然条件及其开发利用评价——以重庆库区为例[J]. 地理科学, 2009, 29(2): 268–272.
SU Weici, ZHAO Chunyong, YANG Hua. Evaluation on natural conditions of water-level-fluctuating zone (WLFZ) in three gorges reservoir[J]. Scientia Geographica Sinica, 2009, 29(2): 268–272. (in Chinese) |
| [2] | Veresoglou S D, Chen B, Rillig M C. Arbuscular mycorrhiza and soil nitrogen cycling[J]. Soil Biology & Biochemistry, 2012, 46(1): 53–62. |
| [3] | Dalias P, Anderson J M, Bottner P, et al. Temperature responses of net nitrogen mineralization and nitrification in conifer forest soils incubated under standard laboratory conditions[J]. Soil Biology & Biochemistry, 2002, 34(5): 691–701. |
| [4] | Jiang X J, Hou X Y, Zhou X, et al. pH regulates key players of nitrification in paddy soils[J]. Soil Biology & Biochemistry, 2015, 81(2): 691–701. |
| [5] |
牟晓杰, 刘兴土, 仝川, 等.
人为干扰对闽江河口湿地土壤硝化反硝化潜力的影响[J]. 中国环境科学, 2013, 33(8): 1413–419.
MOU Xiaojie, LIU Xingtu, TONG Chuan, et al. Effects of human disturbance on nitrification and denitrification potential in the Min River estuarine wetland[J]. China Environmental Science, 2013, 33(8): 1413–419. (in Chinese) |
| [6] |
吴承林, 田伟君, 宫晓敏, 等.
龙门口水库滨岸带硝化作用研究[J]. 中国海洋大学学报 (自然科学版), 2014, 44(7): 77–81.
WU Chenglin, TIAN Weijun, GONG Xiaomin, et al. Studies on Nitrification in the riparian zone of Longmenkou reservoir[J]. Periodical of Ocean University of China (Natural Science Edition), 2014, 44(7): 77–81. (in Chinese) |
| [7] |
鲍士旦. 土壤农化分析[M]. 北京: 中国农业出版社, 2005.
BAO Shidan. The soil agrochemical analysis[M]. Beijing: China Agricul Ture Press, 2005. (in Chinese) |
| [8] |
林先贵. 土壤微生物研究原理与方法[M]. 北京: 高等教育出版社, 2010.
LIN Xiangui. Principles and methods of soil microbiology research[M]. Beijing: Higher Education Press, 2010. (in Chinese) |
| [9] |
周桦, 于万太, 徐永刚, 等. 一种土壤硝化作用潜势测定的方法: 201010565600. 4[P]. 2012-05-30. ZHOU Ye, YU Wantai, XU Yonggang, et al. A method for the test of Soil Nitrification Potential: 201010565600.4[P]. 2012-05-30. (in Chinese) |
| [10] | Carter M, Gregorich E, Adl S M, et al. Soil sampling and methods of analysis[J]. Journal of Environmental Quality, 2007, 38(1): 15–24. |
| [11] |
张树兰, 杨学云, 吕殿青, 等.
几种土壤剖面的硝化作用及其动力学特征[J]. 土壤学报, 2000, 37(3): 372–379.
ZHANG Shulang, YANG Xueyun, LV Dianqing, et al. Nitrification and dynamics in profiles of differently managed Soil Types[J]. Acta Pedologica Sinica, 2000, 37(3): 372–379. (in Chinese) |
| [12] |
王玉萍, 王立立, 李取生, 等.
珠江河口湿地沉积物硝化作用强度及影响因素研究[J]. 生态科学, 2012, 31(3): 330–334.
WANG Yuping, WANG Lili, Li Qusheng, et al. Study on nitrification and impact factors in Pearl River estuarine wetlands[J]. Ecological Science, 2012, 31(3): 330–334. (in Chinese) |
| [13] |
吕艳华, 白洁, 姜艳, 等.
黄河三角洲湿地硝化作用强度及影响因素研究[J]. 海洋湖沼通报, 2008(2): 61–66.
LV Yanhua, BAI Jie, JIANG Yan, et al. Studies of nieifying activityy and impact factors of wetland in Yellow River Delta[J]. Transactions of Oceanology and Limnology, 2008(2): 61–66. (in Chinese) |
| [14] |
郭劲松, 黄轩民, 张彬, 等.
三峡库区消落带土壤有机质和全氮含量分布特征[J]. 湖泊科学, 2012, 24(2): 213–219.
GUO Jinsong, HUANG Xuanmin, ZHANG Bin, et al. Distribution characteristics of organic matter and total nitrogen in the soils of water-levelfluctuating zone of Three Gorges Reservoir area[J]. Journal of Lake Sciences, 2012, 24(2): 213–219. DOI:10.18307/2012.0207 (in Chinese) |
| [15] | Zaman M, Saggar S, Blennerhassett J D, et al. Effect of urease and nitrification inhibitors on N transformation, gaseous emissions of ammonia and nitrous oxide, pasture yield and N uptake in grazed pasture system[J]. Soil Biology and Biochemistry, 2009, 41(6): 1270–1280. DOI:10.1016/j.soilbio.2009.03.011 |
| [16] | Lars R, Dan B K, Maj B J. Conecntrations and fiuxes of dissolved organic carbon and nitrogen in a Picea abies chronosequence on former arable land in Sweden[J]. Forest Ecology and Management, 2010, 259(3): 275–285. DOI:10.1016/j.foreco.2009.10.013 |
| [17] |
常超, 谢宗强, 熊高明, 等.
三峡水库蓄水对消落带土壤理化性质的影[J]. 自然资源学报, 2011, 26(7): 1236–1244.
CHANG Chao, XIE Zongqiang, XIONG Gaoming, et al. The effect of flooding on soil physical and chemical properties of riparian zone in the Three Gorges Reservoir[J]. Jouranal of Natural Resources, 2011, 26(7): 1236–1244. (in Chinese) |
| [18] |
杨洪昇, 田昆, 姚茜, 等.
筑坝蓄水对高原湿地拉市海土壤有机质和全氮分布格局的影响[J]. 生态学杂志, 2015, 34(1): 162–167.
YANG Hongshen, TIAN Kun, YAO Xi, et al. The impacts of dam impoundment on the distribution patterns of soil organic matter and total nitrogen in Lashihai plateau wetland[J]. Chinese Journal of Ecology, 2015, 34(1): 162–167. (in Chinese) |
| [19] | Borken W, Ahrens B, Schulz C, et al. Site-to-site variability and temporal trends of DOC concentrations and fluxes in temperate forest soils[J]. Global Change Biology, 2011, 17(7): 2428–2443. DOI:10.1111/j.1365-2486.2011.02390.x |
| [20] |
曹磊, 宋金明, 李学刚, 等.
黄河三角洲典型潮汐湿地碳、氮、磷生物地球化学特征[J]. 海洋科学, 2015, 39(1): 84–92.
CAO Lei, SONG Jinming, LI Xuegang, et al. Biogeochemical characteristics of soil C, N, P in the tidal wetlands of the Yellow River Delta[J]. Marine Science, 2015, 39(1): 84–92. (in Chinese) |
| [21] | Alex T C, Kenneth K T, Gao Suduan, et al. Temperature, water content and wet-dry cycle effects on DOC production andcarbon mineralization in agricultural peat soils[J]. Soil Biology and Biochemistry, 2006, 38(3): 477–488. DOI:10.1016/j.soilbio.2005.06.005 |
| [22] | Staik S, Eskelinen A, Mnnisto M K. Regulation of microbial community composition andactivity by soil nutrient availability, soil pH, and herbivory in the timdra[J]. Ecosystems, 2012, 15(1): 18–33. DOI:10.1007/s10021-011-9491-1 |
| [23] | Park S, Bae W, Chung J, et al. Empirical model of the pH dependence of the maximum specific nitrification rate[J]. Process Biochemistry, 2007, 42(12): 1671–1676. DOI:10.1016/j.procbio.2007.09.010 |
| [24] | Wde B, Kowalchuk G A. Nitrification in acid soils: micro-organisms and mechanisms[J]. Soil Biology & Biochemistry, 2001, 33(7/8): 853–866. |
| [25] | Nguyen B T, Marschner P. Effect of drying and rewetting on phosphorus transformations in red brown soils with different soil organic matter content[J]. Soil Biology & Biochemistry, 2005, 37(8): 1573–1576. |
| [26] | Shiwei Li S W, Xianjun Jiang X J, Xiaolan Wang X L, et al. Tillage effects on soil nitrification and the dynamic changes in nitrifying microorganisms in a subtropical rice-based ecosystem: A long-term field study[J]. Soil & Tillage Research, 2015, 150(2): 132–138. |
 2017, Vol. 40
2017, Vol. 40

