化学发光是一种灵敏度高、线性范围宽、仪器设备简单的分析方法。近年来,纳米粒子的参与使化学发光法的研究及应用不再局限于分子和离子水平,特别是纳米粒子用于液相化学发光得到了广泛的应用,如用作微尺度反应平台、发光体等[1-3]。其具体应用包括金纳米粒子催化Luminol-H2O2化学发光体系测定柑橘类的尼索朗残留物[5],CuO纳米粒子催化Luminol-H2O2化学发光体系测定有机物[6]等,国内外关于纳米粒子参与化学发光的研究和应用最多的是Luminol发光体系,其中以Luminol-H2O2应用较为广泛。但因H2O2见光易分解,且具有氧化性,会使Luminol-H2O2化学发光体系背景值较高且不稳定,所以具有一定的缺陷。
现阶段用于化学发光比较多的纳米材料包括量子点[7]、贵金属纳米材料[8]、金属氧化物纳米材料[9]、双金属纳米材料[10]、磁性纳米材料[11]等。其中磁性纳米材料参与的化学发光报道较少,主要原因可能是大多数磁性纳米材料水溶性不好,而铁酸铜是一种性能优良的半导体材料和磁材料,禁带宽度约为2 ev[12]。纳米铁酸铜 (CuFe2O4 NPs) 在气敏性能、吸附性能、催化性能等方面均已得到研究与应用[13-14],笔者采用水热法合成了CuFe2O4 NPs,具有良好的水溶性,将CuFe2O4 NPs首次用于化学发光。
已有报道,CuFe2O4 NPs具有类过氧化物酶性质,可以催化过氧化氢产生羟基自由基[15]。研究发现,在没有CuFe2O4 NPs的情况下,Luminol-EDTA有极微弱的发光,而CuFe2O4 NPs的加入,化学发光大大提高。笔者首次建立了Luminol-EDTA-CuFe2O4 NPs化学发光新体系,避免了发光不稳定、背景值高等缺点,且该体系简单,重现性好,同时研究了发光特性,推测其发光机理。
芦丁,又名维生素P,属维生素类药,有降低毛细血管通透性和脆性的作用,保持及恢复毛细血管的正常弹性,用于防治高血压脑溢血、糖尿病视网膜出血和出血性紫癜等,也可用作食品抗氧化剂和色素。芦丁也是一种分布广泛的黄酮类化合物,主要存在于槐米、芸香、荞麦、沙棘等植物,具有抗氧化性。目前测定芦丁含量的方法有高效液相色谱法[16]、分光光度法[17]、荧光法[18]、红外光谱法[19]、伏安法[20-21]、电化学法[22]、毛细管电泳法等[23]。笔者基于芦丁的抑制发光作用,结合流动注射技术,采用Luminol-EDTA-CuFe2O4 NPs化学发光新体系,简单、快速、准确地测定了芦丁片中的痕量芦丁含量。
1 实验方法 1.1 仪器与试剂IFFM-E型流动注射化学发光分析仪 (西安瑞迈分析仪器有限公司);数显恒温磁力搅拌器 (金坛市双捷实验仪器厂);UV-2450紫外可见分光光度计 (日本SHIMADZU公司);电子天平 (日本SHIMADZU公司);高速冷冻离心机GL-16A (上海菲洽尔分析仪器有限公司);KQ-100B型超声波清洗器 (昆山市超声仪器有限公司);DELTA320 pH计 (梅特勒托利多仪器有限公司);艾柯DZG-303A纯水制备仪 (成都唐氏康宁科技发展有限公司);聚四氟乙烯反应釜 (上海聚昆仪器设备有限公司)。
鲁米诺 (Aladdin公司);芦丁标准品 (中国药品生物制品检定所);乙二醇 (分析纯,重庆川东化工有限公司);聚乙二醇20 000、无水乙醇、EDTA、无水NaAc、Na2CO3、NaHCO3、CuCl2·2H2O、FeCl3·6H2O和NaOH (分析纯,成都市科龙化工试剂厂);所用试剂均为标准品或分析纯,实验用水均为超纯水。
1.2 鲁米诺储备液的配制用分析天平准确称取0.442 9 g鲁米诺,用0.1 mol/L NaOH溶液溶解,定容于250 mL棕色容量瓶中,配制成10 mmol/L鲁米诺储备液,置于冰箱,在4℃下避光保存,放置半个月后使用。根据需要,用0.1 mol/L Na2CO3-NaHCO3缓冲溶液稀释成所需浓度,即配即用。
1.3 CuFe2O4纳米颗粒的制备CuFe2O4 NPs详细制备方法参照文献[24-25]采用水热法制备:称取0.426 2 g CuCl2·2H2O (2.5 mmol) 和1.351 4 g FeCl3·6H2O (5 mmol) 于40 mL的乙二醇溶液。在室温常压下,超声10 min,得到澄清的溶液。再称取3.60 g无水NaAc和1.00 g聚乙二醇20 000加入上述溶液,置于磁力搅拌器上搅拌30 min左右后,转移到50 mL聚四氟乙烯反应釜,在反应温度200 ℃下反应8 h,反应结束后冷却到室温。用去离子水和无水乙醇交替离心洗涤5次,在60 ℃下真空干燥6 h得到单相CuFe2O4纳米颗粒。重复实验,制备一定量的CuFe2O4纳米颗粒,用于后续化学发光。
1.4 化学发光的实验装置采用图 1所示流路研究Luminol-EDTA-CuFe2O4 NPs体系的化学发光。分别将载流 (去离子水)、EDTA、鲁米诺以及CuFe2O4 NPs通过相应的管道输入分析系统,待基线稳定后,注入样品溶液,记录反应的发光信号,其中将未加入芦丁时体系产生的化学发光强度定义为本体发光值I0,而将芦丁加入到发光体系中得到的的化学发光强度定义为I,则化学发光降低值ΔI = I0-I。实验条件:Luminol浓度为40.0 μmol/L;Luminol pH为10.97;CuFe2O4 NPs质量浓度为6.5 mg/L;EDTA浓度为4.32 mmol/L。
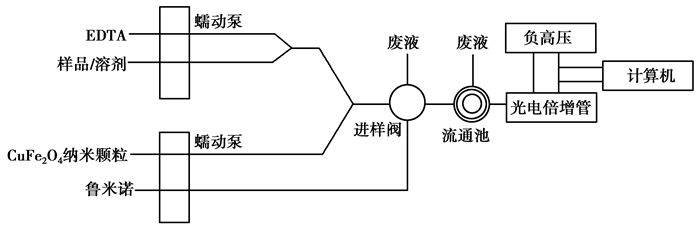
|
图 1 化学发光流路图 Figure 1 Schematic diagram of flow injection CL system |
考察了Luminol-EDTA化学发光体系在加入CuFe2O4 NPs前后发光强度的变化。如图 2所示,Luminol-EDTA发光较微弱,加入CuFe2O4 NPs后发光明显增强。将CuFe2O4 NPs分散于水中超声30 min分离出CuFe2O4 NPs,取上清液测定其催化活性,实验结果表明,上清液几乎没有催化作用。且对比试验发现,同浓度的Cu2+对此体系也无影响。因此这种增敏作用是来自CuFe2O4 NPs而不是其他干扰物质的影响。由图 2可知,芦丁的加入会抑制此体系的化学发光。
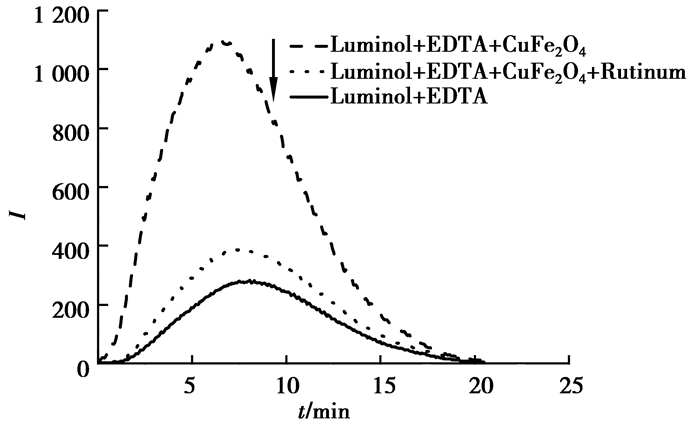
|
图 2 CuFe2O4 NPs和芦丁对化学发光的影响 Figure 2 Effect of CuFe2O4 NPs, rutin on studied CL system |
考察芦丁存在条件下,2 ~ 80 μmol/L范围内不同浓度鲁米诺浓度对化学发光的影响 (如图 3)。结果表明,随着鲁米诺浓度增加,ΔI增大,但是当鲁米诺浓度大于40 μmol/L时,体系的化学发光值随鲁米诺浓度的影响不大且有下降的趋势,考虑到试剂消耗、信噪比,本实验中选择鲁米诺浓度为40 μmol/L。
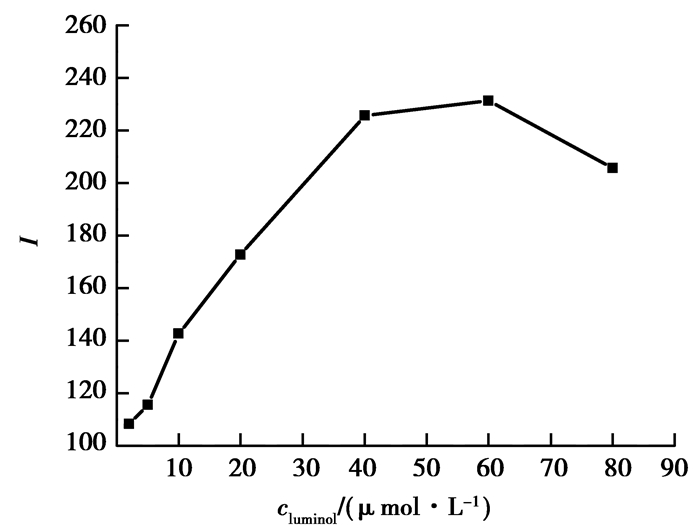
|
图 3 Luminol浓度对化学发光的影响 Figure 3 Effect of luminol concentration on the CL intensity |
通过调节0.1 mol/L Na2CO3-NaHCO3缓冲溶的pH,考察了芦丁存在条件下,鲁米诺溶液pH在9.00~11.40范围内不同pH对化学发光的影响 (如图 4)。结果表明,随着pH的增加,ΔI会一直增加,考虑到pH太高可能会腐蚀管路,所以,选择pH为11.00。
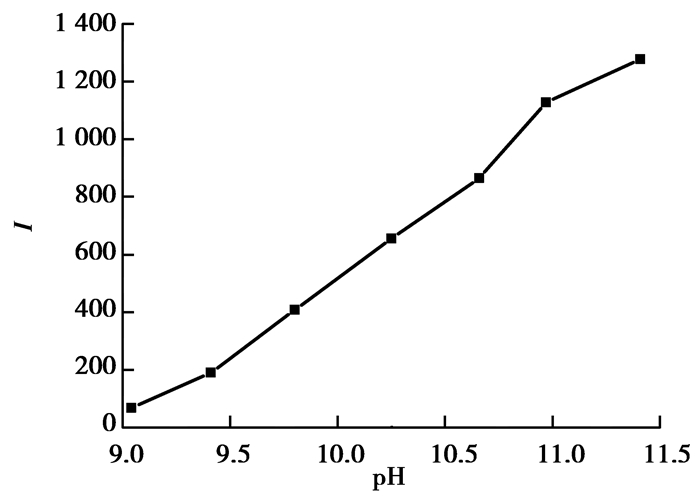
|
图 4 pH对化学发光的影响 Figure 4 Effect of pH on the CL intensity |
考察了芦丁存在条件下,EDTA浓度在0.11 ~ 6.48 mmol/L范围内不同EDTA浓度对化学发光的影响 (见图 5)。结果表明,ΔI随着EDTA的增大而增大,当EDAT浓度达到4.32 mmol/L时,ΔI的值达到最大,并保持基本不变。所以选择EDTA浓度为4.32 mmol/L进行后续分析。
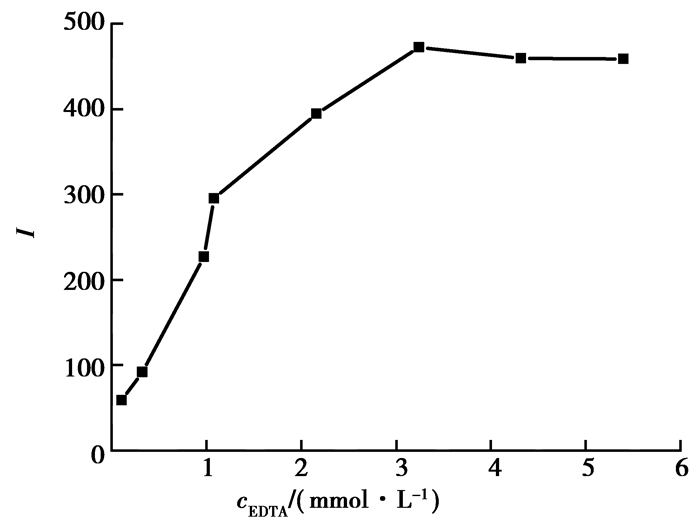
|
图 5 EDTA浓度对化学发光的影响 Figure 5 Effect of EDTA concentration on the CL intensity |
考察芦丁存在条件下,CuFe2O4纳米颗粒质量浓度在0.50 ~ 9.50 mg/L范围内对化学发光强度的影响,如图 6所示,ΔI随着CuFe2O4纳米颗粒质量浓度的增大而增大,当CuFe2O4纳米颗粒质量浓度达到6.50 mg/L时具有最大的ΔI,当CuFe2O4纳米颗粒质量浓度大于6.50 mg/L时,ΔI反而随着CuFe2O4纳米颗粒质量浓度的增大而降低,这可能是因为当纳米CuFe2O4质量浓度太高时,纳米粒子发生团聚的原因。所以,选择CuFe2O4纳米颗粒质量浓度为6.50 mg/L进行后续分析。
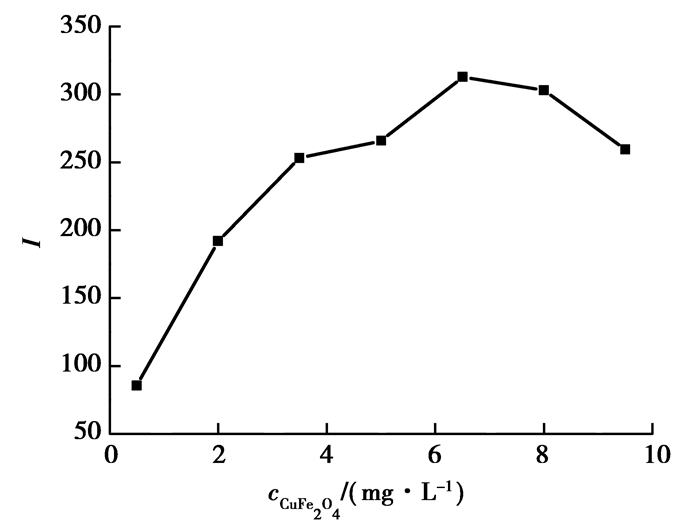
|
图 6 CuFe2O4纳米颗粒浓度对化学发光的影响 Figure 6 Effect of CuFe2O4 nanoparticle concentration on the CL intensity |
在上述选定的最佳条件下对芦丁进行测定,EDTA浓度:4.32 mmol/L,Luminol pH:11.00,Luminol浓度:40 μmol/L,CuFe2O4NPs质量浓度:6.50 mg/L,测定芦丁片中芦丁的含量。实验得到芦丁质量浓度在2×10-8 ~ 8×10-7mol/L与8×10-7 ~ 2×10-5mol/L范围内,芦丁浓度的对数 (lg c)和相对化学发光值 (ΔI) 分段呈线性变化 (r2=0.995 7和0.994 0),线性方程分别为ΔI=918.14 lg c + 7 449和ΔI=94.77 lg c+2 398,(其中ΔI为化学发光强度降低值,c为芦丁浓度),检出限 (3S/N) 为1.21×10-9 mol/L,对1×10-7 mol/L的芦丁平行测定11次,得出RSD为2.54%。
2.4 共存物质的干扰实在优化实验条件下,在1×10-7 mol/L的芦丁溶液中加入不同浓度的干扰离子和干扰物质,相对误差±5%作为干扰水平上限。结果如表 1所示,说明芦丁药片中常见辅料对其测定基本没有影响。
| 表 1 干扰物质的影响 Table 1 Effect of coexisting substance |
取市售芦丁片剂 (20 mg/片)20片,准确称量后研磨混匀,求得每片片剂的平均质量,然后称取约相当于一片片剂的质量于烧杯,加温水溶解,超声15 min,加二次水定容至100 mL,摇匀。过滤、准确移取适量此样品溶液并稀释至线性范围内,然后按上述方法测定。根据ΔI计算芦丁片中芦丁的含量,同时进行加标回收实验,结果见表 2。
| 表 2 芦丁片中芦丁测定的结果 Table 2 Results of analysis of rutin in rutin tablets |
为了讨论CuFe2O4 NPs对Luminol-EDTA增强作用的可能化学发光机理,分别考察了体系的紫外可见吸收光谱 (图 7) 与化学发光光谱 (图 8)。文献报道,鲁米诺的两个紫外吸收峰分别为294和346 nm[26],由图 7发现,在鲁米诺中加入CuFe2O4 NPs和EDTA后,鲁米诺的特征吸收峰位置没有改变,也没有新峰生成。图 8显示,Luminol-EDTA-CuFe2O4 NPs体系的最大发射波长与已有文献报道的鲁米诺的发光体——激发态3氨基邻苯二甲酸根阴离子的最大发射波长为425 nm[27]相同,说明该体系中没有生成新的激发态物质。紫外可见吸收光谱与化学发光光谱的实验表明,CuFe2O4 NPs加入Luminol-EDTA后,没有生成新的物质也没有生成新的发光体。由此说明,CuFe2O4 NPs加入Luminol-EDTA化学发光体系仅起到了催化剂的作用。
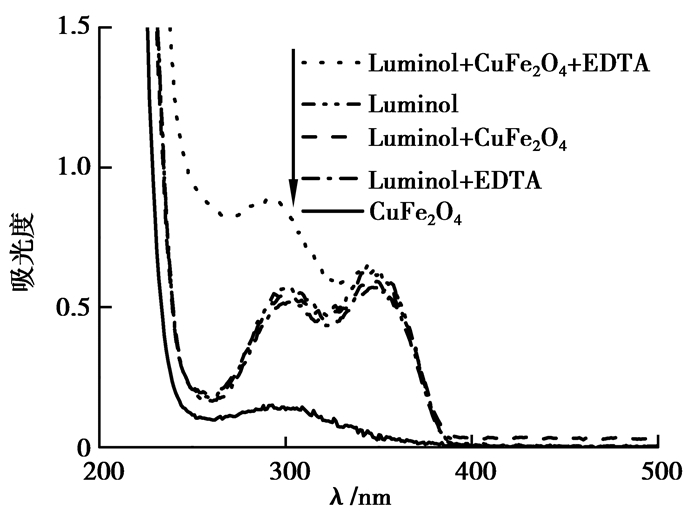
|
图 7 发光体系紫外吸收光谱图 Figure 7 UV-visible absorption spectra of chemiluminescence system |
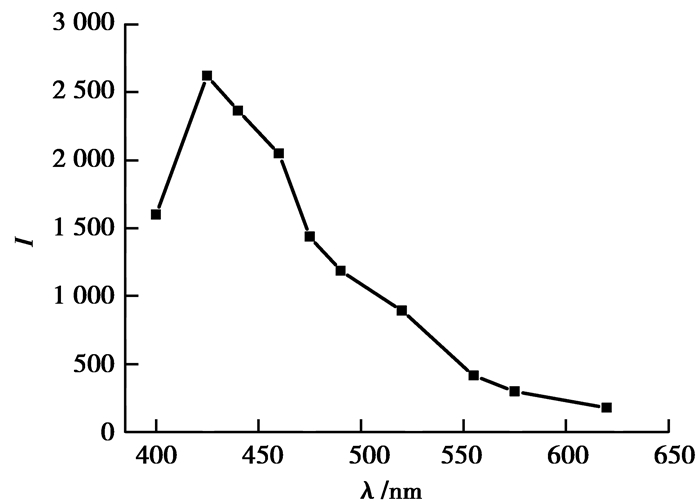
|
图 8 化学发光光谱图 Figure 8 Chemiluminescence spectra of Luminol-EDTA-CuFe2O4 NPs system |
此外,还考察了溶解氧 (O2) 对该化学发光体系的影响,在化学反应前,将氮气通入反应溶液中并持续15 min,除去溶液中的溶解氧 (O2) 后,测定Luminol-EDTA-CuFe2O4 NPs化学发光体系的发光强度。除氧 (O2) 前后化学发光强度变化的结果如图 9所示,除氧 (O2) 后该体系的化学发光值明显减弱,其发光强度几乎为0,而除氧 (O2) 前可产生强烈的化学发光。结果表明,溶解在溶液中的O2参与了Luminol-EDTA-CuFe2O4 NPs化学发光过程。
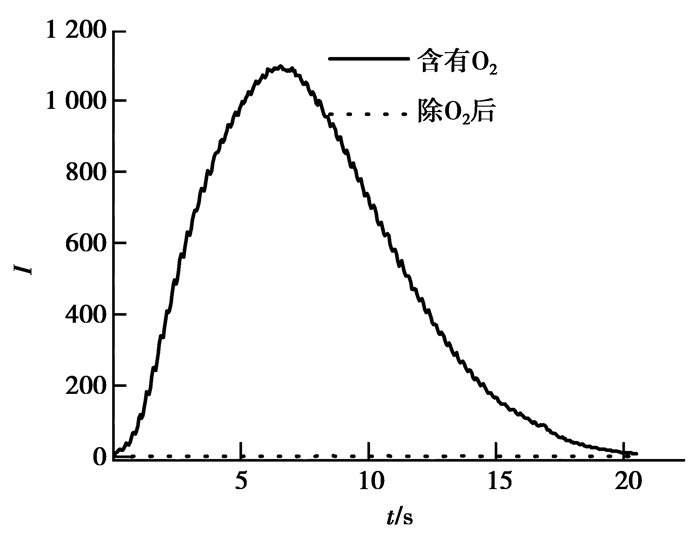
|
图 9 除O2前后的化学发光强度 Figure 9 The CL intensity of the existence and absence of O2 |
根据以上实验结果,推测Luminol-EDTA-CuFe2O4 NPs化学发光体系的机理可能为:在光照条件下,CuFe2O4 NPs价带 (VB) 的电子跃迁到导带 (CB) 上,CuFe2O4 NPs表面积累的电子可不断被溶解氧 (O2) 捕获,生成超氧阴离子自由基 (O2.-)。在碱性条件下鲁米诺生成鲁米诺阴离子,鲁米诺阴离子和O2.-反应生成鲁米诺自由基 (L.-),鲁米诺自由基 (L.-) 和O2.-之间进一步反应生成关键的发光体——激发态3氨基邻苯二甲酸盐,当激发态的3氨基邻苯二甲酸盐回到基态时产生光辐射。EDTA是一种电子提供剂和螯合剂,EDTA与CuFe2O4 NPs通过配位形成复合物,发生配体金属电子转移,从而不断提供电子给CuFe2O4 NPs导带,连续快速产生更多的O2.-,使化学发光增强。总之,CuFe2O4 NPs对体系中自由基的生成以及自由基之间电子转移反应的催化作用导致了体系化学发光信号的大大增强。
3 结论笔者采用水热法制备了水溶性较好的CuFe2O4 NPs,并构建了新的Luminol-EDTA-CuFe2O4 NPs化学发光体系,首次将CuFe2O4 NPs用于化学发光测定。Luminol-EDTA与Luminol-H2O2化学发光体系相比,EDTA不会氧化Luminol化学发光,所以体系背景值低,而且具有更好的稳定性,结合紫外可见吸收光谱及化学发光光谱,探讨了Luminol-EDTA-CuFe2O4 NPs体系可能的机理。优化实验条件,结合流动注射化学技术测定了芦丁片中芦丁的含量,该方法与其他化学方法相比具有更宽的线性范围和更低的检测限,在实际应用中具有重要意义。
| [1] | Su Y Y, Chen H, Wang Z M, et al. Recent advances in chemiluminescence[J]. Applied Spectroscopy Reviews, 2007, 42(2): 139–176. DOI:10.1080/05704920601184275 |
| [2] | Zhang L J, Chen Y C, Zhang Z M, et al. Highly selective sensing of hydrogen peroxide based on cobalt-ethylenediaminetetraacetate complex intercalated layered double hydroxide-enhanced luminol chemiluminescence[J]. Sensors and Actuators B Chemical, 2014, 193(3): 752–758. |
| [3] | Su Y Y, Xie Y N, Hou X D, et al. Recent advances in analytical applications of nanomaterials in liquid-phase chemiluminescence[J]. Applied Spectroscopy Reviews, 2014, 49(3): 201–232. DOI:10.1080/05704928.2013.819514 |
| [4] | Qin W. Flow injection chemiluminescence-based chemical sensors[J]. Analytical Letters, 2002, 35(14): 2207–2220. DOI:10.1081/AL-120015008 |
| [5] | Khajvand T, Chaichi M J, Colagar A H. Sensitive assay of hexythiazox residue in citrus fruits using gold nanoparticles-catalysed luminol-H2O2 chemiluminescence[J]. Food Chemistry, 2015, 173: 514–520. DOI:10.1016/j.foodchem.2014.10.015 |
| [6] | Chen W, Hong L, Liu A L, et al. Enhanced chemiluminescence of the luminol-hydrogen peroxide system by colloidal cupric oxide nanoparticles as peroxidasemimic[J]. Talanta, 2012, 99(18): 643–648. |
| [7] | Khataeea A, Hasanzadeha A, Iranifamb M, et al. A novel flow-injection chemiluminescence method for determination of baclofen using l-cysteine capped CdS quantum dots[J]. Sensors and Actuators B, 2015, 215: 272–282. DOI:10.1016/j.snb.2015.03.066 |
| [8] | Maddah B, Shamsi J, Barsang M J, et al. The chemiluminescence determination of 2-chloroethyl ethyl sulfide using luminol-AgNO3-Silver nanoparticles system[J]. Spectrochimica A cta Part A Molecular and Biomolecular Spectroscopy, 2015, 142: 220–225. DOI:10.1016/j.saa.2015.02.009 |
| [9] | Iranifam M, Kharameh K M. Cupric oxide nanoparticles-enhanced chemiluminescence method for measurement of β-lactam antibiotics[J]. Luminescence, 2015, 30(5): 625–630. DOI:10.1002/bio.v30.5 |
| [10] | Yu H L, He Y. Seed-assisted synthesis of dendritic Au-Ag bimetallic nanoparticles with chemiluminescence activity and their application in glucose detection[J]. Sensors and Actuators B, 2015, 209: 877–882. DOI:10.1016/j.snb.2014.12.058 |
| [11] | Abdolmohammad Z H, Rahimpour E. A novel chemosensor for Ag (I) ion based on its inhibitory effect on the luminol-H2O2chemiluminescence response improved by CoFe2O4 nano-particles[J]. Sensors and Actuators B-chemicals, 2015, 209: 496–504. DOI:10.1016/j.snb.2014.11.096 |
| [12] | Cheng C K, Kong Z Y, Khan M R. Photocatalytic-fenton degradation of glycerol solution over visible light-responsive CuFe2O4[J]. Water, Air, and Soil Pollution, 2015, 226(10): 1–12. |
| [13] | Balagurow A M, Bobrikov I A, Maschenko M S, et al. Structural phase transition in CuFe2O4 spinel[J]. Crystallography Reports, 2013, 58(5): 710–717. DOI:10.1134/S1063774513040044 |
| [14] | Kumar A S, Thulasiram B, Laxmi S B, et al. Magnetic CuFe2O4 nanoparticles: a retrievable catalyst for oxidative amidation of aldehydes with amine hydrochloride salts[J]. Tetrahedron, 2014, 46(3): 6059–6067. |
| [15] | Iranifam M. Analytical applications of chemiluminescence-detection systems assisted by magnetic microparticles and nanoparticles[J]. Trac Trends in Analytical Chemistry, 2013, 51(11): 51–70. |
| [16] | Su L, Qin W J, Zhang H G, et al. The peroxidase/catalase-like activities of MFe2O4 (M=Mg, Ni, Cu) MNPs and their application in colorimetric biosensing of glucose[J]. Biosensors and Bioelectronics, 2015, 63: 384–391. DOI:10.1016/j.bios.2014.07.048 |
| [17] | Kunti V, Peji N, Ivkovi B, et al. Isocratic RP-HPLC method for rutin determination in solid oral dosage forms[J]. Journal of Pharmaceutical & Biomedical Analysis, 2007, 43(2): 718–721. |
| [18] |
蔡卓, 赵静, 江彩英, 等.
偏最小二乘紫外分光光度法同时测定复方芦丁片中2组分的含量[J]. 中国药房, 2009(31): 2454–2456.
CAI Zhuo, ZHAO Jing, JIANG Caiying, et al. Simultaneous Determination of 2 Constituents in compound rutoside tablets by PLS-UV soectrophotometry[J]. China Pharmacy, 2009(31): 2454–2456. (in Chinese) |
| [19] |
李改茹, 常军民, 程煜凤, 等.
荧光法测定维药刺糖中黄酮类化合物含量[J]. 中国新药杂志, 2010(22): 2103–2105.
LI Gairu, CHANG Junmin, CHENG Yufeng, et al. Determination of total flavones in saccharum alhagi by spectrofluorimetry[J]. Chinese Journal of New Drugs, 2010(22): 2103–2105. (in Chinese) |
| [20] |
何书美, 乔兰侠, 刘敬兰.
红外光谱法测定芹菜叶提取物中总黄酮的含量[J]. 分析科学学报, 2008, 24(2): 201–204.
HE Shumei, QIAO Lanxia, LIU Jinglan. Quantitative determination of total flavonoids in the extraction of celery leaves by IR[J]. Journal of analytical science, 2008, 24(2): 201–204. (in Chinese) |
| [21] | Yang S, Qu L, Li G, et al. Gold nanoparticles/ethylenediamine/carbon nanotube modified glassy carbon electrode as the voltammetric sensor for selective determination of rutin in the presence of ascorbic acid[J]. Journal of Electroanalytical Chemistry, 2010, 645(2): 115–122. DOI:10.1016/j.jelechem.2010.04.019 |
| [22] | Magarelli G, Lima L H C, Silva J G D, et al. Rutin and total isoflavone determination in soybean at different growth stages by using voltammetric methods[J]. Microchemical Journal, 2014, 117(2): 149–155. |
| [23] | Deng P H, Xu Z F, Peng Y L. Highly sensitive and simultaneous determination of ascorbic acid and rutin at an acetylene black paste electrode coated with cetyltrimethyl ammonium bromide film[J]. Journal of Electroanalytical Chemistry, 2012, 683(8): 47–54. |
| [24] |
隋因, 郭涛, 孙沂, 等.
高效毛细管电泳法测定心舒口服液中腺苷、芦丁和阿魏酸的含量[J]. 中国医院药学杂志, 2005, 25(3): 232–234.
SUI Yin, GUO Tao, SUN Yi, et al. Determination of adenosine, rutin and ferulic acid in Xinshu oral liquid were determined by HPCE[J]. Chinese Journal of Hospital Pharmacy, 2005, 25(3): 232–234. (in Chinese) |
| [25] |
孙莲, 阿合买提江, 马晓丽, 等.
HPCE法同时测定新疆药桑叶中芦丁、异槲皮苷、槲皮素与绿原酸的含量[J]. 中国药房, 2011(23): 2177–2179.
SUN Lian, A Hemaitijiang, MA Xiaoli, et al. Determination of chlorogenic acid, rutin, isoquercitrin and quercetin in drug mulberry leaves of Xijiang by HPCE[J]. China Pharmacy, 2011(23): 2177–2179. (in Chinese) |
| [26] | Miao D D, Li J J, Yang R, et al. Supersensitive electrochemical sensor for the fast determination of rutin in pharmaceuticals and biological samples based on poly (diallyldimethylammonium chloride)-functionalized graphene[J]. Journal of Electroanalytical Chemistry, 2014, 732: 17–24. DOI:10.1016/j.jelechem.2014.08.018 |
| [27] |
李利军, 钟招亨, 冯军, 等.
流动注射化学发光法测定芦丁[J]. 光谱学与光谱分析, 2007, 27(8): 1625–1628.
LI Lijun, ZHONG Zhaoheng, FENG Jun, et al. Determination of rutin by flow injection chemiluminescence method[J]. Spectroscopy and Spectral Analysis, 2007, 27(8): 1625–1628. (in Chinese) |
| [28] | Deng H, Li X L, Peng Q, et al. Monodisperse magnetic single-crystal ferrite microspheres[J]. Angewandte Chemie, 2005, 44(18): 2782–2785. DOI:10.1002/(ISSN)1521-3773 |
| [29] | Deng H, Chen H Y, Li H. Synthesis of crystal MFe2O4 (M=Mg, Cu, Ni) microspheres[J]. Materials Chemistry and Physics, Materials Chemistry & Physics, 2007, 101(2/3): 509–513. |
| [30] | Chen S, Yan G, Schwartz M A, et al. Penicillin-enhanced chemiluminescence of the Luminol-H2O2-Co2+ System[J]. Journal of Pharmaceutical Sciences, 1991, 80(11): 1017–1019. DOI:10.1002/jps.2600801104 |
| [31] | Chen W, Hong L, Liu A L, et al. Enhanced chemiluminescence of the luminol-hydrogen peroxide system by colloidal cupric oxide nanoparticles as peroxidase mimic[J]. Talanta, 2012, 99(18): 643–648. |
| [32] | Maddah B, Shamsi J, Barsang M J, et al. The chemiluminescence determination of 2-chloroethyl ethyl sulfide using luminol-AgNO3-silver nanoparticles system[J]. Spectrochimica Acta Part A Molecular and Biomolecular Spectroscopy, 2015, 142(1): 220–225. |
| [33] | Khataee A, Iranifam M, Fathinia M, et al. Flow-injection chemiluminescence determination of cloxacillin in water samples and pharmaceutical preparation by using CuO nanosheets-enhanced luminol-hydrogen peroxide system[J]. Spectrochimica Acta Part A Molecular and Biomolecular Spectroscopy, 2015, 134: 210–217. DOI:10.1016/j.saa.2014.06.125 |
| [34] | Miyawa J H, Schulman S G, Perrin J H. Postcolumn chemiluminescence as a detection technique in the liquid chromatographic analysis of beta‐lactam ring containing compounds[J]. Biomedical Chromatography, 2015, 11(4): 224–229. |
 2017, Vol. 40
2017, Vol. 40

