2. 杭州医学院 杭州 310053
2. Hangzhou Medical College, Hangzhou 310053, P. R. China
乙酸异戊酯作为带有香蕉和梨香味的无色透明液体,在食用香精、香皂、合成洗涤剂等日化香精配方中有着广泛的应用。乙酸异戊酯的传统工业生产方法是浓硫酸催化合成法,制备过程易发生氧化、脱水等副反应,同时存在设备腐蚀严重,废液后处理复杂,催化剂再生困难等问题,属非绿色生产工艺路线。采用固体超强酸、分子筛、酸性树脂等作为催化剂,虽然在一定程度上解决了传统催化酯化反应催化剂存在的一些缺点,但它们仍存在相对活性低、酸性位密度低和酸强度分布不均等缺陷,从而限制了它们的应用[1-4]。
杂多酸化合物作为一种新型环境友好催化材料,可在不改变结构的情况下通过调整其组成元素来控制其在不同反应中的催化性能。杂多酸是多原子强酸,催化反应时形成的假液相(pseudo-liquid phase)反应场使其显示较好的催化性能[5]。这些典型的特征使杂多酸应用倍受关注[6-8]。但杂多酸自身存在的比表面积小,易溶于极性溶剂以及作为催化剂催化反应时回收及循环使用困难等问题使其工业应用受到限制。因此对杂多酸(磷钨酸)进行改性以提高其表面积,并且激发更高的催化活性和选择性是研究的热点。无机有机杂化材料具有耐高温、表面性质(亲水、亲油)以及表面官能团容易调变等优点使此类材料的应用受到关注[9-14]。氨基酸是含有氨基和羧基的一类有机化合物,是蛋白质的基本组成单元,价格低廉且无毒。与无机成分磷钨酸相结合得到的氨基酸基磷钨酸化合物可同时具有有机成分及无机成分的各种优异性能,并且由于其具有的协同效应等其他性质,使其在多酸型无机有机杂化材料领域亦具有潜在的应用价值[15]。笔者以甘氨酸与磷钨酸结合形成的磷钨酸盐为催化剂,考察催化剂用量、反应时间及带水剂量等因素对乙酸异戊酯合成的影响,并利用响应面分析法优化反应条件,为乙酸异戊酯的规模化生产奠定研究基础。
1 材料与方法 1.1 材料与试剂甘氨酸(Gly)、磷钨酸、乙酸乙酯、乙酸、异戊醇、环己烷、氢氧化钠、酚酞及其他试剂均为分析纯级,由迈瑞化学试剂公司提供。
1.2 方法 1.2.1 催化剂的制备与表征试验中所用催化剂的制备与表征见课题组前期发表的文献[16]。傅里叶变换红外光谱仪(Bruker IFS-28) 对重复使用前后甘氨酸功能化磷钨酸催化剂进行表征,同时利用电感耦合等离子体发射光谱仪(ICP-OES CID,iCAP 6500; Thermo Scientific)对催化剂中P含量进行检测。
1.2.2 乙酸异戊酯的合成向带有电动机械搅拌的三颈瓶中加入乙酸6.0 g (0.1mol),异戊醇9.25 g (0.105mol),催化剂0.24 g及带水剂环己烷10 mL,装上分水冷凝回流装置,加热搅拌,使反应体系保持回流至不再有水生成时结束反应。静置冷却后甘氨酸功能化磷钨酸催化剂从反应体系中析出,过滤、乙醚洗涤、真空干燥后的催化剂回收利用。滤液减压蒸馏除环己烷及异戊醇,用10% NaHCO3水溶液洗涤滤液至偏碱性,再用热水洗至中性,减压蒸馏,即得乙酸异戊酯。按照国标GB/T 1668—1995测定反应前后酸值,由式(1) 来计算酯化反应的酯化率。
| $ 酯化率 = (1-反应后酸值/反应前酸值) \times 100\% 。 $ | (1) |
甘氨酸、磷钨酸及不同组成的甘氨酸基磷钨酸[GlyH]xH3-xPW12O40在乙酸异戊酯合成反应中显示不同的催化性能,具体结果见表 1。由表 1可知,Gly显示较弱的催化酯化反应活性,而甘氨酸功能化磷钨酸催化剂催化酯化活性均有不同程度提高,且反应活性随着甘氨酸含量的增加先增加后降低,其中[GlyH]1.0H2.0PW12O40的催化活性最好,乙酸异戊酯产率为98.2%。这是因为酯化反应是典型的酸催化反应,Gly较差的催化性能与其较弱的酸性有关,而Gly通过结合磷钨酸提供的质子形成GlyH+,得到具有强酸性的甘氨酸基磷钨酸[GlyH]xH3-xPW12O40催化剂,从而催化活性大大提高。当Gly含量过高时,催化剂晶体结构内部的空间位阻增加,不利于反应物分子的运动,分子间的有效碰撞降低,从而使乙酸异戊酯的产率下降。甘氨酸基磷钨酸催化剂催化酯化反应时除显示较强酸性外,催化剂在催化反应时存在的“自分离”(self-seperation)性能使它的应用备受关注。反应初期,催化剂溶于反应体系,表现为均相反应,随着反应进行,异戊醇量不断减少,乙酸异戊酯量增加。由于催化剂在酯中具有较低溶解度,从而使得反应体系变浑浊,反应结束冷却反应体系,高收率的乙酸异戊酯进一步促进产物与催化剂自动分层,从而可通过简单过滤实现催化剂与反应体系分离。综合各种因素,试验中选择[GlyH]1.0H2.0PW12O40作为催化剂,进行乙酸异戊酯的合成工艺研究。
| 表 1 不同组成甘氨酸基磷钨酸在乙酸异戊酯合成反应中的催化性能 Table 1 List of isoamyl acetate yield during esterification of acetic acid and isoamylol over various catalysts |
反应条件:醇酸摩尔数比为1.05 :1,催化剂量4%,反应时间1.5 h,10 mL环己烷。
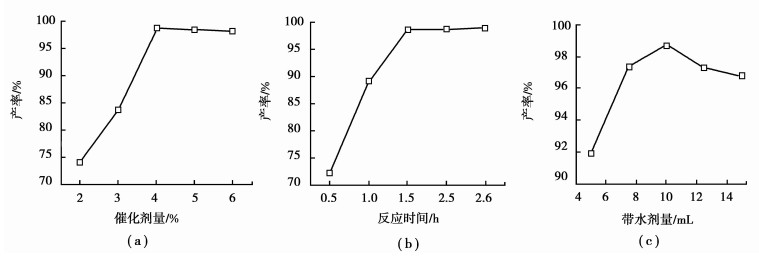
2.2 反应条件对[GlyH]1.0H2.0PW12O40催化合成乙酸异戊酯的影响以[GlyH]1.0H2.0PW12O40为催化剂,进行乙酸与异戊醇的酯化反应研究,各因素对乙酸异戊酯产率的影响结果如图 1所示。
|
图 1 不同反应条件对乙酸异戊酯产率的影响 Figure 1 Yield of isoamyl acetate over [GlyH]1.0H2.0PW12O40 as a function of reaction conditions |
由图 1(a)可知,在乙酸与异戊醇的酯化反应过程中,随着催化剂用量的增加, 乙酸转化率增加,当催化剂用量超过4%时,乙酸转化率略有降低。这是由于[GlyH]1.0H2.0PW12O40为酸性催化剂,4%用量的催化剂已达到该酯化反应对催化剂酸量的要求,此时乙酸异戊酯的产率最高为98.2%。继续增加催化剂用量,反应体系酸性增强,易导致酯水解等副反应的发生,使乙酸异戊酯收率降低。因此,以[GlyH]1.0H2.0PW12O40为催化剂时,最佳催化剂用量为4%。
图 1 (b)为不同反应时间对乙酸异戊酯产率的影响,由图可知,随着反应时间增加,乙酸异戊酯产率增加,其中反应1.5 h时,酯化率达到最大;继续增加反应时间,酯化率略有降低。这是因为乙酸与异戊醇的酯化反应为可逆反应,在一定温度下存在最佳平衡反应时间,而过长的反应时间会导致乙酸异戊酯的部分水解,产率降低。因此反应时间控制在1.5 h为宜。
带水剂用量对酯化反应也有一定的影响。图 1 (c)为温度373 K,醇酸摩尔数比1.05 :1,催化剂用量4%,反应时间1.5 h条件下带水剂量对乙酸异戊酯产率的影响。由图可见,随着带水剂量的增加,乙酸异戊酯产率增加,当带水剂量为10 mL时,乙酸异戊酯酯产率最大,继续增加带水剂用量,酯产率降低。这是由于加入过量带水剂,降低了反应体系中醇酸及催化剂的相对浓度,从而使酯化反应速度降低。因此该反应选用10 mL环己烷作为带水剂进行考察。
2.3 响应面分析法优化乙酸异戊酯的合成根据Box-Benhnken的中心组合试验设计原理,利用响应面设计软件(Version 6.0.5, Stat-Ease. Inc., USA)对乙酸与异戊醇的酯化反应条件进行优化。在单因素试验的基础上,以催化剂用量、反应时间和带水剂量为参考因素,乙酸异戊酯的产率为响应值进行试验设计。试验因素和水平设计见表 2。
| 表 2 试验设计中的因素水平及编码水平 Table 2 Experimental range and factor levels for esterification process |
以x1、x2和x3为自变量,乙酸异戊酯的产率为响应值(Y),试验方案及结果见表 3。其中实验1~12是析因点,13~17是区域中心点,中心实验重复5次,用以估计试验误差(标准误差为0.35)。
| 表 3 响应面试验设计方案及实验结果 Table 3 The design and results of response surface methodology |
由表 3中数据可以看出,实际产率与预测产率值较接近,说明响应面回归模型能够较好地预测自变量与响应值的关系。该二次回归方程为:
| $ Y{\rm{ }} = 98.23 + 1.38{x_{1}} + 1.29{x_{2}}-1.84{x_{3}}-1.52{x_{1}}^2-0.90{x_2}^2 - \\1.60{x_{3}}^2 + 0.20{x_1}{x_{2}} + 0.95{x_1}{x_{3}} + 1.80{x_2}{x_3}。 $ |
由表 3的实验结果得到的方差分析见表 4。由表 4可知,模型F值为58.29,F >F0.01 (9, 7) =6.71;模型P值远小于0.000 1,表明二次回归模型极其显著。失拟度表示二次回归方程和实验数据的偏差程度,本实验二次模型失拟项为1.55,相对于纯误差不显著,说明二次模型合理。模型的复相关系数R2和调整后的R2分别为0.986 8和0.969 9,说明该模型具有很高的可信度。该模型的变异系数为0.45%,作为衡量每个平均值偏离实际情况的参数,其值越小,重复性越好。各因素分析表明该实验方法可靠,试验设计较合理,因此可用该回归模型预测乙酸异戊酯的产率。
| 表 4 方差分析表 Table 4 Analysis of variance table |
另外,P值的大小表明模型及各因素的显著水平。由表 4中各自变量的P值可知,在二次模型中催化剂用量、反应时间、带水剂量对乙酸异戊酯产率的影响均达到极显著水平(P < 0.01),催化剂用量与反应时间之间的交互作用对响应值的影响不显著,而催化剂用量与带水剂量及反应时间与带水剂量之间的相互作用对响应值的影响极显著。
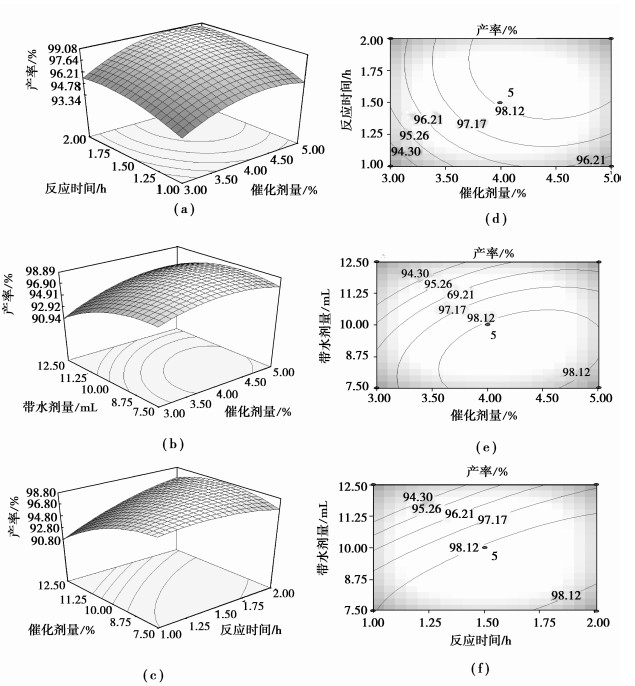
RSM的图形是响应值对各试验因子构成的等曲面图和高线图,借助Design Expert软件,由回归方程式绘制分析图,结果见图 2。
|
图 2 各因素对乙酸异戊酯产率影响的响应面图和等高线图 Figure 2 3D response surfaces and contour plots showing correlations between a pair of experimental variables and relevant effects on predicted isoamyl acetate yield while keeping other variables at a constant level of 0 |
图 2(a)和(d)表示催化剂用量和反应时间两因素对催化合成乙酸异戊酯的交互作用。从图 2(a)可以看出,使用定量催化剂时,乙酸异戊酯产率随着反应时间的增加而快速增加,随后缓慢减小。在保持反应时间不变时,随着催化剂用量的增加,乙酸异戊酯产率先缓慢增加后缓慢降低。从图 2(d)可以看出,等高线图为圆形,表明催化剂用量和反应时间的交互作用不显著,这与表 4分析结果相一致。
图 2(b)和(e)为乙酸异戊酯产率随带水剂量和催化剂用量的变化情况。从3D图可知,催化剂用量一定时,随着带水剂量的增加,乙酸异戊酯产率呈现先缓慢增加后快速降低的趋势。其次,带水剂量曲线相对于催化剂用量曲线更为陡峭,表明带水剂量对乙酸异戊酯产率的影响相对于催化剂用量更为显著。由等高线图 2(e)可以看出,等高线图为斜椭圆形,表明催化剂用量和带水剂量两因素对乙酸异戊酯合成的交互作用极其显著,这与表 4分析结果相一致。
图 2(c)和(f)为反应时间和带水剂量的交互作用。由响应面图 2(c)可知,带水剂量对乙酸异戊酯产率的影响相对于反应时间更为显著,这从带水剂量曲线相对于反应时间曲线表现的更为陡峭可以看出。从图 2(f)可以看出,等高线图为斜椭圆形,也表明两因素的交互作用对乙酸异戊酯产率具有显著影响。
结合回归模型的数学分析可知,制备乙酸异戊酯的最佳工艺参数为:催化剂用量4.52%,反应时间1.91 h,带水剂量10.09 mL,在此条件下乙酸异戊酯的产率为99.08%。为便于实际操作,将乙酸异戊酯的制备工艺参数修正为催化剂用量4.5%,反应时间2.0 h,带水剂量10 mL。在此条件下进行3次验证试验,测得乙酸异戊酯的平均产率为98.5%,与理论预测值基本相符,这说明回归方程能够真实地反映各因素对乙酸异戊酯酯化率的影响。
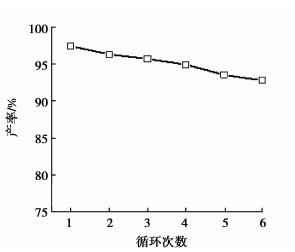
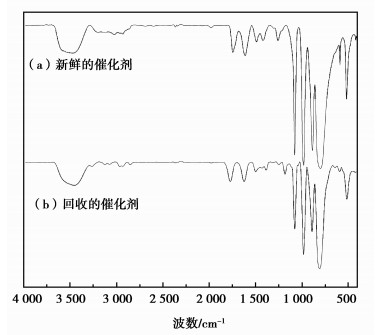
2.4 [GlyH]1.0H2.0PW12O40催化剂的重复使用性试验考察了最佳工艺条件,即催化剂用量4.5%,反应时间2.0 h,带水剂量10 mL,回流条件下甘氨酸基磷钨酸[GlyH]1.0H2.0PW12O40催化剂催化合成乙酸异戊酯的重复使用性能。反应结束,由于催化剂的自分离性能,使反应混合物自动分成两层,上层主要为酯产物,下层为催化剂。通过过滤分离、乙醚洗涤,然后343 K真空干燥5 h后催化剂循环使用,实验结果见图 3。由图可见,经过6次循环使用,酯化率有所降低。对循环使用6次后催化剂进行红外表征发现(图 4),回收的催化剂保留了磷钨酸4个典型的Keggin结构特征峰;同时对反应前后[GlyH]1.0H2.0PW12O40催化剂中的P元素含量进行分析,结果表明催化剂中P元素含量由新鲜催化剂的1.28%降低到0.92%,催化剂中部分磷钨酸的流失是该催化剂活性降低的原因之一。以上结果均表明[GlyH]1.0H2.0PW12O40催化剂是一种重复使用性能较好的催化剂,具有一定使用价值。
|
图 3 [GlyH]1.0H2.0PW12O40催化剂的重复使用性 Figure 3 Results of repeated use of the [GlyH]1.0H2.0PW12O40 catalyst |
|
图 4 新鲜催化剂与回收催化剂的FT-IR谱图 Figure 4 FT-IR spectra of the fresh [GlyH]1.0H2.0PW12O40 and the corresponding spent catalyst regenerated after six consecutive cycles |
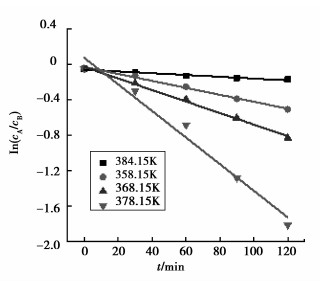
以[GlyH]1.0H2.0PW12O40为催化剂,分别在温度为348.15、358.15、368.15、378.15 K条件下建立催化合成乙酸异戊酯的动力学模型。固定其他反应条件为:催化剂用量4.5%,带水剂量10 mL。不同温度下分别反应30、60、80和120 min。
由于酯化反应为可逆反应,实验条件下,带水剂把反应生成的水有效带出,从而抑制了酯分解反应的进行,且反应体系的体积变化可忽略,故可假定反应为恒容不可逆反应,相应动力学方程表示为:
| $ Y =-\frac{{{\rm{d}}{c_A}}}{{{\rm{d}}t}} = kc_A^\alpha c_B^\beta, $ | (1) |
式中:r为酯化反应速率;k为正反应速率常数;cA和cB分别是乙酸和异戊醇的瞬时浓度;α和β分别是他们的反应级数。现假设α=β=1,式(1) 积分可得:
| $ Y = \frac{{{\rm{ln}}{c_A}/{c_B}}}{{{c_{A0}}-{c_{B0}}}} = kt + c, $ | (2) |
式中:cA0为乙酸初始浓度(mol/L); cB0为异戊醇初始浓度(mol/L)。
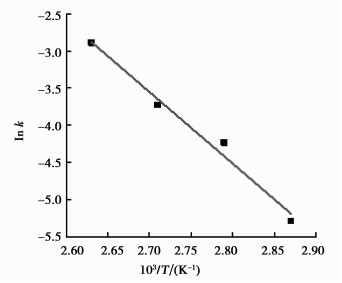
根据不同温度对ln cA/cB和反应时间t作图(图 5),求得各相应温度下速率常数k。结合Arrhenius公式
|
图 5 ln(cA/cB)与时间关系拟合图 Figure 5 Plot of ln(cA/cB) versus time for esterification with isoamyl alcohol and acetic acid |
|
图 6 ln k vs 103/T的阿乌尼斯方程拟合图 Figure 6 Arrhenius plot of lnk versus 103/T |
不同组成甘氨酸基磷钨酸催化合成乙酸异戊酯时显示较好的催化活性,其中部分取代的[GlyH]1.0 H2.0PW12O40催化剂具有最好的催化性能和重复使用性能,以其为催化剂,利用响应面分析法优化得到乙酸异戊酯的最佳合成条件为:催化剂用量4.5%,反应时间2.0 h,带水剂量10 mL,该条件下,乙酸异戊酯产率为98.5%。优化条件下动力学模型表明乙酸异戊酯的酯化反应为二级反应,该反应的活化能为79.73 kJ/mol。
| [1] |
崔秀兰, 林明丽, 郭海福, 等.
稀土固体超强酸催化合成乙酸异戊酯的研究[J]. 化学世界, 2003, 44(1): 27–30.
CUI Xiulan, LIN Mingli, GUO Haifu, et al. Study on the catalytic synthesis of isoamyl acetate on solid superacid containing rare earth elements[J]. Chemical World, 2003, 44(1): 27–30. (in Chinese) |
| [2] | Blagov S, Parada S, Bailer O. Influence of ion-exchange resin catalysts on side reactions of the esterification of n-Butanol with acetic acid[J]. Chemical Engineering Science, 2006, 61(2): 753–765. DOI:10.1016/j.ces.2005.07.007 |
| [3] | Xu D Y, Ma H, Cheng F. Preparation and application of zirconium sulfate supported on SAPO-34 molecular sieve as solid acid catalyst for esterification[J]. Materials Research Bulletin, 2014, 53: 15–20. DOI:10.1016/j.materresbull.2014.01.029 |
| [4] |
刘炜烽, 杨水金.
合成乙酸异戊酯催化剂研究新进展[J]. 乙醛醋酸化工, 2015(2): 9–14.
LIU Weifeng, YANG Shuijin. New research progress in synthesis of iso-amyl acetate[J]. Acetaldehyde Acetic Acid Chemical Industry, 2015(2): 9–14. (in Chinese) |
| [5] | Misono M, Okuhara T, Ichiki T, et al. ChemInform abstract:"Pseudoliquid" behavior of heteropoly compound catalysts. Unusual pressure dependences of the rate and selectivity for ethanol dehydration[J]. Journal of the American Chemical Society, 1987, 18(48): 5535–5536. |
| [6] | Talebian-Kiakalaieh A, Amin N A S, Zarei A, et al. Transesterification of waste cooking oil by heteropoly acid (HPA) catalyst:optimization and kinetic model[J]. Appl Energ, 2013, 102(2): 283–292. |
| [7] | Misono M. Recent progress in the practical applications of heteropolyacid and perovskite catalysts:catalytic technology for the sustainable society[J]. Catalysis Today, 2009, 144(3/4): 285–291. |
| [8] | Choi J H, Kim J K, Park D R, et al. Redox properties and oxidation catalysis of transition metal-substituted a-K5PW11O39 (M·OH2) (M=MnⅡ, CoⅡ, NiⅡ, and ZnⅡ) Keggin heteropolyacid catalysts for liquid-phase oxidation of 2-propanol[J]. Journal of Molecular Catalysis A Chemical, 2013, 371: 111–117. DOI:10.1016/j.molcata.2013.01.035 |
| [9] | Lai D M, Deng L, Guo Q X, et al. Hydrolysis of biomass by magnetic solid acid[J]. Energy and Environmental Science, 2011, 4(9): 3552–3557. DOI:10.1039/c1ee01526e |
| [10] | Leng Y, Wang J, Zhu D R, et al. Heteropolyanion-based ionic liquids:Reaction-induced self-separation catalysts for esterification[J]. Angewandte Chemie International Edition, 2009, 48(1): 168–171. DOI:10.1002/anie.200803567 |
| [11] | Han X, He Y, Hung C T, et al. Efficient and reusable polyoxometalate-based sulfonated ionic liquid catalysts for palmitic acid esterification to biodiesel[J]. Chemical Engineering Science, 2013, 104: 64–72. DOI:10.1016/j.ces.2013.08.059 |
| [12] | Han X, Yan W, Chen K, et al. Heteropolyacid-based ionic liquids as effective catalysts for the synthesis of benzaldehyde glycol acetal[J]. Applied Catalysis A General, 2014, 485: 149–156. DOI:10.1016/j.apcata.2014.08.001 |
| [13] | Huang M Y, Han X X, Hung C T, et al. Heteropolyacid-based ionic liquids as efficient homogeneous catalysts for acetylation of glycerol[J]. Journal of Catalysis, 2014, 320(1): 42–51. |
| [14] |
陈可可, 方苗利, 严巍, 等.
磺酸官能化三苯基磷负载磷钨酸催化合成异戊酸正丁酯[J]. 中国粮油学报, 2015, 30(10): 54–60.
CHEN Keke, FANG Miaoli, YAN Wei, et al. Catalytic synthesis of isoamyl isovalerate by phosphotungstic acid salt of triphenyl (3-Sulfopropyl) phosphonium as catalysts[J]. Journal of the Chinese Cereals and Oils Association, 2015, 30(10): 54–60. DOI:10.3969/j.issn.1003-0174.2015.10.011(in Chinese) |
| [15] |
郭树荣, 由万胜, 王恩波, 等.
甘氨酸的杂多酸超分子化合物的合成及性质研究[J]. 分子科学学报, 2000, 16(1): 1–4.
GUO Shurong, YOU Wansheng, WAN Enbo, et al. Synthesis and properties of supermolecular compounds of glycine heteropoly tungstutes[J]. Journal of Molecular Science, 2000, 16(1): 1–4. (in Chinese) |
| [16] | Han X X, Chen K K, Yan W, et al. Amino acid-functionalized heteropolyacids as efficient and recyclable catalysts for esterification of palmitic acid to biodiesel[J]. Fuel, 2016, 165: 115–122. DOI:10.1016/j.fuel.2015.10.027 |
| [17] | Chem K K, Yan W, Zhang X F, et al. Optimization of process variables in the synthesis of isoamyl isovalerate using sulfonated organic heteropolyacid salts as catalysts[J]. Journal of the Brazilian Chemical Society, 2015, 26(3): 224–229. |
 2017, Vol. 40
2017, Vol. 40


