自从紫杉醇(taxol,商品名Paclitaxe1) 被发现有抗癌作用以来[1],人们对它的各个方面均展开了研究,但紫杉醇的生产量成了医药应用上的一大瓶颈。目前,获得紫杉醇的方式仍然主要是直接从红豆杉树皮或叶子中获取而来。但红豆杉生长非常缓慢,而且其紫杉醇含量很低,即使是采用现在紫杉醇含量最高的曼地亚红豆杉品种,含量也才最多万分之六、七。所以要得到一针剂量的紫杉醇,就需要大量的红豆杉树皮或者针叶,这对红豆杉资源和生态环境都提出了挑战。除了直接从植物中提取出微量紫杉醇外,目前生产紫杉醇主要还有几种方法:1) 化学全合成;2) 化学半合成,用植物代谢中间产物巴卡亭Ⅲ(baccatin Ⅲ)来合成紫杉醇;3) 通过培养红豆杉细胞的方法生产紫杉醇;4) 通过微生物发酵生产[2]。化学半合成的方法虽然可以应用,但必须从中间产物巴卡亭Ⅲ这一步开始,其它几种方法都还处于实验阶段。因紫杉醇化学结构复杂,虽然现在可以用化学全合成的方法来合成,但产量太低,而且要用到剧毒原料;而培养植物红豆杉细胞也会面临老化的问题;从自然界中分离能产紫杉醇的真菌培养,又出现不稳定及产量太低的问题[3-5]。
紫杉醇的自然合成过程非常复杂,经过多年研究,现在大部分过程都逐渐得到阐明,一些关键的酶基因被鉴定出并已得到克隆和表达[6-10]。紫杉醇在植物化学分类中属于多贴类化合物,其第一步成环反应和紫杉二烯合成酶的DNA序列早在1995年就被Hezari等相继确定[11-14]。特别是美国华盛顿州立大学的Croteau教授实验组对紫杉醇通路做了大量系统的研究,逐步解析了紫杉醇合成的生物学过程[15]。在植物红豆杉中,以牻牛儿焦磷酸(GGPP)为合成前体物质,至少需要经过20多步的酶促生物化学反应,才能得到紫杉醇。随着合成生物学和生物发酵工程的发展,人们认识到对微生物的改造来发酵生产药物或者中间体,既安全又环保。2005年,加州大学伯克利分校的J.Keasling实验室开始改造酵母天然的甲羟戊酸途径(Mevalonate, MVA),使MVA途径被用来大量产生中间体法尼焦磷酸盐(FPP),而法尼焦磷酸盐接下来可被青蒿基因在酵母中表达的甜苦艾酶催化产生青蒿酸,而正常情况下该途径是通过糖类代谢产生的乙酰辅酶A来合成甾醇,这一成果发表在2006年的Nature杂志上[16]。利用酵母菌对其改造后生产青蒿素的成功,对人们是一个很大的鼓舞。人们也在尝试生产其它中间体[17-20]。麻省理工学院的Stephanopoulos教授实验组展开了相关的研究,并于2010年在Science上发表了其最新研究结果[21]。
紫杉醇作为一种对卵巢癌、乳腺癌、子宫癌、肺癌、食道癌、前列腺癌以及直肠癌等多种癌症都非常有效的天然药物,它有着独特的作用机制:主要作用于癌细胞中的微管蛋白,使微管蛋白复合物结构稳定,而不能得到解聚,从而使癌细胞的有丝分裂异常或停止,最终导致肿瘤细胞的死亡,达到有效地治疗效果[22-26]。
大肠杆菌作为一种被常规研究的微生物,人们对其遗传背景及生长规律都了解很清楚。其实,在大肠杆菌其本身也包含有紫杉醇生物合成的上游途径,虽然和真核生物不一样,但仍然有合成前体物质异戊烯焦磷酸(IPP)和二甲基烯丙基焦磷酸(DMAPP)的能力,称之为MEP途径,此途径也是大肠杆菌正常生长所需要的,只是表达水平比较低而已。因此,理论上可以根据需要对大肠杆菌进行改造,改变其基因表达的强弱,使它可以适合萜类的合成[21, 27-29]。文中主要集中对上游途径的MEP2模块进行构造,然后与MEP1模块和下游模块一起互相调节,使菌株既能正常生长,又能稳定表达紫杉醇中间体4(5),11(12)-紫杉二烯。
1 实验材料 1.1 细胞株大肠杆菌菌株EDE3-Ch1Trc-MEP1-T7TG(实验室保存)、EDE3-Ch1T5-MEP1-T7TG(实验室保存)、EDE3-Ch1T7-MEP1-T7TG(实验室保存)、DH5a大肠杆菌感受态细胞(Invitrogen公司)。
1.2 质粒pcl2009-ispC, pcl2009-ispH, pcl2009-ispE, pcl2009-ispG(Invitrogen公司);pACYCDuet-TXS-GGPP-kmFRP(实验室保存)。
1.3 所用试剂限制性内切酶:Nde1(NEB);Xho 1(NEB);Ase1;Nae 1(NEB);Pst1(NEB);Sca1(NEB);Apa(NEB);XbaI(NEB);NotⅠ(NEB);HindⅢ(NEB);SalⅠ(NEB);T4DNA连接酶(NEB);去磷酸化酶(NEB);质粒提取试剂盒(Qiagen);快速DNA凝胶回收试剂盒(QIAGEN);Taq DNA聚合酶(Invitrogen公司);普通PCR试剂盒(Invitrogen公司);高保真PCR试剂盒(Invitrogen);DNA Maker(Invitrogen公司);PCR产物回收试剂盒(Qiagen);Glycerol(Sigama公司)。其它分子生物学试剂及各种限制性内切酶也从NEB公司购买。
2 实验方法 2.1 创建MEP2模块1) 根据所要操作的基因序列设计好带酶切位点的引物,如图 1所示。

|
图 1 MEP2模块4种基因引物 Figure 1 Four gene primers of MEP2 module |
2) 把基因ispH连接入质粒ipcl2009ispC中。
首先,以质粒pcl2009ispH作为模板,用PCR方法高保真扩增基因ispH,继而在37 ℃的温箱中用Xho1与Pst1两种限制性内切酶分别充分双酶切质粒pcl2009ispC和ispH PCR产物,为了使酶切彻底,切4 h。然后把质粒pcl2009ispC酶切产物去磷酸化处理。用试剂盒分别纯化DNA酶切产物。16 ℃水浴连接过夜后,转化DH5a感受态细胞。经过抗生素筛选,挑取阳性克隆菌,提取质粒,进行酶切、测序分析。最后得到连接成功的ipcl2009ispCH质粒。
3) 把基因ispE连接入质粒ipcl2009ispCH中。
以质粒pcl2009ispE作为模板,PCR高保真扩增ispE基因,在37 ℃的温箱中用Pst1与Xba1分别充分双酶切所构建质粒pcl2009ispCH和ispE PCR产物4 h。把质粒pcl2009ispCH酶切产物去磷酸化。再分别用试剂盒纯化DNA酶切产物。16 ℃水浴连接过夜,转化DH5a感受态细胞。经过抗生素筛选,挑取阳性克隆菌,提取质粒,进行酶切、测序分析。最后得到连接成功的ipcl2009ispCHE质粒。
4) 把基因ispG连接入质粒ipcl2009ispCHEG中。
用基因质粒pcl2009ispG作为模板,PCR高保真扩增ispG基因,在37 ℃的温箱中用Xba1与Sal1充分双酶切pcl2009ispCHE和ispG PCR产物4 h。把质粒pcl2009ispCHE酶切产物去磷酸化。再分别用试剂盒纯化DNA酶切产物。16 ℃连接过夜,转化DH5a感受态细胞。经过抗生素筛选,挑取阳性克隆菌,提取质粒,进行酶切、测序分析。最后得到连接成功的ipcl2009ispCHEG质粒。
5) 把抗生素Km(Kanamycin)基因连接入质粒ipcl2009ispCHEG中。
用高保真PCR试剂盒和带有Sca1和Xho1酶切位点的引物,从pACYCDuet-TXS-GGPP-kmFRP质粒上扩增-FRP-Km gene-FRP基因盒;然后在37 ℃的温箱中用Xho 1酶和Sca1酶下双酶切PCR产物至少4 h,产物用DNA纯化试剂盒纯化;再用Sal 1酶和Nae 1酶在37 ℃条件下双酶切新得到的质粒ipcl2009ispCHEG 4 h;待双酶切完全后后,加入去磷酸化酶及缓冲液(Buffer)在37 ℃培养箱中去磷酸化反应1 h;继而跑DNA胶后,切割小质粒条带,酶切完后的线性质粒用纯化试剂盒纯化;最后把双酶切下的-FRT-Km-FRT基因盒与酶切后的线性质粒质粒ipcl2009ispCHEG连接:加入连接酶1 μL, 相应buffer 2 μL, 总反应体积为20 μL,在16 ℃水浴锅中连接过夜;取2 μL过夜连接产物转化进入50 μL DH5a细胞;然后铺卡那霉素板筛选,挑取培养皿板上的阳性克隆提取质粒进行PCR、特异酶切以及精确测序进行分析进而得到确认。最后得到ipcl2009ispCHEGKm质粒。
2.2 把得到的质粒模块ipcl2009ispCHEGKm转入到含有MEP1模块和下游模块的菌种中首先用氯化钙的方法分别制作菌株感受态细胞:EDE3-Ch1Trc-MEP1-T7TG1、EDE3-Ch1T5-MEP1-T7TG1、EDE3-Ch1T7-MEP1-T7TG1,然后按操作规程将质粒ipcl2009ispCHEGKm分别转进3个菌株中:分别向3种菌株中加入质粒DNA溶液(200 ng左右),摇匀,放置冰上10 min。42 ℃水浴中热击45 s,迅速置于冰上冷却2 min。再加入250 μL LB培养基,混匀后37 ℃振荡培养1 h。将上述菌液摇匀后取150 μL涂布于抗生素筛选平板上,向上放置0.5 h,菌液完全干后倒置培养皿,37 ℃培养,直到克隆长出。
2.3 用IPTG诱导改造菌小发酵生产4(5),11(12) 紫杉二烯同样,每种质粒挑取5个克隆来检测:先用灭菌牙签挑取少许克隆接种到3 mL含1%葡萄糖LB溶液中,30 ℃摇床200 r/min生长过夜;当生长到OD600值超过到2OD时,鲜配发酵培养基(Taxadiene培养基,加入适当抗生素,并加入IPTG,使其终浓度到0.1 M,搅拌器上充分混合);分别加入50 μL菌液到2 mL发酵培养基的玻璃试管中,旋紧塑料瓶塞,插入小针管透气;放到30 ℃摇床200 r/min转速连续培养6 d。
2.4 气相色谱质谱联用(GC-MS)测4(5),11(12) 紫杉二烯浓度当菌株生长到第6 d时,从各个玻璃管中取出500 μL菌液,测定其OD600值,计算其生长情况。接着用管内另外的1.5 mL菌液来提取紫杉二烯:向管中加入正己烷1 mL,盖紧;振荡器上大力度震荡30 min;2 000 r/min转速离心20 min;小心取200 μL上清液到GC-MS管中待测Taxadiene浓度,同时用正己烷作为空白对照和洗涤用,设定好方法,运行程序进行检测。
3 实验结果 3.1 成功创建另一上游模块,并成功添加Km选择基因:MEP2-ispCHEG-Km因大肠杆菌MEP上游途径除了dxs、ispD、idi、ispF4种关键酶基因外,还有ispC、ispE、ispH、ispG 4种酶基因。虽然大肠杆菌已有这4种基因本底水平的表达以供自己正常生长需要,但为了增加前体物质IPP和DMAPP的供应量,需要让上游每个步骤的前体物质充分表达。为了成功构建MEP2-ispCHEG-Km模块,采用逐步连接法,从基因ispc开始,先连接ispH,然后再连接ispE,继而连接ispG,最后接上Km基因以供转化后抗性筛选。克隆过程如图 2所示,构建成功的模块质粒图如图 3所示。
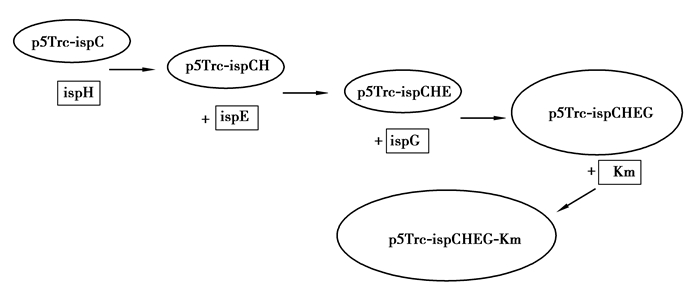
|
图 2 MEP2模块逐渐克隆过程 Figure 2 the clone process of MEP2 module |

|
图 3 成功克隆的MEP2模块质粒图谱 Figure 3 the plasmid map of MEP2 |
因实验室在前期把上游MEP1模块和下游TG模块整合进入EDE3菌株,已经得到3个稳定表达的菌株:EDE3-Ch1Trc-MEP1-T7TG1、EDE3-Ch1T5-MEP1-T7TG1、EDE3-Ch1T7-MEP1-T7TG1,微发酵后,产生紫杉二烯的最高浓度为30 mg/L。考虑到大肠杆菌染色体的容量,先不把MEP2模块整合进入大肠杆菌染色体,而是以质粒的方式转入到上述3种菌株中。成功得到新的3种菌株,组成示意图如图 4所示。
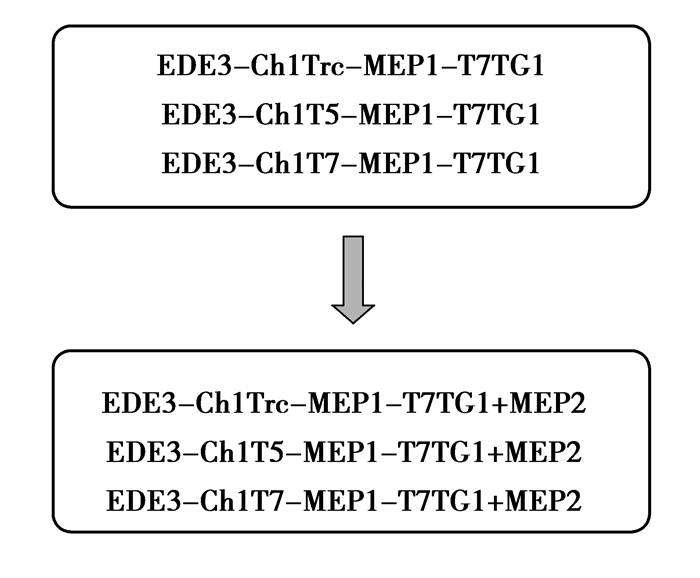
|
图 4 构建含上下游3个模块的菌株示意图 Figure 4 Schematic diagram of strain including 3 modules of upstream and downstream |
当大肠杆菌只含有上游MEP1模块和下游模块TG时,菌株已能发酵产生紫杉二烯了,大肠杆菌本身含有模块MEP2中的所有基因,只是表达量比较低。所以,就再人为地增加这些基因的表达量,把MEP2以质粒的方式转入EDE菌株中。结果显示转入的MEP2能帮助增加紫杉二烯的合成量,通过微发酵后使产生的紫杉二烯的最高浓度达到最高40 mg/L,如图 5所示。
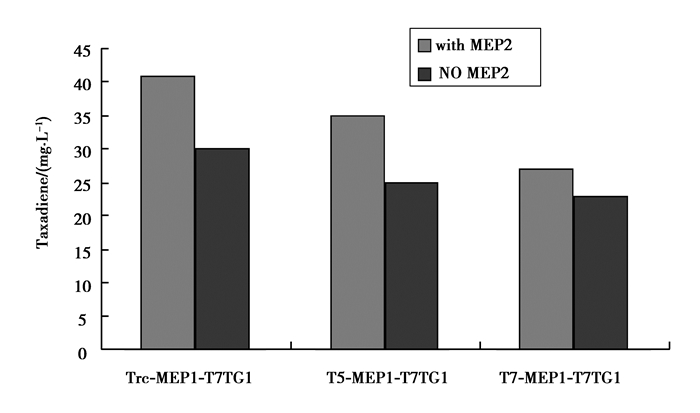
|
图 5 含MEP1、MEP2、TG 3个模块菌株生产紫杉二烯 Figure 5 The taxadiene production in the strain including MEP1, MEP2 and TG modules |
随着紫杉醇医疗需求量的增加,现有植物资源已不能满足需求。目前,紫杉醇依然主要从红豆杉植物直接提取,资源消耗太大。红豆杉属于生长慢的树种,所以科学家们都在寻求从其它途径生产紫杉醇的可能性。自从可以用酵母菌来发酵生产青蒿素以来,似乎已经看到了可以用微生物发酵生产紫杉醇的前景[30]。紫杉醇与青蒿素一样都属于贴类化合物,青蒿素属于倍半萜类,结构和生物合成途径更简单。而紫杉醇属于二萜类化合物,生物合成途径复杂得多。但紫杉醇和青蒿素的生物合成有共同的上游部分,都是以GGPP为反应底物。理论上,用改造了的微生物来发酵生产紫杉醇是可以的。因为其复杂结构及合成的复杂过程,各大实验室都还处于探索阶段,没有实质性的突破。
目前,用微生物改造来生产紫杉醇及前体物质的实验室基本上都是采取这种上下游策略[2, 19-20]:改变微生物原有的上游途径;改变微生物的下游途径;降低其它的需消耗IPP和DMAPP的旁路途径。思路虽然简单,但是要想在微生物正常发酵生长的前提下改变这么多通路,确实也是一个挑战。通过研究发现,并不是上游表达强度越强越好,但是上游某些酶基因表达弱了肯定影响下游表达。就要找这个平衡点,既不要表达过少,也不要过多。所以,就只有通过不同的启动子和表达量的多少来控制最终表达量,找到各方面都比较平衡的状态。
实验的创新之处在于把大家容易忽视的另外几个基因ispC、ispE、ispH和ispG4整合成一个操纵子模块转入到大肠杆菌中加强上游表达水平。ispC、ispE、ispH和ispG4虽然不是MEP通路的限速酶基因,但他们表达量的多少也可能对下游途径造成影响。如果表达量很低的话,有可能会减少下游产量,如果能增加其表达量,或许可以增加下游的表达量。但大肠杆菌作为一种简单生长菌,不能同时容纳太多质粒生长,所以,实验把ispC、ispE、ispH和ispG4这4个基因以串联的方式控制在同一个启动子下表达,以期增加IPP和DMAPP供应量,进而提高紫衫二烯表达水平。实验结果虽然不是很明显,但也初步证明了设想,当把上游MEP2转入进菌株后,紫杉二烯的表达量有所提高。至于为什么没有大幅度提高,可能是因为还没有找到其最佳平衡点。这也是今后研究中会进一步加强的地方。在下一步研究中,把MEP2模板的启动子换成表达强度更强的启动子,同时增加下游外来途径的表达量水平,从多方面来改造大肠杆菌以加强紫衫二烯的表达量,从而使大肠杆菌为人类医药发展服务。
| [1] | Wani M C, Taylor H L, Wall M E, et al. Plant antitumor agents. Ⅵ. The isolation and structure of taxol, a novel antileukemic and antitumor agent from Taxus brevifolia[J]. Journal of the American Chemical Society, 1971, 93(9): 2325. DOI:10.1021/ja00738a045 |
| [2] | Li J, Wang C. Advances of taxol combinatorial biosynthesis[J]. Chinese Journal of Biotechnology, 2014, 30(3): 355–367. |
| [3] | Doi T, Fuse S, Miyamoto S, et al. A formal total synthesis of taxol aided by an automated synthesizer[J]. Chemistry-An Asian Journal, 2006, 1(3): 370–383. DOI:10.1002/(ISSN)1861-471X |
| [4] | Karliga B, Schilling J K, Kingston D G, et al. Synthesis and biological evaluation of N -(arylsulfanyl)carbonyl analogues of paclitaxel (taxol)[J]. Chemistry & Biodiversity, 2006, 3(4): 396–404. |
| [5] | Ganesh T, Norris A, Sharma S, et al. Design, synthesis, and bioactivity of simplified paclitaxel analogs based on the T-Taxol bioactive conformation[J]. Bioorganic & Medicinal Chemistry, 2006, 14(10): 3447–3454. |
| [6] | Li H, Horiguchi T, Croteau R, et al. Studies on taxol biosynthesis:preparation of taxadiene-diol-and triol-derivatives by deoxygenation of taxusin[J]. Tetrahedron, 2008, 64(27): 6561–6567. DOI:10.1016/j.tet.2008.04.008 |
| [7] | Jin Q W, Williams D C, Hezari M, et al. Stereochemistry of the macrocyclization and elimination steps in taxadiene biosynthesis through deuterium abeling[J]. Journal of Organic Chemistry, 2005, 70(12): 4667–4675. DOI:10.1021/jo0502091 |
| [8] | Hampel D, Mau C J D, Croteau R B. Taxol biosynthesis:identification and characterization of two acetyl CoA:taxoid-O-acetyl transferases that divert pathway flux away from Taxol production[J]. Archives of Biochemistry & Biophysics, 2009, 487(2): 91–97. |
| [9] | Horiguchi T, Rithner C D, Croteau R, et al. Studies on Taxol biosynthesis. Preparation and tritium labeling of biosynthetic intermediates by deoxygenation of a taxadiene tetra-acetate obtained from Japanese yew[J]. Journal of Labelled Compounds & Radiopharmaceuticals, 2003, 51(9): 325–328. |
| [10] | Guo B H, Kai G Y, Gong Y F, et al. Molecular cloning and heterologous expression of a 10-deacetylbaccatin Ⅲ-10-O-acetyl transferase cDNA from Taxus x media[J]. Molecular Biology Reports, 2007, 34(2): 89–95. DOI:10.1007/s11033-006-9018-6 |
| [11] | Guerrabubb J, Croteau R, Williams R M. The early stages of taxol biosynthesis:an interim report on the synthesis and identification of early pathway metabolites[J]. Natural Product Reports, 2012, 29(6): 683–696. DOI:10.1039/c2np20021j |
| [12] | Kong J Q, Wang W, Zhu P, et al. Acta Pharmaceutica Sinica[J]. Yao Xue Xue Bao, 2007, 42(4): 358–365. |
| [13] | Hezari M, Lewis N G, Croteau R. Purification and characterization of taxa-4(5), 11(12)-diene synthase from Pacific yew (Taxus brevifolia) that catalyzes the first committed step of taxol biosynthesis[J]. Archives of Biochemistry and Biophysics, 1995, 322(2): 437–444. DOI:10.1006/abbi.1995.1486 |
| [14] | Walker K, Ketchum R E, Hezari M, et al. Partial purification and characterization of acetyl coenzyme A:taxa-4(20), 11(12)-dien-5alpha-ol O-acetyl transferase that catalyzes the first acylation step of taxol biosynthesis[J]. Archives of Biochemistry & Biophysics, 1999, 364(2): 273–279. |
| [15] | Dejong J H M, Liu Y L, Bollon A P, et al. Genetic engineering of taxol biosynthetic genes in Saccharomyces cerevisiae[J]. Biotechnology & Bioengineering, 2006, 93(2): 212–224. |
| [16] | Ro D K, Paradise E M, Ouellet M, et al. Production of the antimalarial drug precursor artemisinic acid in engineered yeast[J]. Nature, 2006, 440(7086): 940–943. DOI:10.1038/nature04640 |
| [17] | Ohto C, Muramatsu M, Obata S, et al. Production of geranylgeraniol on overexpression of a prenyl diphosphate synthase fusion gene in Saccharomyces cerevisiae[J]. Applied Microbiology and Biotechnology, 2010, 87(4): 1327–1334. DOI:10.1007/s00253-010-2571-x |
| [18] | Akbari V, Moghim S, Mofid M R. Comparison of epothilone and taxol binding in yeast tubulin using molecular modeling[J]. Avicenna Journal of Medical Biotechnology, 2011, 3(4): 167–175. |
| [19] | Dahm P, Jennewein S. Introduction of the early pathway to taxol biosynthesis in yeast by means of biosynthetic gene cluster construction using SOE-PCR and homologous recombination[J]. Methods in Molecular Biology, 2010, 643: 145–163. DOI:10.1007/978-1-60761-723-5 |
| [20] | Engels B, Dahm P, Jennewein S. Metabolic engineering of taxadiene biosynthesis in yeast as a first step towards Taxol (Paclitaxel) production[J]. Metabolic engineering, 2008, 10(4): 201–206. |
| [21] | Ajikumar P K, Xiao W H, Tyo K E J, et al. Isoprenoid pathway optimization for Taxol precursor overproduction in escherichia coli[J]. Science, 2010, 330(6000): 70–74. DOI:10.1126/science.1191652 |
| [22] | Weaver B A. How Taxol/paclitaxel kills cancer cells[J]. Molecular Biology of the Cell, 2014, 25(18): 2677–2681. DOI:10.1091/mbc.E14-04-0916 |
| [23] | Lin Y H, Chen B Y, Lai W T, et al. The Akt inhibitor MK-2206 enhances the cytotoxicity of paclitaxel (Taxol) and cisplatin in ovarian cancer cells[J]. Naunyn-Schmiedeberg's Archives of Pharmacology, 2015, 388(1): 19–31. DOI:10.1007/s00210-014-1032-y |
| [24] | Li W, Liu J, Jackson K, et al. Sensitizing the therapeutic efficacy of taxol with shikonin in human breast cancer cells[J]. Plos One, 2014, 9(4): 94079. DOI:10.1371/journal.pone.0094079 |
| [25] | Kim Y W, Kim E Y, Jeon D, et al. Differential microRNA expression signatures and cell type-specific association with Taxol resistance in ovarian cancer cells[J]. Drug Design Development & Therapy, 2014, 8(1): 293–314. |
| [26] | Kim J H, Yoon E K, Chung H J, et al. p53 acetylation enhances Taxol-induced apoptosis in human cancer cells[J]. Apoptosis, 2013, 18(1): 110–120. DOI:10.1007/s10495-012-0772-8 |
| [27] | Ajikumar P K, Tyo K, Carlsen S, et al. Terpenoids:opportunities for biosynthesis of natural product drugs using engineered microorganisms[J]. Molecular Pharmaceutics, 2008, 5(2): 167–190. DOI:10.1021/mp700151b |
| [28] | Liu T, Khosla C. A balancing act for Taxol precursor pathways in E.coli[J]. Science, 2010, 330(6000): 44–45. DOI:10.1126/science.1195014 |
| [29] | Loncaric C, Merriweather E, Walker K D. Profiling a Taxol pathway 10β-acetyltransferase:assessment of the specificity and the production of baccatin Ⅲ by in vivo acetylation in E.coli[J]. Chemistry & Biology, 2006, 13(3): 309–317. |
| [30] | Westfall P J, Pitera D J, Lenihan J R, et al. Production of amorphadiene in yeast, and its conversion to dihydroartemisinic acid, precursor to the antimalarial agent artemisinin[J]. Proceedings of the National Academy of Sciences, 2012, 109(3): 111–118. DOI:10.1073/pnas.1110740109 |
 2017, Vol. 40
2017, Vol. 40

