2. 重庆大学 化工学院, 重庆 400044
2. College of Chemistry and Chemical Engineering, Chongqing University, 400044, P. R. China
地球大气层中臭氧层空洞的不断扩大,致使地面上紫外线的辐射不断增强,对人类及其生存环境也造成了越来越多的不利影响。与此同时高分子材料长期暴露在日光下,受紫外线辐射会引起自动氧化反应,导致聚合物的降解老化,缩短使用寿命。为了防御紫外辐射对材料的危害,光稳定剂的应用范围也随着工业的发展不断扩大。光稳定剂的化合物类型广泛,根据化学结构可以分为苯丙三氮唑、受阻胺类、二苯酮类、水杨酸酯类、三嗪类、氰代丙烯酸酯类及镍螯合物类等[1-3]。其中苯并三氮唑类和受阻胺类是工业上应用最多的品种。而苯并三氮唑类化合物由于其低毒性、吸收范围广、吸收效率高、稳定、与其他材料相容性好等优点,使其成为各种塑料中最常用、最有效的紫外光稳定剂[4-6]。
苯并三氮唑类化合物由于分子中具有3个氮原子的杂环而呈现独特的物理化学性质,如丰富的多齿配位模式,潜在的荧光性,因此在药品、紫外线吸收剂、光稳定剂、防腐剂及农药等方面有广泛的结构基础[7-8],也吸引了越来越多研究人员的关注[9-11]。Wang等[12-14]合成了新型的苯并三氮唑化合物作为铜缓蚀剂,在金属铜表面形成一层分子膜,以达到抑制金属分子腐蚀反应的效果。Khalid[15]以苯并三氮唑为基体合成了一种新型的头孢菌素,经过初步的抗菌敏感性测试,其对金黄色葡萄球菌表现出更广泛的抗菌活性。Paramjeet[16]用苯并三氮唑、苯甲酸钠和钾山梨酸酯为前驱体制备了一种具有润滑作用的离子液体,实验结果证明该离子液体构成的三聚体化学物质的形成膜能保护接触表面不受不良磨损,减少摩擦。Gregory[17]通过实验证明,苯并三氮唑和苯并三氮唑代谢物广泛存在于粮食作物、植物以及饮用水中,但其转化产物到目前为止还尚未得到证实,其在植物或消费者中的生物效用也是未知。苯并三氮唑在其他方面的应用研究也在不断得到开发[18-20]。
邻羟基苯基苯并三氮唑类衍生物由于羟基-亚胺基能够发生可逆的光致氢快速迁移而表现互变异构现象[21-24],从而可以发生激发态分子内质子转移(ESIPT, excited state intramolecular proton transfer),具有该特征的化合物通常可作为性能优良的荧光探针或者光致变色材料。虽然已有大量的文献报道此苯并三氮唑类衍生物,但是对于该衍生物的ESIPT性质的研究面临很多科学挑战,只有部分科学家认为此苯并三氮唑类衍生物能够发生ESIPT[25-29],因此,对于该类衍生物在ESIPT性质方面的关注度还不够,更进一步的相关研究报道[30]也较少。研究通过对该衍生物在ESIPT方面已有的报道进行总结,并结合作者多年来对该衍生物的认识,对其研究进展及未来的应用前景做一个详细的阐述。
1 激发态分子内质子转移 1.1 激发态分子内质子转移概念激发态分子内质子转移(ESIPT, excited state intramolecular proton transfer)是化合物异构平衡和氧化还原反应中最基本的现象之一,也是分子动力学理论研究的重要内容,因此它一直是有机光物理、光化学与光生物学的研究重点[31]。激发态分子内的质子转移通常是指某些有机分子在光、热、电等作用下从基态跃迁至激发态后,分子内的给质子基团通过分子内或者分子间的氢键作用与相近的受质子基团(如N、S、O等)在激发态发生分子内质子转移的过程,这个过程通常会有互变异构(tautomerization)现象发生,例如发生烯醇式向酮式的互变异构转变,从而导致发射波长红移[32],即发生Stokes红移。
发生ESIPT必须具备以下条件:1) 在基态时分子内有氢键的存在,但并不是所有具有氢键的化合物都能发生ESIPT,氢键的存在只是发生ESIPT的必要条件,而不是充要条件。2) 产物的能量一定不能高于反应物的能量,也就是说分子内质子转移的过程是放热反应[33-34]。3) 质子受体的碱性和质子供体的酸性都会影响ESIPT的发生,受体与供体的酸碱性直接影响分子的电子密度分布,而激发态电荷密度的变化是发生质子转移的动力。Ferrer[35]和Frey[36]等人提出分子内质子转移是通过质子的大振幅振动完成的,通过测试和比较激发态质子转移的时间与质子转移荧光的时间得出了在各种溶剂中的转移时间,发现与分子的低频振动周期是一致的。Swimey等人也得出了类似的结论。ESIPT的发生与化合物分子的电子和结构重组,与其所处溶剂的环境有很大的关系[37]。
1.2 具有激发态分子内质子转移能力的化合物简介在激发态能够进行分子内质子转移的化合物包含单官能和双或更多官能团化合物[38-40],其中两性双官能分子通常表现出很强的碱性或者酸性,而且易进行光致异构化反应,在受到激发后能表现出与单官能化合物相异性质。
激发态分子内质子转移的过程中起主要作用的是质子,质子被转移以后生成了相应的光致异构体,并且回到基态以后还可以发生反向的异构化反应,回到最初时的结构,这也就是经常所说的四级循环反应过程,如图 1所示
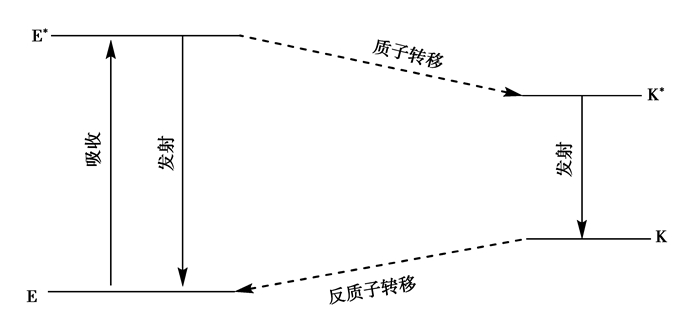
|
图 1 ESIPT体系的四级反应过程图 Figure 1 Four levels process of the excited state intramolecular proton transfer (ESIPT) |
氢键的存在是激发态分子内质子转移发生的前提条件,具有ESIPT性质的化合物作为有机材料在拉曼滤色片,聚合物稳定剂和三重态猝灭剂等化学领域有很大的应用价值[41-44],目前还可以用来了解蛋白质的结合性质,对蛋白激酶CK2全酶活性分析也有很大的用处,故还可以用作生物分子的光学探针。
2 苯并三氮唑类光稳定剂 2.1 苯并三氮唑类光稳定剂简介苯并三氮唑类光稳定剂是世界上销售量最大的紫外线吸收剂[45]。2002年,西欧、北美和日本等国家和地区共消费苯并三氮唑类光稳定剂5 900 t,为羟基二苯甲酮类紫外线吸收剂消费量的2.3倍。
① 苯并三氮唑(BTA)类光稳定剂的化学结构通式Ⅰ,如图 2所示
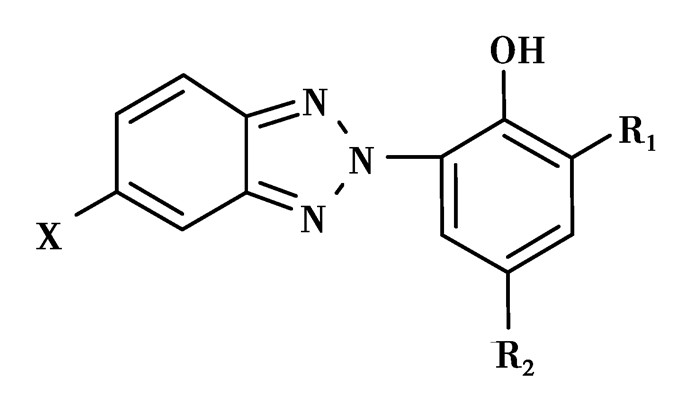
|
图 2 苯并三氮唑类化合物的结构通式Ⅰ Figure 2 The general chemical structure Ⅰ of benzotriazole derivatives 其中X=H, Cl等;R1=H, C4—C12烷基异构体等;R2=CH3, C4—C8烷基异构体等 |
取代基不同就形成了不同性能和不同牌号的光稳定剂,比如:
UV-326:X=Cl,R1= C(CH3)3,R2=CH3;
UV-327:X=Cl,R1= C(CH3)3,R2=C(CH3)3;
UV-P:X=H,R1=H,R2=CH3;
UV-5411:X=H,R1=H,R2=C(CH3)2CH2C(CH3)3;
② 苯并三氮唑类光稳定剂除了化学通式Ⅰ之外,还有另外一种类型化学结构式,可以用通式Ⅱ表示,如图 3所示
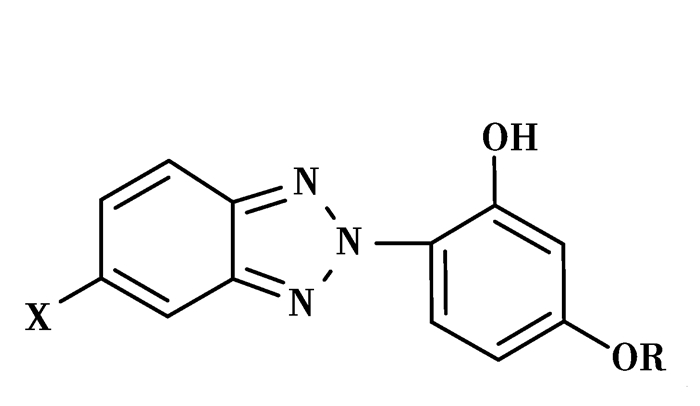
|
图 3 苯并三氮唑类化合物的结构通式Ⅱ Figure 3 The general chemical structure Ⅱ of benzotriazole derivatives 其中X=H, Cl, Br;R=H, C1—C12烷基, (CH2)3COOH等 |
Ⅰ型苯并三氮唑类光稳定剂和Ⅱ型合成工艺区别主要在于:Ⅰ型偶合时以烷基酚为原料,而Ⅱ型则以间苯二酚为原料,得到母体2-(2’, 4’-二羟基苯基)苯并三唑后,4’-羟基再烷基化得到最终产物。
③ 物化性质[45]:苯并三氮唑类光稳定剂具有颜色浅、低毒性、耐油性、低挥发性以及与聚合物相容性比较好等物理特性。颜色一般多为白色或者浅黄色,形状为粉末或者晶体,易溶于二氯甲烷、苯、丙酮等常用有机溶剂,不溶于水。苯并三氮唑类光稳定剂具有好的光化学特性,它可以吸收280~400 nm波长范围的紫外线,从基态跃迁到激发态,并把所吸收的能量以热能等形式释放或消耗掉。苯并三氮唑类光稳定剂还可以与高分子材料进行聚合,生成分子量相对较高的光稳定剂,还可以与受阻胺类光稳定剂协同作用来减缓有机合成制品的氧化程度。苯并三氮唑类化合物由于对近紫外线有最大范围的吸收,所以使其成为目前市场上首选的紫外线吸收剂。
苯并三氮唑类光稳定剂吸收紫外线的原理如下图 4所示
|
图 4 苯并三氮唑类紫外吸收剂吸收紫外线原理 Figure 4 Principle of benzothriazole ultraviolet ray absorbent absorb ultravioletray |
最早开发利用苯并三氮唑类紫外线稳定剂是瑞士的CIBA-GEIGY公司在1965年提出的,中国20世纪60年代开始研制该类产品,1968年国家投入巨资生产该类紫外线稳定剂,其后随着经济的发展,目前国内已经有大约10家生产苯并三氮唑类紫外线稳定剂的厂家,年产量约2 000 t。目前美国、欧洲、日本、中国为全球主要的消费市场,美国占光稳定剂消费市场的20%,欧洲占25%,中国占15%,日本为8%。美国、欧洲、日本光稳定剂消费年均增长率在0.5%~3%左右,但是中国年平均增长率超过8%,中国的消费市场正在飞速扩大,预计在不久的将来,有望超过美国成为世界第一光稳定剂消费大国[46]。
UV-P等苯并三氮唑类紫外线稳定剂能有效地吸收280~340 nm的紫外线,几乎不吸收可见光,其生产和应用工艺成熟,原料易得,生产成本相对较低,所以UV-P的产销会经久不衰。
不同苯并三氮唑类化合物的合成工艺是相似的,它们都是以邻硝基苯胺及其衍生物为原料,在酸性条件下用亚硝酸钠进行重氮化,得到了重氮盐溶液;重氮盐再和苯酚的衍生物发生偶合反应,得到紫红色或者黑色的偶氮化合物(或称染料),然后偶氮化合物再还原闭环,就可以得到最终产物。
苯并三氮唑类紫外线稳定剂的合成过程中,中间体偶氮染料的合成技术已经基本成熟,可以高效率大批量的生产,但其还原技术一直是工业界的研究热点,也是合成苯并三氮唑类紫外光稳定剂的核心技术,尤其在还原反应的过程中如何创造条件,尽量减少副反应的发生,从而提高产品的收率和质量,这是核心技术的关键。
在还原的过程中,按照使用的还原剂的不同,可以分为一步还原法和二步还原法,一步还原法就是用还原剂将偶氮染料中间体直接还原为产品;二步还原法是用还原剂先把偶氮染料还原为氮氧化合物,然后再进一步还原为最终产品(见图 5)。
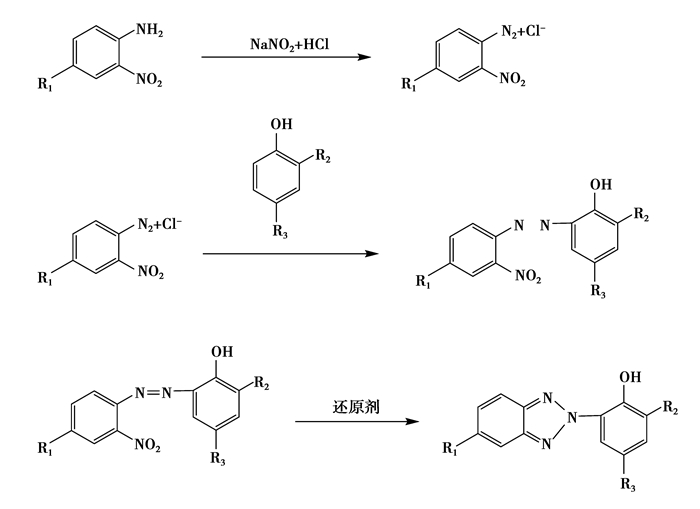
|
图 5 苯并三氮唑类衍生物合成技术路线 Figure 5 The synthetic routes of benzotriazole derivatives 其中:R1=H、Cl、Br、烷氧基等;R2=H、烷基等;R3=H、烷基等。 |
一步还原法有1) 锌粉还原法,这种方法是实验中常用的方法;2) 水合肼还原法;3) 加氢还原法;4) 氢转移剂还原法等。
二步还原法主要包括1) 硫化钠锌粉还原法,硫化钠是第一步还原剂,锌粉是二步还原剂;2) 水合肼锌粉还原法,水合肼是第一步的还原剂,锌粉是二步还原剂;3) 葡萄糖锌粉法;4) 水合肼加氢还原法等。
由于还原反应很剧烈,大量的实验表明,用一步还原法很难控制反应,达不到很好的效果;相反用二步还原法,合成氧化物的条件比较温和,而且氧化物比较稳定些,不易破坏所生成的胺类化合物。
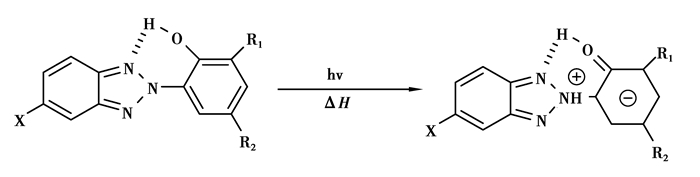
3 ESIPT苯并三氮唑类衍生物的激发态性质激发态分子内质子转移在化学和生物领域是一个非常重要的反应,自Weller[47-48]对甲基水杨酸的荧光性进行研究以后,ESIPT已经受到了光化学、光物理以及光生物等领域的广泛关注。ESIPT反应过程在光的作用下烯醇-酮式的互变异构是通过一个五元环[49-50]或者六元环[51]的4级循环过程进行的,在一些不同寻常的系统反应中甚至还有七元环的情况[52]。ESIPT的结果就是在荧光发射光谱中出现一个分裂的双发射峰,并且第二发射峰出现大的Stokes位移,这主要是因为吸收是从E→E*,而发射却从K*→K的过程。
苯并三氮唑类化合物除了在常温下能发生质子转移以外,在低温下(77K)还可以发生磷光,并且随着照射时间的延长,磷光强度会随之增加直至到达一个平衡值为止[53-54],磷光方程可以用图 6来表示:在图 6中看到closed form (C)和open form (O)之间存在一个平衡,当在激发态S1(C)时是不可能看见磷光的,因为它会随高效而迅速的分子内质子转移过程衰竭掉。如果观察到了磷光,那么在光激发之前分子内的氢键桥肯定已经被破坏,就如open form (O)所示,在S1(O)状态下,ESIPT过程是不可能发生的,基态更倾向于ISC发生三级跃迁,从而产生磷光。在磷光发射的整个过程中存在4个反应式
| $ \begin{array}{*{20}{l}} {{\rm{C}} \longrightarrow {{\rm{C}}^*}({{\rm{K}}_{{\rm{abs}}}});}\\ {{{\rm{C}}^{\rm{*}}} \longrightarrow {\rm{ C}}({{\rm{K}}_{\rm{1}}});}\\ {{{\rm{C}}^{\rm{*}}} \longrightarrow {\rm{O(}}{{\rm{K}}_{\rm{2}}}{\rm{)}};}\\ {{\rm{O }} \longrightarrow {\rm{C(}}{{\rm{K}}_{{\rm{rel}}}})} \end{array} $ |
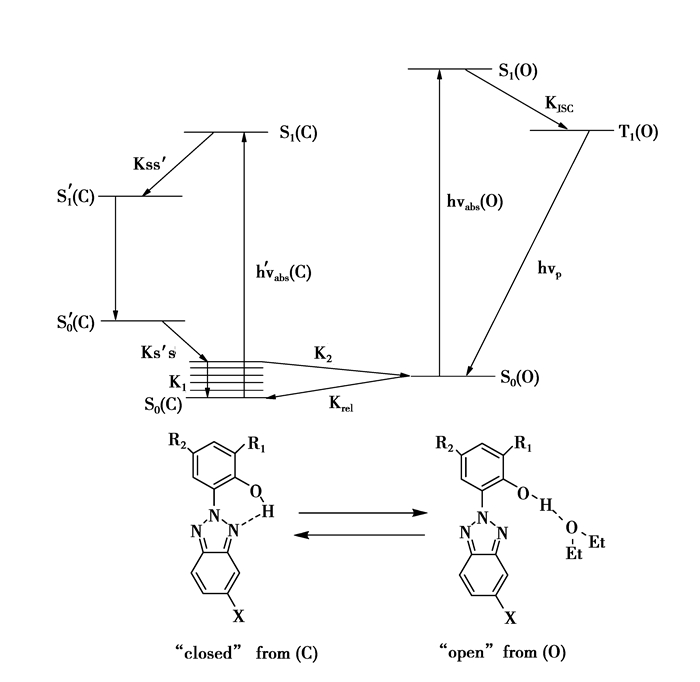
|
图 6 苯并三氮唑类化合物的Jablonski示意图[25] Figure 6 Jablonski Scheme for the Interpretation of Phosphorescence Evolution in 2-(2-hydroxyphenyl) benzotriazoles |
反应式(1) 中表示的是化合物在稳定的基态S0(C)通过光激发跃迁到了激发态S1(C),然后接着发生了分子内质子转移过程,即S1(C)→S1’(C),然后S1’(C)态不再跃迁就形成了C*,这也就是分子式(1) 中所表示的C→C*的过程,尽管C*的特性对整个反应模型的影响不是很重要,认为它是一个高能量的激发态,它可以通过反应式(2) 的形式钝化为基态S0(C),也可以利用多余的能量来破坏分子内的螯合键桥重组为开环形式O,这就是反应式(3) 所表示的。C还可以通过反应式(4) 得到恢复。
4 展望随着量子化学理论计算和合成化学的发展,目前对具有ESIPT特性化合物的认识和研究越来越多,对这些化合物的研究主要集中在理论方面,但是仅仅通过理论计算[55]来评价、设计化合物激发态的性能是不够的,还需要通过实验来验证。
关于苯并三氮唑类染料衍生物质子转移的问题,通过理论和实验的研究,得出的是2个截然相反的结论[25-29],因此还需要研究者通过有力的实验结果证明此类染料是否存在ESIPT。文献报道的苯并三氮唑类染料化合物都是在带羟基的苯环上链接烷基或者芳香基团[25-29],但烷基或芳香基的给电子特性会使羟基的酸性降低,从而导致ESIPT发生的几率降低。相反,羟基的酸性可以通过吸电子基团来加强,从而ESIPT反应就会容易发生[29]。总之,对于苯并三氮唑类化合物所具有的ESIPT研究难度较大,实验现象不易捕捉,而且各方对于该类衍生物中是否具有ESIPT及影响ESIPT的因素也存在较多的争论和未知,可见目前从稳态与瞬态实验证明此类衍生物是否能够发生激发态分子内质子转移仍有很大的研究空间,对苯并三氮唑类化合物所具有的ESIPT性质的研究仍将是一个漫长而具有挑战的过程。另一方面,对于ESIPT苯并三氮唑类衍生物,除了在光稳定剂方面的应用,还可利用它特殊的化学特性来研究开发新的、更广泛的应用领域。
| [1] |
张建宇.
苯并三唑类化合物取代基与光稳定性的关系[J]. 湖南化工, 1998, 28(2): 4–6.
ZHANG Jianyu. The relationship between the substituent group of benzotrizole derivatives and light stabilizer[J]. Hunan Chemical Industry, 1998, 28(2): 4–6. (in Chinese) |
| [2] | Cordero R R, Roth P, Georgiev A, et al. Climatology of surface ultraviolet-radiation in valparaiso, Chile[J]. Energy Conversion & Management, 2005, 46(18): 2907–2918. |
| [3] | Samper M D, Fages E, Fenollar O, et al. The potential of flavonoids as natural antioxidants and UV light stabilizers for polypropylene[J]. Journal of Applied Polymer Science, 2013, 129(4): 1707–1716. DOI:10.1002/app.v129.4 |
| [4] |
祝迎花.
苯并三唑类紫外吸收剂的合成工艺研究[J]. 南京理工大学, 2010.
ZHU Yinghua. Study on the synthetic technology of benzotrizole ultraviolet[J]. Nanjing University of Science and Technology, 2010. DOI:10.3969/j.issn.1008-2646.2010.01.001 (in Chinese) |
| [5] | Chen Y L, Shih C Y, Lin H S, et al. A highly efficient UV-C absorber based on theoretical and experimental studies[J]. Journal of the Chinese Chemical Society, 2017, 64: 282–288. DOI:10.1002/jccs.2017.64.issue-3 |
| [6] | Cohen S, Michal K D, Hai H H, et al. Engineering of UV-absorbing polypropylene films containing poly (2-(2'-hydroxy-5'-methacryloxyethylphenyl)-2H-benzotriazole) nanoparticles[J]. Polymers Advanced Technologies, 2017, 28: 897–904. DOI:10.1002/pat.v28.7 |
| [7] |
汤冬. 五元、六元氮杂环化合物的合成研究[D]. 兰州: 兰州大学, 2016. TANG Dong. Studied on the synthesis of the five-or six-membered heterocycles containing nitrogen[D]. Lanzhou:Lanzhou University, 2016. http://cdmd.cnki.com.cn/Article/CDMD-10730-1016725683.htm |
| [8] |
黄瑞鑫. 世界精细化工产品质量规格手册[M]. 北京: 化学工业出版社, 2000.
HUANG Ruixin. The world fine chemical industry product quality specification manual[M]. Beijing: Chemical Industry Press, 2000. (in Chinese) |
| [9] | Farkas R, Lhiaubetvallet V, Corbera J, et al. Synthesis of new 2-(2'-hydroxyaryl) benzotriazoles and evaluation of their photochemical behavior as potential UV-filters[J]. Molecules, 2010, 15(15): 6205–6216. |
| [10] | Frank W, Juergen K, Martin S, et al. Light-induced opening of the intramolecular hydrogen bond of UV absorbers of the 2-(2-hydroxyphenyl)-1, 3, 5-triazine and the 2-(2-hydroxyphenyl) benzotriazole type[J]. Journal of Physical Chemistry A, 2000, 104(6): 1100–1106. DOI:10.1021/jp993349l |
| [11] | Lu Y, Gong Y L, Ma H Y, et al. 4-formyl-2-(2H-benzotriazol-2-yl-)-phenol:an ESIPT chromophore[J]. Chinese Science Bulletin, 2014, 59(34): 4741–4751. DOI:10.1007/s11434-014-0562-5 |
| [12] | Wang Z Q, Gong Y L, Jing C, et al. Synthesis of dibenzotriazole derivatives bearing alkylene linkers ascorrosion inhibitors for copper in sodium chloride solution:A newthought for the design of organic inhibitors[J]. Corrosion Science, 2016, 113: 64–77. DOI:10.1016/j.corsci.2016.10.005 |
| [13] | Gong Y L, Wang Z Q, Gao F, et al. Synthesis of new benzotriazole derivatives containing carbon chains as the corrosion inhibitors for copper in sodium chloride solution[J]. Industrial & Engineering Chemistry Research, 2015, 54: 12242–12253. |
| [14] | Huang H J, Wang Z Q, Gong Y L, et al. Water soluble corrosion inhibitors for copper in 3.5 wt% sodium chloride solution[J]. Corrosion Science, 2017, 123: 339–350. DOI:10.1016/j.corsci.2017.05.009 |
| [15] | Khalid A A, Nader E, Tarek S.Ibrahim, et al. Benzotriazole-mediated synthesis and antibacterial activity of novel n-acylcephalexins[J]. Scientia Pharmaceutica, 2016, 84: 484–496. DOI:10.3390/scipharm84030484 |
| [16] | Paramjeet S B, Gusain R, Dhawaria M, et al. Antimicrobial and lubrication properties of 1-acetyl-3-hexylbenzotriazolium benzoate/sorbate ionic liquids[J]. RSC Advances, 2016, 6: 46567–46572. DOI:10.1039/C6RA09900A |
| [17] | Gregory H L, Alicia L, Katherine C H, et al. Benzotriazole (BT) and BT plant metabolites in crops irrigated with recycled water[J]. Environmental Science:Water Research & Technology, 2017, 3(2): 179–380. |
| [18] | Sivalingam S, Namhyeon K, Jeong J Y, et al. Benzotriazole-based donor-acceptor type low band gap polymers with a siloxane-terminated side-chain for electrochromic applications[J]. Polymer, 2017, 116: 226–232. DOI:10.1016/j.polymer.2017.03.075 |
| [19] | Wang X L, Li H J, Zhu M, et al. Convenient iodine-mediated aminoselenation of alkenes using benzotriazoles as nitrogen sources[J]. RSC Advances, 2017, 7: 15709–15714. DOI:10.1039/C6RA27202A |
| [20] | Lee M H, Kim J, Kang M, et al. Precise side-chain engineering of thienylenevinylene-benzotriazole-based conjugated polymers with coplanar backbone for organic field effect transistors and cmos-like inverters[J]. American Chemical Society:Applied Materials & Interfaces, 2017, 9: 2758–2766. |
| [21] | Sennikova E V, Borodkina I G, Antsyshkina A S, et al. 2-(2-Pyridyl) indandione-1, 3 and its zinc(ii) and nick(ii) complexes:synthesis and physicochemical characterization[J]. Russian Journal of Inorganic Chemistry, 2006, 51(10): 1548–1551. DOI:10.1134/S0036023606100068 |
| [22] | Negri F, Caminati W. The tautomeric equilibrium of benzotriazole:new evidence from the jet-cooled rotational spectrum and first principles calculations[J]. Chemical. Physics. Letters, 1996, 260(1-2): 119–124. DOI:10.1016/0009-2614(96)00793-2 |
| [23] | Jaroslaw P, Andzelika N, Maria B, et al. Experimental (13C NMR) and theoretical (ab initio molecular orbital calculations) studies on the prototropic tautomerism of benzotriazole and some derivatives symmetrically substituted on the benzene ring[J]. The Journal of Physical Chemistry A, 2007, 111(28): 6501–6509. DOI:10.1021/jp071611h |
| [24] | Leonardo T U, Rodrigo O R, Milton S R, et al. About the benzotriazole tautomerism:an ab initio study[J]. Journal of Molecular Structure:Theochem, 2003, s664-665(2): 207–215. |
| [25] | Fluegge A P, Waiblinger F, Stein M, et al. Probing the intramolecular hydrogen bond of 2-(2-hydroxyphenyl) benzotriazoles in polar environment:a photophysical study of uv absorber efficiency[J]. Journal of Physical Chemistry A, 2007, 111(39): 9733–9744. DOI:10.1021/jp0721189 |
| [26] | Martin J, Michael A, Blancafort L, et al. Mechanism of an exceptional class of photostabilizers:a seam of conical intersection parallel to excited state intramolecular proton transfer (esipt) in o-hydroxyphenyl-(1, 3, 5)-triazine[J]. Journal of Physical Chemistry A, 2005, 109: 7527–7537. DOI:10.1021/jp051108+ |
| [27] | Paterson M, Robb M, Blancafort L, et al. Theoretical study of benzotriazole UV photostability:ultrafast deactivation through coupled proton and electron transfer triggered by a charge-transfer state[J]. Journal of the American Chemical Society, 2004, 126(9): 2912–2922. DOI:10.1021/ja0386593 |
| [28] | Maliakal A, Lem G, Nicholas J, et al. Twisted Intramolecular charge transfer states in 2-arylbenzotriazoles:fluorescence deactivation via intramolecular electron transfer rather than proton transfer[J]. Journal of Physical Chemistry A, 2002, 106(34): 7680–7689. DOI:10.1021/jp021000j |
| [29] | Li H L, Li H R, Yang L, et al. Excited state intramolecular proton transfer fluorescence emission of o-hydroxyphenyl-triazine derivatives[J]. 2011, 56(14):1457~1460. |
| [30] | Gong Y L, Wang Z Q, Zhang S T, et al. New ESIPT-inspired photostabilizers of two-photon absorption coumarin-benzotriazole dyads:from experiments to molecular modeling[J]. Industrial & Engineering Chemistry Research, 2016, 55: 5223–5230. |
| [31] | Rodriguez W, Zugazagoitia J S, Collado E, et al. Excited state intramolecular proton transfer in schiff bases. decay of the locally excited enol state observed by femtosecond resolved fluorescence[J]. The Journal of Physical Chemical A, 2007, 111(28): 6241–6247. DOI:10.1021/jp072415d |
| [32] |
赵春柳, 等.
激发态分子内质子转移有机分子研究进展[J]. 光电子·激光, 1990, 10(4): 380–384.
ZHAO Chunliu, et al. Progress of study on the organic molecules of excited-state int ramolecular proton transfer[J]. Journal of Optoelectronics Laser, 1990, 10(4): 380–384. (in Chinese) |
| [33] | Carter T P, VanBenthem M H, Gilllsple G D. Fluorescence and fluorescence excitation spectra of 1-aminoanthraquinone in an n-heptane shpol'skii matrix[J]. The Journal of Physical Chemical, 1983, 87: 1891–1898. DOI:10.1021/j100234a013 |
| [34] | Carter T P, Gillsple G D, Connolly M A. Intramolecular hydrogen bonding probed by laser-induced fluorescence dihydroxyanthraquinone (quinizarin)[J]. Chemischer Informationsdienst, 1982, 13(18):no-no. |
| [35] | Ferrer M L, Acuña A U, Amat-Guerri F, et al. Proton-transfer lasers from solid polymeric chains with covalently bound 2-(2'-hydroxyphenyl) benzimidazole groups[J]. Apllied Optics, 1994, 33(12): 2266–2272. DOI:10.1364/AO.33.002266 |
| [36] | Frey W, Laermer F, Elsaesser T. Femtosecond studies of excited-state proton and deuterium transfer in benzothiazole compounds[J]. Cheminform, 1991, 95(25): 10391–10395. |
| [37] | Fores M, Duran M, Sola M, et al. Excited-State intramolecular proton transfer and rotamerism of 2-(2'-hydroxyvinyl) benzimidazole and-2-(2'-hydroxyphenyl) imidazole[J]. Journal of Physical Chemistry A, 1999, 103: 4413–4420. DOI:10.1021/jp9844765 |
| [38] | Ireland J F, Wyatt P A H. Acid-Base properties of electronically excited states of organic molecules[J]. Advances in Physical Organic Chemistry, 1976, 12: 131–221. |
| [39] | Alkorta I, Elguero J, Donnadieu B, et al. The structure of 3, 5-bis (trifluoromethyl) pyrazole in the gas phase and in the solid state[J]. New Journal of Chemistry, 1999, 23: 1231–1237. DOI:10.1039/a904292j |
| [40] | Arnaut L, Formosinho S. Excited-state proton transfer reactions Ⅰ. Fundamentals and intermolecular reactions[J]. Journal of Photochemistry Photobiology A Chemistry, 1993, 75(1): 1–20. DOI:10.1016/1010-6030(93)80157-5 |
| [41] | Wu S Z, Luo S J, She W L, et al. All-optical switching effects in poly (methyl methacrylate) composites[J]. Reactive & Functional Polymers, 2003, 56(1): 83–88. |
| [42] | Guo Y X, Li X P, Zheng J J, et al. Excited state proton transfer effect of 7-hydroxyquinoline in dimethyl sulfoxide solvent[J]. Opto-electronics Letters, 2006, 2(2): 115–117. DOI:10.1007/BF03034027 |
| [43] | Yang-Kyoo H, Bong-Soo K. Synthesis of new erasable optical data storage polymers and their applications[J]. Optical Materials, 2002, 21(1): 621–625. |
| [44] | Zhan H B, Chen W Z, Wang M Q. Study on the optical limiting mechanism of metallo-phthalocyanine/silica gel glass composites[J]. Materials Letters, 2005, 59(11): 1395–1399. DOI:10.1016/j.matlet.2004.12.043 |
| [45] |
隋昭德, 李杰, 张玉杰. 光稳定剂及其应用技术[M]. 北京: 中国轻工业出版社, 2010.
SUI Zhaode, Li Jie, ZHANG Yujie. Light stabilizer and its application technology[M]. Beijing: China Light Industry Press, 2010. (in Chinese) |
| [46] |
俞胜华.
光稳定剂行业分析[J]. 北京:科技与企业, 2016(4): 224–224.
YU Shenghua. The analysis of light stabilizer industry[J]. Beijing:Science-Technologe and Enterprise, 2016(4): 224–224. (in Chinese) |
| [47] | Weller Albet. Innermolekularer protonenubergang im angeregten zustand[J]. Zeitschrift FVr Elektrochemie, 2015, 60(9-10): 1144–1147. |
| [48] | Zeng Q G, Ding Z J, Zhang Z M. Synthesis, structure and optical properties of Eu3+/TiO2 nanocrystals at room temperature[J]. Journal of Luminescence, 2006, 118(2): 301–307. DOI:10.1016/j.jlumin.2005.09.002 |
| [49] | Yu W S, Cheng C C, Cheng Y M, et al. Excited-stated intramolecular proton transfer in five-membered hydrogen-bonding systems:2-pyridyl pyrazoles[J]. Journal of the Americal Chemical Society, 2003, 125(36): 10800–10801. DOI:10.1021/ja035382y |
| [50] | Chen C L, Lin C W, Hsieh C C, et al. Dual excited-state intramolecular proton transfer reaction in 3-Hydroxy-2-(pyridin-2-yl)-4H-chromen-4-one[J]. The Journal of Physical Chemistry A, 2009, 113: 205–214. DOI:10.1021/jp809072a |
| [51] | Chen K Y, Hsieh C, Cheng Y, et al. Extensive spectral tuning of the proton transfer emission from 550 to 675nm via a rational derivatization of 10-hydroxybenzo[J]. Chemical Communications, 2006, 42(42): 4395–4397. |
| [52] | Chen K Y, Cheng Y M, Lai C H, et al. Ortho green fluorescence protein synthetic chromophore; excited-state intramolecular proton transfer via a seven-membered-ring hydrogen-bonding system[J]. Journal of the American Chemical Society, 2007, 129(15): 4534–4535. DOI:10.1021/ja070880i |
| [53] | Frank W, Juergen K, Martin S, et al. Light-Induced opening of the intramolecular hydrogen bond of absorbers of the 2-(2-Hydroxyphenyl)-1, 3, 5-triazine and the 2-(2-Hydroxyphenyl) benzotriazole Type[J]. Journal of Physical Chemistry A, 2000, 104: 1100–1106. DOI:10.1021/jp993349l |
| [54] | Martin Stein, Juergen Keck, Frank Waiblinger, et al. Influence of polymer matrixes on the photophysical properties of UV absorbers[J]. Journal of Physical Chemistry A, 2002, 106: 2055–2066. DOI:10.1021/jp012134k |
| [55] | Lin H Y, Chang X P, Yan D P, et al. Tuning excited-state-intramolecular-proton-transfer (ESIPT) process and emission by cocrystal formation:a combined experimental and theoretical study[J]. Chemical Science, 2017, 8: 2086–2090. DOI:10.1039/C6SC04354B |
 2017, Vol. 40
2017, Vol. 40



