BrO3-因具有致癌致突变性而备受关注。国际肿瘤研究机构(IARC)认为饮用水中的BrO3-含量为“微克/升”水平就会产生一定的致癌作用,因此,IARC将BrO3-归入2B级人类可疑致癌物[1]。高剂量的BrO3-摄入能引起动物肾小管损伤;另外,高剂量的BrO3-会带来遗传毒性[2]。中国《生活饮用水卫生标准》(GB 5749—2006)从2007年7月1日开始正式执行,其中明确规定BrO3-的质量浓度不能超过10 μg/L[3]。在淡水环境中,Br-的含量一般较少,但海水与淡水的混合区域,Br-的质量浓度会比较高。据调查统计,中国长江下游水中Br-的质量浓度大于0.2 mg/L,黄河下游水中Br-的质量浓度在0.11~0.2 mg/L之间[4]。大量研究证明,在O3氧化过程中,O3能将Br-直接氧化为BrO3-[5];在O3消毒过程中,除O3直接将Br-氧化为BrO3-外,·OH同样在BrO3-的生成过程中扮演了重要角色。在O3氧化的初始阶段,BrO3-的生成主要是由于·OH的作用,因此BrO3-的量通常增加比较迅速;而在O3氧化的第二个阶段,BrO3-的形成是主要是由于·OH和O3的共同作用,因此BrO3-量的增加比较缓慢[6-7]; 在氯消毒过程中[3],BrO3-由水中的HClO与Br-进行一系列复杂反应生成;在SO4·-氧化体系中,当有Br-存在时,SO4·-和·OH能够与Br-反应,生成Br·、Br2·-和HBrO等一系列含溴的中间产物[8-9]。因此,在有·OH参与的高级氧化过程中,当水体中存在Br-时,BrO3-的生成风险极高。
超声空化氧化技术是一种新兴的和环境友好的高级氧化技术,在抑制(灭活)藻类[10]及降解水中难降解有机污染物的方面展示出了良好的前景[11]。超声空化氧化技术主要利用超声波辐射水体时在水体中产生的高温裂解效应、·OH自由基氧化效应、空化泡共振效应及微射流剪切效应实现对藻类的灭活以及有机物的降解[12]。因此,当水体中存在Br-时,超声水处理过程存在产生BrO3-的风险。而目前,尚无关于超声空化氧化过程中生成BrO3-的系统研究报道,严重影响到了超声水处理技术应用的水质安全性[3, 13]。笔者针对就超声水处理过程中BrO3-生成效能及机理进行研究。
1 材料与方法 1.1 主要试剂与仪器设备溴化钾(分析纯,上海阿拉丁生化科技股份有限公司);溴酸钾(分析纯,上海阿拉丁生化科技股份有限公司);智能恒温水浴槽(宁波新芝DC-0510,中国浙江);超声波发生器(型号分别为F200(200 kHz)、SF400(400 kHz)、SF600(600 kHz)和SF800(800 kHz)),中科院声学研究所东海站,中国上海);离子色谱仪(戴安公司,美国);超纯水机(HITECH)。
实验中所有的玻璃制品都经过仔细的清洗,包括清洁剂洗涤,超声波清洗,纯水冲洗等过程。
1.2 实验装置研究采用的实验装置由超声波发生器以及超声波换能器组成[14]。每次实验时,向反应器中加入200 mL含一定质量浓度Br-的反应液,用1 mol/L的盐酸和1 mol/L的氢氧化钠调节溶液的初始pH为3.00,7.00和11.00,打开超声波发生器,按反应时间不同(0,10,20,30,40,50,60 min)分批处理水样,待处理时间结束后,取50 mL水样,采用离子色谱对其中的无机含溴副产物(BrO3-)进行分析测定。反应器中的温度通过设置水浴温度控制在20 ℃。
1.3 无机含溴副产物(BrO3-)的检测方法研究采用离子色谱(型号:861 Advasnced Compact IC)分析无机含溴副产物:BrO3-。分析条件:Metrosep A Supp7-250阴离子分离柱;RP 2Gard保护柱;柱温45 ℃;淋洗液:3.6 mmol/L的Na2CO3溶液,流速0.7 mL/min;进样量:100 μL。BrO3-的标准曲线方程见表 1。
| 表 1 BrO3-的标准曲线方程 Table 1 The standard curve equation of BrO3- |
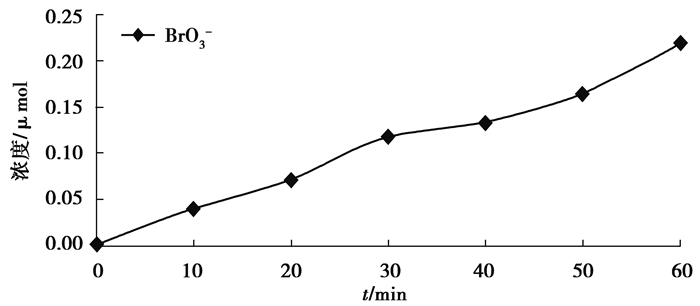
在超声频率为600 kHz,声能密度为0.19 W/mL,温度为20 ℃条件下,对Br-初始浓度为1 mmol的200 mL水样进行超声处理60 min,生成的BrO3-浓度随时间的变化情况见图 1。
|
图 1 超声处理过程中BrO3-的浓度随时间变化图 Figure 1 Time-dependent evolution of BrO3- concentration upon ultrasonic irradiation |
在60 min超声的超声处理中,BrO3-的浓度随时间逐渐增大,并在60 min时达到了0.22 μmol,Br-转化为BrO3-的比例为0.022%,这说明在处理含Br-水时,超声空化氧化过程可以产生BrO3-,验证了之前的猜想,同时也提出来一种新的BrO3-产生途径。水体在一定频率的超声辐射作用下会产生大量空化泡。在超声波正压相和负压相的交替作用下,空化泡在数微秒甚至纳秒内经历绝热的振荡、生长、压缩和破灭整个过程,从而在水溶液中产生局部的高温高压微环境(温度可达5 000 K,压力可达1×108 Pa)。在空化泡破灭的瞬间,进入空化泡的水分子会在极端的高温高压条件下均裂为高活性的自由基(氢原子(·H)、羟基自由基(·OH))[15]。所以超声过程中的BrO3-来自于·OH氧化途径,具体的反应机理推导如下(如反应式(1)~式(11)所示)[16-17]。
| $ {{\text{H}}_2}{\text{O}}\xrightarrow{{超声空化}} \cdot {\text{OH}} + {{\text{H}}^ + } $ | (1) |
| $ {\text{B}}{{\text{r}}^-} + \cdot {\text{OH}} \to {\text{HOB}}{{\text{r}}^{ \cdot-}}, k = 1.06 \times {10^{10}}\;{\text{mol} ^{-1}}{{\text{s}}^{ - 1}}, $ | (2) |
| $ {\text{BrO}}{{\text{H}}^-} \to {\text{B}}{{\text{r}}^ \cdot } + {\text{O}}{{\text{H}}^-}, k = 4.2 \times {10^6}\;{\text{mol} ^{-1}}{{\text{s}}^{ - 1}}, $ | (3) |
| $ {\text{B}}{{\text{r}}^-} + {\text{Br}} \cdot \to {\text{Br}}_2^{ \cdot-}, k = {10^{10}}\;{\text{mo}}{{\text{l}}^{-1}}{{\text{s}}^{ - 1}}, $ | (4) |
| $ {\text{Br}}_2^{ \cdot-} + \cdot {\text{OH}} \to {\text{HOBr}} + {\text{B}}{{\text{r}}^-}, k = 1.0 \times {10^9}\;{\text{mo}}{{\text{l}}^{-1}}{{\text{s}}^{ - 1}}, $ | (5) |
| $ {\text{HOBr}} + \cdot {\text{OH}} \to {\text{BrO}} \cdot + {{\text{H}}_2}{\text{O}}, k = 2.0 \times {10^9}\;{\text{mo}}{{\text{l}}^{-1}}{{\text{s}}^{-1}}, $ | (6) |
| $ {\text{Br}}{{\text{O}}^-} + \cdot {\text{OH}} \to {\text{BrO}} \cdot + {\text{O}}{{\text{H}}^-}, k = 4.5 \times {10^9}\;{\text{mo}}{{\text{l}}^{-1}}{{\text{s}}^{ - 1}}, $ | (7) |
| $ 2{\text{BrO}} \cdot + {{\text{H}}_2}{\text{O}} \to {\text{Br}}{{\text{O}}^-} + {\text{BrO}}_2^-+ 2{{\text{H}}^ + }, k = 4.9 \times {10^9}\;{\text{mo}}{{\text{l}}^{-1}}{{\text{s}}^{ - 1}} $ | (8) |
| $ {\text{Br}}{{\text{O}}^-}_2 + \cdot {\text{OH}} \to {\text{Br}}{{\text{O}}_2} \cdot + {\text{O}}{{\text{H}}^-}, k = 2 \times {10^9}\;{\text{mo}}{{\text{l}}^{-1}}{{\text{s}}^{ - 1}}, $ | (9) |
| $ 2{\text{Br}}{{\text{O}}_2} \cdot \to {\text{B}}{{\text{r}}_2}{{\text{O}}_4}, k = 1.4 \times {10^9}\;{\text{mo}}{{\text{l}}^{-1}}{{\text{s}}^{-1}}, $ | (10) |
| $ {\text{B}}{{\text{r}}_2}{{\text{O}}_4} + {\text{O}}{{\text{H}}^-} \to {\text{BrO}}_3^-+ {\text{BrO}}_2^-+ {{\text{H}}^ + }, k = 7 \times {10^8}\;{\text{mo}}{{\text{l}}^{ - 1}}{{\text{s}}^{ - 1}}。$ | (11) |
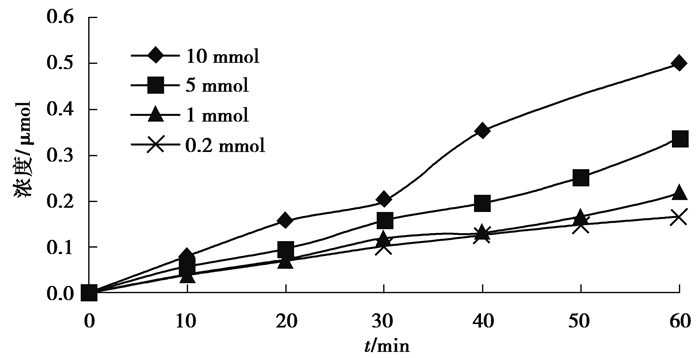
在超声声能密度为0.19 W/mL,频率为600 kHz,温度为20 ℃条件下,用超声波对200 mL不同Br-初始浓度(0.2, 1, 5, 10 mmol)的水样处理60 min,其中BrO3-浓度随时间的变化情况如图 2所示。
|
图 2 Br-初始浓度对BrO3-的影响 Figure 2 The effects of Br- initial concentration on BrO3- generation |
结果显示,在反应时间为60 min时,随着Br-初始浓度的增加,BrO3-的生成量逐渐增加,Br-转化为BrO3-的比例逐渐降低,这与前人关于臭氧氧化过程的相关研究结论是一致的:Tyrovola等[18]发现,在臭氧质量浓度为2 mg/L,作用时间为30 min条件下,Br-质量浓度从0.16 mg/L上升为4.08 mg/L时,BrO3-质量浓度从23 μg/L上升到307 μg/L,相应的Br-转化为BrO3-的比例从8.98%下降到4.70%。这主要是因为:首先,Br-初始浓度越大,意味着就有越多的Br-参与反应生成BrO3-,所以BrO3-生成量会随着Br-初始浓度的增大而增大;其次,BrO3-是由·OH逐步氧化Br-而生成的,该过程会生成很多含溴的中间产物(Br·-2、HBrO、BrO-和BrO2-等),其中BrO2-是生成BrO3-最重要的前体物,而当为Br-浓度增大到一定水平时,虽然被氧化生成的BrO3-量增多了,但另外也有相当一部分Br-仅仅转化为了生成Br·- 2、HBrO和BrO-等中间产物,而这些中间产物及大量的Br-都会与BrO2-争夺·OH,从而形成一种竞争状态,导致Br-转化为BrO3-的比例降低。
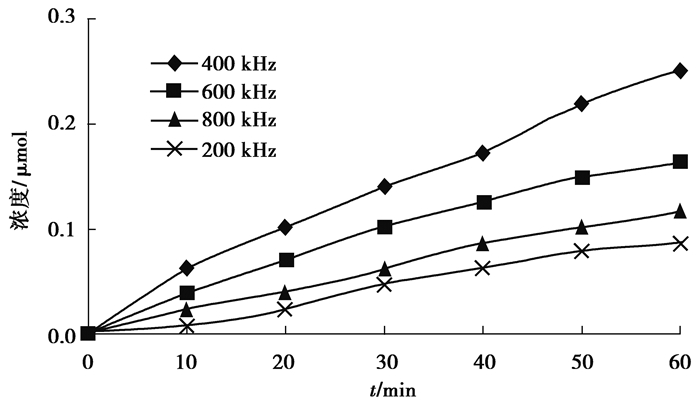
2.2.2 超声频率对BrO3-生成的影响在超声声能密度为0.19 W/mL,Br-初始浓度为1 mmol,温度为20 ℃条件下,用不同频率(200,400,600,800 kHz)的超声波对200 mL水样处理60 min,其中BrO3-浓度随时间的变化情况如图 3所示。
|
图 3 超声频率对BrO3-的影响 Figure 3 The effects of ultrasonic frequency on BrO3- generation |
结果显示,200 kHz时BrO3-生成量最低,400 kHz时BrO3-生成量最高。Yang等[19]的研究发现,在同样超声强度不同超声频率的辐射条件下,水中产生的·OH浓度的顺序为:354>620>803>206>1 062 kHz,这与本研究中BrO3-的生成量400>600>800> 200 kHz相符,说明在BrO3-的生成过程中·OH扮演了主要角色,这也进一步说明在超声空化氧化过程中BrO3-的生成主要是Br-经过·OH氧化而来。
2.2.3 超声声能密度对BrO3-生成的影响在超声频率为600 kHz,Br-初始浓度为1 mmol,温度为20 ℃条件下,用不同声能密度(0.06, 0.12, 0.16, 0.19 W/mL)的超声波对200 mL水样处理50 min,其中BrO3-浓度随时间的变化情况如图 4所示。

|
图 4 超声声能密度对BrO3-的影响 Figure 4 The effects of power density on BrO3- generation |
结果显示,随着超声声能密度的增大,BrO3-生成量先增大后减小。其中的原因为:首先,能量输入的增大使产生的空化泡数量增加,空化泡破裂更加激烈,从而使体系中产生更多的·OH,这促进了BrO3-的生成;其次,当声能密度继续增大到0.19 W/mL时,产生的·OH会更多,氧化能力会更强,使得一部分BrO3-被进一步氧化为BrO4-(如反应式(12)所示),从而使BrO3-表观的生成量降低。
| $ {\text{BrO}}_3^-+ 2 \cdot {\text{OH}} \to {\text{BrO}}_4^-+ {{\text{H}}_2}{\text{O}}。$ | (12) |
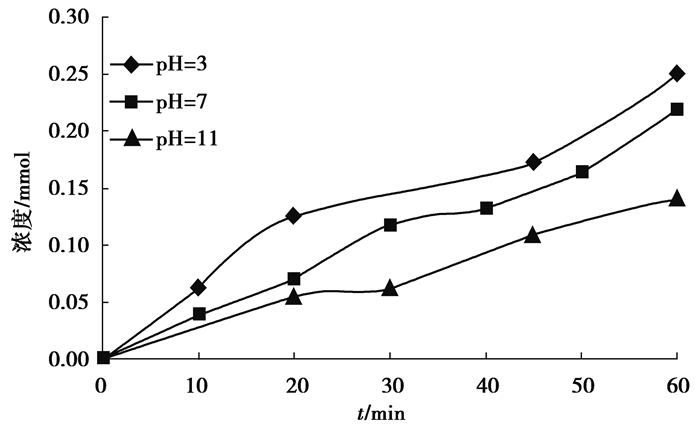
在超声声能密度为0.19 W/mL,频率为600 kHz,Br-初始浓度为1 mmol,温度为20 ℃的不同pH(3.00,7.00,11.00)条件下,对200 mL水样处理60 min,其中BrO3-浓度随时间的变化情况如图 5所示。
|
图 5 pH值对BrO3-的影响 Figure 5 The effects of pH on BrO3- generation |
结果显示,pH=3时,BrO3-的生成量最大,pH=11时,BrO3-的生成量最小。可见,酸性条件下更容易生成BrO3-。这是因为Br·与Br-快速反应生成Br2·-(反应式(4),随后生成HOBr/OBr-;而与此同时,Br·与OH-也快速反应生成BrOH·-(反应式(14))[20]与Br-生成竞争,尽管BrOH·-也与Br-反应生成Br2·-(反应式(15)),但该反应的速率比Br-与Br·反应的速率慢50倍,因此在高pH时,HOBr/OBr-的生成变慢,从而使得BrO3-的生成量降低。
| $ {\text{B}}{{\text{r}}^-} + {\text{Br}} \cdot \to {\text{Br}}_2^{ \cdot-}, k = {10^{10}}\;{\text{mo}}{{\text{l}}^{-1}}{{\text{s}}^{ - 1}}, $ | (13) |
| $ {\text{Br}} \cdot + {\text{O}}{{\text{H}}^-} \to {\text{BrOH}}{ \cdot ^-}, k = 1.3 \times {10^{10}}\;{\text{mo}}{{\text{l}}^{-1}}{{\text{s}}^{ - 1}}, $ | (14) |
| $ {\text{BrOH}}{ \cdot ^-} + {\text{B}}{{\text{r}}^-} \to {\text{Br}}_2^{ \cdot-} + {\text{O}}{{\text{H}}^ - }, k = 2 \times {10^8}\;{\text{mo}}{{\text{l}}^{ - 1}}{{\text{s}}^{ - 1}}。$ | (15) |
本次实验对Br-存在条件下超声空化氧化过程中BrO3-的生成机理及反应条件对BrO3-生成的影响进行了研究,结果发现:
1) BrO3-生成量随Br-初始浓度的增加而增加,而Br-转化率却随Br-初始浓度的增加而减小,这是因为虽然较多的Br-使得BrO3-生成量增多,过多的Br-会与生成BrO3-的BrO-、BrO2-等中间产物争夺·OH。
2) BrO3-的生成量随超声频率的变化的大小关系为:400 kHz>600 kHz>800 kHz>200 kHz,这与超声空化氧化过程中·OH生成量随频率变化的大小一致,说明超声过程中BrO3-的生成主要依靠·OH氧化。
3) 超声声能密度从0.06 W/mL增大为0.19 W/mL时,BrO3-生成量先增大后减小。而BrO3-生成量在0.19 W/mL时反而减小主要因为声能密度增大使体系中的·OH增多,氧化能力增强,将BrO3-进一步氧化成了BrO4-。
4) 酸性条件下BrO3-的生成量较大,而碱性条件下BrO3-的生成量较小。这主要是因为OH-与Br-竞争Br·,使得HOBr/OBr-的生成变慢,导致BrO3-生成量较小。
5) 超声过程中的生成机理符合·OH氧化途径。
| [1] | Liu D, Wang Z, Zhu Q, et al. Drinking water toxicity study of the environmental contaminant:Bromate[J]. Regulatory Toxicology and Pharmacology, 2015, 73(3): 802–810. DOI:10.1016/j.yrtph.2015.10.015 |
| [2] | Xiao Q, Yu S, Li L, et al. An overview of advanced reduction processes for bromate removal from drinking water:Reducing agents, activation methods, applications and mechanisms[J]. Journal of Hazardous Materials, 2017, 324(part B): 230–240. |
| [3] | Heeb M B, Criquet J, Zimmermann-Steffens S G, et al. Oxidative treatment of bromide-containing waters:Formation of bromine and its reactions with inorganic and organic compounds:A critical review[J]. Water Research, 2014, 48(1): 15–42. |
| [4] |
李波, 曲久辉, 刘会娟, 等.
含溴离子水氯化过程中消毒副产物生成和分配研究[J]. 科学通报, 2007, 52(17): 2071–2076.
LI Bo, QU Jiuhui, LIU Huijuan, et al. Study on formation and distribution of disinfection by-products in chlorination of brominated ion[J]. Chinese Science Bulletin, 2007, 52(17): 2071–2076. DOI:10.3321/j.issn:0023-074x.2007.17.016 (in Chinese) |
| [5] | Lu N, Wu X, Zhou J, et al. Bromate oxidized from bromide during sonolyticozonation[J]. Ultrasonics Sonochemistry, 2015, 22: 139–143. DOI:10.1016/j.ultsonch.2014.05.024 |
| [6] | Wang X, Liu L, Fang W, et al. Theoretical insight towards the photo-dissociation dynamics of O3-H2O complex:Deep understanding the source of atmospheric hydroxyl radical[J]. Chemical Physics Letters, 2014, 608: 95–101. DOI:10.1016/j.cplett.2014.05.083 |
| [7] | Sharma V K, Zboril R, Mcdonald T J. Formation and toxicity of brominated disinfection byproducts during chlorination and chloramination of water:A review[J]. Journal of Environmental Science and Health Part B-pesticides Food Contaminants and Agricultural Wastes, 2014, 49(3): 212–228. |
| [8] |
刘阔, 金浩, 董为, 等.
钴活化过一硫酸盐氧化过程中卤代副产物的生成[J]. 环境科学, 2016, 37(5): 1823–1830.
LIU Kuo, JIN Hao, DONG Wei, et al. The formation of halogenated by-products during the oxidation of cobalt-activated[J]. Environmental Science, 2016, 37(5): 1823–1830. (in Chinese) |
| [9] | Yang Y, Pignatello J J, Ma J, et al. Comparison ofhalide impacts on the efficiency of contaminant degradation by sulfate and hydroxyl radical-based advanced oxidation processes (AOPs)[J]. Environmental Science & Technology, 2014, 48(4): 2344–2351. |
| [10] | Rajasekhar P, Fan L, Thong N, et al. A review of the use of sonication to control cyanobacterialblooms[J]. Water Research, 2012, 46(14): 4319–4329. DOI:10.1016/j.watres.2012.05.054 |
| [11] | Sathishkumar P, Mangalaraja R V, Anandan S. Review on the recent improvements in sonochemical and combined sonochemical oxidation processes:A powerful tool for destruction of environmental contaminants[J]. Renewable & Sustainable Energy Reviews, 2016, 55: 426–454. |
| [12] | Bhangu S K, Ashokkumar M. Theory of Sonochemistry[J]. Topics in Current Chemistry, 2016, 374(4): (UNSP 564). |
| [13] | Bergmann M E H, Koparal A S, Iourtchouk T. Electrochemicaladvanced oxidation processes, formation of halogenate and perhalogenatespecies:A critical review[J]. Critical Reviews in Environmental Science and Technology, 2014, 44(4): 348–390. DOI:10.1080/10643389.2012.718948 |
| [14] |
姚娟娟, 高乃云, 王成金.
水中离子对超声降解2种有机磷农药的影响机理[J]. 重庆大学学报, 2010, 33(6): 13–19.
YAO Juanjuan, GAO Naiyun, WANG Chengjin. Effects of ion on the degradation of two organophosphorus pesticides by ultrasonic[J]. Journal of Chongqing University, 2010, 33(6): 13–19. DOI:10.11835/j.issn.1000-582X.2010.06.003 (in Chinese) |
| [15] | Li H W, Zhao SS. Analysis on influencing factors of degradation of water treatment with ultrasonic wave based on GPC[J]. Applied Mechanics and Materials, 2014, 484/485: 501–506. DOI:10.4028/www.scientific.net/AMM.484-485 |
| [16] | Janda V, Kastl G, Pivokonsky M, et al. Oxyanions ofhalogens in drinking water[J]. Chemicke Listy, 2015, 109(5): 360–363. |
| [17] | Fang J, Zhao Q, Fan C, et al. Bromate formation from the oxidation of bromide in the UV/chlorine process with low pressure and medium pressure UV lamps[J]. Chemosphere, 2017, 183: 582–588. DOI:10.1016/j.chemosphere.2017.05.136 |
| [18] | Tyrovola K, Diamadopoulos E. Bromate formation during ozonation of groundwater in coastal areas in Greece[J]. Desalination, 2005, 176(1/2/3): 201–209. |
| [19] | Yang L, Sostaric J Z, Rathman J F, et al. Effect of ultrasound frequency on pulsed sonolytic degradation of octylbenzene sulfonic acid[J]. Journal ofPhysical Chemistry B, 2008, 112(3): 852–858. DOI:10.1021/jp077482m |
| [20] | Fang J, Shang C. Bromate formation from bromide oxidation by the UV/persulfateprocess[J]. Environmental Science & Technology, 2012, 46(16): 8976–8983. |
 2018, Vol. 41
2018, Vol. 41


