2. 兰州理工大学 石油化工学院, 兰州7300050;
3. 兰州陇垦建筑工程勘察设计有限公司, 兰州 730000
2. College of Petrochemical Technology, Lanzhou University of Technology, Lanzhou 730050, P. R. China;
3. Lanzhou Longken Construction Engineering Survey and Design Co., Ltd., Lanzhou 730000, P. R. China
重金属污染已成为当今世界倍受关注的一类公害[1-3]。重金属铅可以在人体蓄积,进入人体血液,破坏儿童的神经系统[4]。常用的去除废水中Pb(Ⅱ)的方法有离子还原、共沉淀、膜过滤、离子交换和吸附等[5]。其中,吸附法由于成本低、操作简单、容易再生等优点,在含pb (Ⅱ)废水处理中应用最广[6-7]。目前,处理废水中Pb(Ⅱ)吸附剂种类主要有活性炭、粘土、泥煤、壳聚糖、生物质等,而新型廉价吸附剂材料的开发与应用是目前国内外研究的热点[8-10]。很多学者研究了关于原生粘土矿物或改性粘土对重金属的去除性能[11-16]。其中蒙脱土(MMT, montmorillonite)是应用最广泛的粘土矿物,是由硅氧四面体和铝氧八面体所组成的层状结构的硅酸盐, 高的阳离子交换容量、大的比表面积和微观分层结构表明,钠基蒙脱土具有良好的吸附能力[17]。郭堃梅等[18]研究了天然蒙脱土吸附重金属Pb(Ⅱ)的主要影响因素及吸附机理, 当初始浓度小于20 mg/L时,去除率达到99%,吸附受吸附剂用量、振荡时间、以及溶液pH值的影响。Sidi Zhu等[19]研究了通过在钠基蒙脱土层中加入赖氨酸,制备了新型吸附剂L-Mt,分子动态模拟揭示了赖氨酸和钠基蒙脱土之间的微观结构和相互作用,L-Mt对Pb(Ⅱ)的饱和吸附能力高于钠基蒙脱土。KatayoonKalantari等[20]研究了合成的Fe3O4/MMT材料,对Cu(Ⅱ)、Ni(Ⅱ)和Pb(Ⅱ)的吸附能力都很大,饱和吸附量分别达到70.92、65.78和263.15 mg/g。Ana-Maria Georgescu等[21]用Cr (Ⅲ)改性蒙脱土,制备了Cr (Ⅲ)柱撑蒙脱土多孔纳米材料,基体间距和比表面积随材料制备参数的变化而变化,合成的纳米材料对水溶液中Pb(Ⅱ)具有良好的吸附性能。Liang等[22]以碳酸钙为制孔剂,制备凹凸棒基多孔材料,该材料表面润湿性可以在疏水和亲水之间可逆调控,因此既可以分离水体中的油/有机物,又可以吸附重金属离子,且吸附容量高。若采用碳酸钙对蒙脱土进行致孔改性,势必能够充分发挥蒙脱土的优良吸附性能,但是此方面的研究尚不多见。研究用碳酸钙改性钠基蒙脱土,制备多孔蒙脱土材料(PM),分析PM对Pb(Ⅱ)的吸附动力学模型和等温线模型,以及溶液pH值对PM吸附Pb(Ⅱ)的影响,探讨其吸附机理,以期为废水中Pb(Ⅱ)的去除提供实验依据和理论指导。
1 材料与方法 1.1 材料与仪器主要材料:钠基蒙脱土(MMT)(型号:PGN,CEC:120 meq/100 g)为工业级,硝酸铅(Pb(NO3)2)、碳酸钙(CaCO3)、盐酸(HCl)等化学品均为分析纯,实验用水为去离子水。1 000 mg/L的Pb(Ⅱ)储备液使用pb(NO3)2配制。
主要仪器:INESA型超声波机(上海仪电分析仪器有限公司);CJJ-931型磁力搅拌器(江苏金坛市环宇科学仪器厂);GZX9140MBE型鼓风干燥箱(上海博迅实业有限公司医疗设备厂);AA800型原子吸收光谱仪(美国Perkin Elmer);TGL-16C型离心机(上海安亭科学仪器厂);SHA-BA型恒温水浴振荡器(金坛荣华);LA-pH10 pH计(哈希公司)。
1.2 多孔蒙脱土材料(PM)的制备 1.2.1 PM的制备称取20 g蒙脱土,加入200 mL去离子水,常温下搅拌36 h,再加入10 g碳酸钙,继续搅拌72 h,超声4 h。放入鼓风干燥箱中,90 ℃干燥,把完全干燥好的材料放入管式炉中,600 ℃加热,加热率为5 ℃/min,连续通氮气1 h。再将所得材料浸泡在1 mol/L的盐酸中24 h,去除CaCO3,用去离子水清洗,直到没有Cl-被检测到为止。在90 ℃下干燥,研磨过100目筛,得到PM材料。
1.2.2 表征方法用日本JEOL公司生产的JSM-6480A型扫描电子显微镜(SEM)对样品的形貌进行分析,用美国Nicolet IR-NexuS670型傅立叶变换红外光谱仪(FTIR)在4000~400 cm-1范围内扫描,用日本Rigaku D/max-TTR-Ⅲ系列X射线衍射仪(XRD)对晶体结构进行分析。
1.3 吸附实验 1.3.1 吸附动力学的测定分别称取质量为100 mg的PM于14个锥形瓶中,加入200 mg/L的Pb(Ⅱ)溶液100 mL,用0.1 mol/L的HNO3或NaOH调节pH为5.5,置于摇床上,25 ℃,180 r/min分别震荡10、20、40、60、90 min,2、2.5、3、3.5、4、6、8、12、24 h后取出,过滤离心,测定上清液中Pb(Ⅱ)质量浓度,并根据公式(1),计算吸附容量qe,mg/g
| $ {q_{\rm{e}}} = \frac{{\left( {{c_0} - {c_{\rm{e}}}} \right) \times v}}{m}, $ | (1) |
式中:c0为Pb(Ⅱ)初始浓度,mg/L;ce为吸附后溶液中Pb(Ⅱ)浓度,mg/L;m为吸附剂质量,g;v为Pb(Ⅱ)溶液体积,L。
1.3.2 吸附等温线的测定称取质量为100 mg的PM,分别加入浓度为30~400 mg/L的Pb(Ⅱ)溶液100 mL,调节pH至5.5,置于摇床上,25 ℃,180 r/min震荡24 h后取出,过滤离心,测定上清液中Pb(Ⅱ)质量浓度,计算吸附容量qe,mg/g。
1.3.3 pH值对Pb(Ⅱ)吸附的影响分别称取质量为100 mg的PM于10只锥形瓶中,加入200 mg/L的Pb(Ⅱ)溶液100.00 mL,分别调节pH为2、2.5、3、3.5、4、4.5、5、5.5、6、7,置于摇床上,25 ℃,180 r/min震荡24 h后取出,过滤离心,测定上清液中Pb(Ⅱ)质量浓度,计算吸附容量qe,mg/g。
2 结果与讨论 2.1 PM的形貌结构特征材料的微观形貌如图 1所示,蒙脱土呈层状结构,PM具有发达的孔隙结构。由此可以推断,蒙脱土分散液中加入碳酸钙,干燥,后经管式炉加热,再经盐酸浸泡并且清洗之后,和蒙脱土相比,PM结构发生了改变,发达的孔道使PM具有更大的比表面积。

|
图 1 MMT和PM扫描电镜图 Fig. 1 SEM images of MMT and PM |
材料的红外谱图如图 2所示,从MMT的红外谱图中可知,在3 634 cm-1的吸收峰为蒙脱土本身含有的结合水的伸缩振动峰,3 428 cm-1的吸收峰为蒙脱土Si-OH及Al-0H的分子内氢键羟基缔合峰所致,1 641 cm-1的吸收峰为-OH键的弯曲振动峰,1 424 cm-1和1 038 cm-1为蒙脱土Si-O伸缩振动峰,400~600 cm-1的吸收峰为Si-O和Al-0的弯曲振动峰。从PM的红外图谱中可知,PM出现了蒙脱土的特征吸收峰。
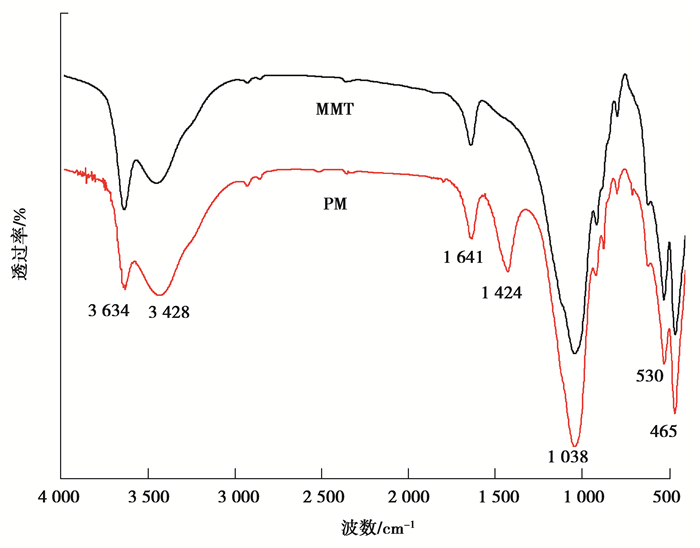
|
图 2 MMT和PM的FTIR图 Fig. 2 FTIRspectra of MMT and PM |
MMT和PM的XRD如图 3所示,MMT在2θ为5°~70°出现了6个特征衍射峰,PM具备MMT的所有衍射峰,表明加入碳酸钙致孔剂,经管式炉加热,盐酸浸泡,和MMT相比PM晶体结构未发生改变。
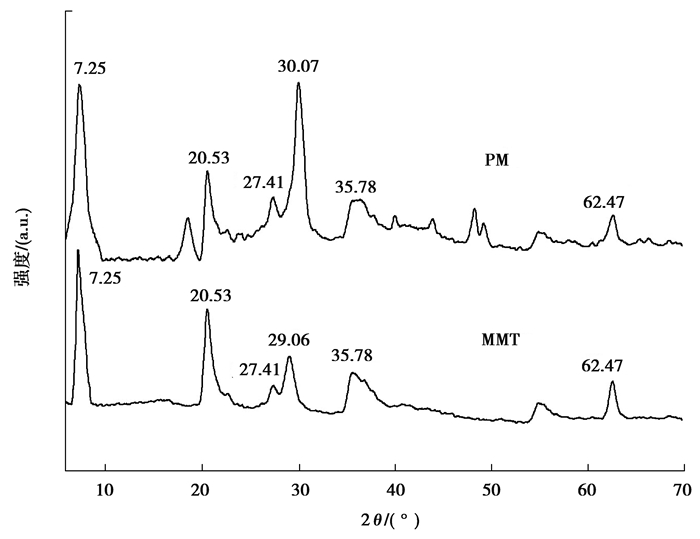
|
图 3 MMT和PM的XRD图 Fig. 3 XRD patterns of MMT and PM |
图 4显示了PM在初始Pb(Ⅱ)浓度为200 mg/L的溶液中不同接触时间的吸附。很容易看出,从0~120 min,吸附能力随接触时间的增加而迅速增加,180 min后吸附量稳定,达到了平衡。吸附180 min后,PM对Pb(Ⅱ)的吸附量达到146.1 mg/g。延长接触时间不能显著提高Pb(Ⅱ)的吸附量。
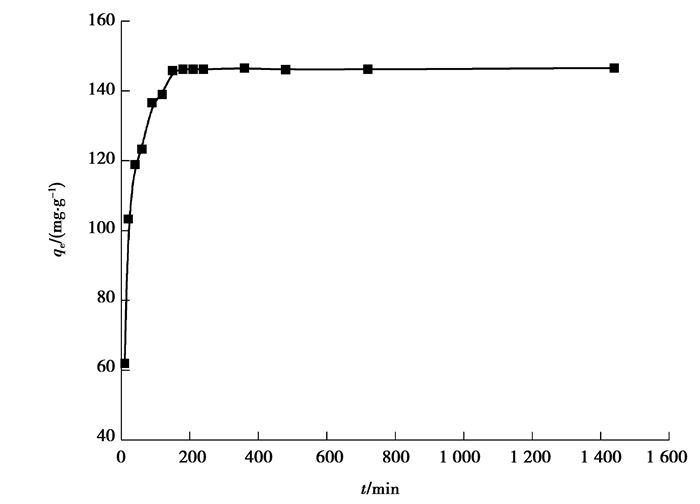
|
图 4 Pb(Ⅱ)吸附量与吸附时间的关系 Fig. 4 The relationship between adsorption capacity and adsorption time on Pb(Ⅱ) |
为了研究吸附机理,应用准一级动力学方程(式(2))和准二级动力学方程(式(3))对实验数据进行模拟
| $ \ln \left( {{q_{\rm{e}}} - {q_{\rm{t}}}} \right) = \ln {q_{\rm{e}}} - {k_1}t, $ | (2) |
| $ \frac{t}{{{q_{\rm{t}}}}} = \frac{1}{{{k_2}q_{\rm{e}}^2}} + \frac{1}{{{q_{\rm{e}}}}}t, $ | (3) |
式中:k1为准一级动力学模型吸附速率,min-1;qt和qe分别为t时刻的吸附容量和吸附平衡时的吸附容量,mg/g;k2为准二级动力学模型吸附速率,g/(mg·min);t为吸附时间,min。
从图 5和表 1可以得出,准二级动力学模型相关系数R2优于准一级动力学模型,且计算吸附量与实验数据更接近,说明PM吸附溶液中Pb(Ⅱ)的过程中,发生了电子转移或共享,主要受化学吸附的控制[23]。
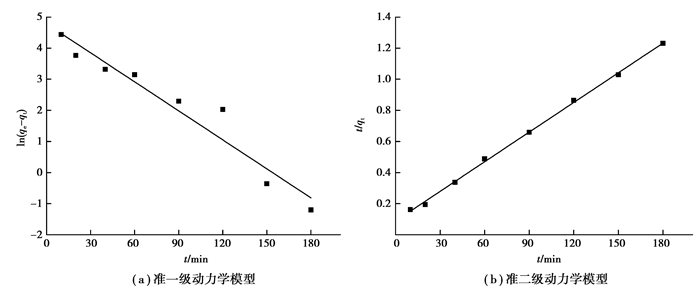
|
图 5 PM对Pb(Ⅱ)的吸附动力学模型 Fig. 5 Adsorption kinetic simulation on Pb(Ⅱ) by PM |
| 表 1 Pb(Ⅱ)的吸附动力学拟合参数 Table 1 model parameters for adsorption kinetics on Pb(Ⅱ) |
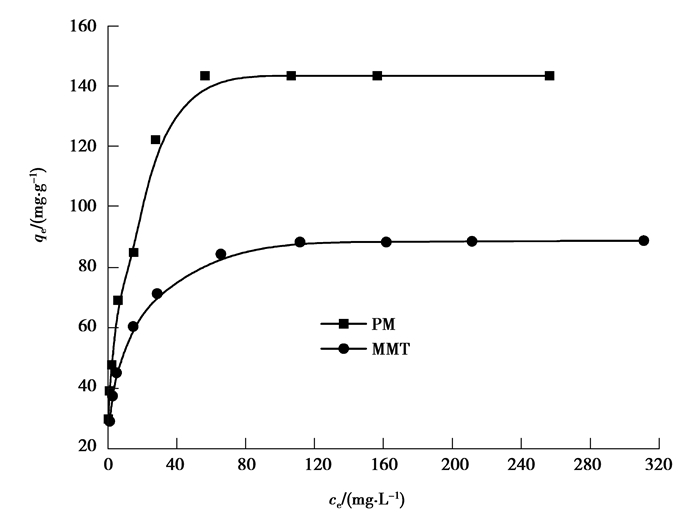
吸附量与平衡质量浓度之间的关系见图 6,刚开始,随着铅离子浓度的增大,铅离子的吸附容量也增加,当初始浓度达到200 mg/L时,吸附量达到143.5 mg/g,PM对Pb(Ⅱ)的吸附量达到MMT对Pb(Ⅱ)吸附量的1.6倍。随着初始浓度的继续增大,吸附量基本保持不变。
|
图 6 Pb(Ⅱ)吸附量与平衡质量浓度之间的关系 Fig. 6 Relationship between adsorption capacity and equilibrium concentration on Pb(Ⅱ) |
为了进一步研究PM对Pb(Ⅱ)的吸附机理,采用Langmuir模型(式(4))和Freundlich模型(式(5))对实验数据进行拟合。Langmuir等温线假设以表面均匀的单分子层吸附,吸附分子之间没有相互作用[20-21],Freundlich等温线假设在非均相表面的多层吸附,吸附活化能分布不均匀[21]。
Langmuir模型
| $ \frac{{{c_{\rm{e}}}}}{{{q_{\rm{e}}}}} = \frac{{{c_{\rm{e}}}}}{{{q_{\rm{m}}}}} + \frac{1}{{{k_{\rm{L}}}{q_{\rm{m}}}}}, $ | (4) |
Freundlich模型
| $ {\mathop{\rm In}\nolimits} \;{q_{\rm{e}}} = {\mathop{\rm In}\nolimits} \;{k_{\rm{F}}} + \frac{1}{n}{\mathop{\rm In}\nolimits} \;{c_{\rm{e}}}, $ | (5) |
式中:qe为吸附平衡吸附量,mg/g;qm为最大吸附量,mg/g;ce为平衡吸附浓度,mg/L;kL为Langmuir模型吸附常数;kF和1/n为Freundlich模型吸附常数。
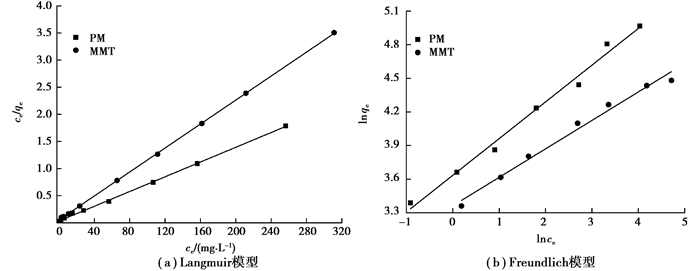
拟合结果见图 7和表 2。图 7和表 2表明,Langmuir模型的R2均高于Freundlich模型,说明在吸附的过程中,MMT和PM对Pb(Ⅱ)的吸附均以单分子层吸附为主[19]。此外,由Langmuir模型求出的MMT和PM的最大吸附量分别为90.09 mg/g和147.06 mg/g,与实验结果相差较小。
|
图 7 MMT和PM对Pb(Ⅱ)的吸附等温线 Fig. 7 Adsorption isotherms on Pb(Ⅱ) by MMT and PM |
| 表 2 Pb(Ⅱ)吸附等温线模型参数 Table 2 model parameters for adsorption isotherms of Pb(Ⅱ) |
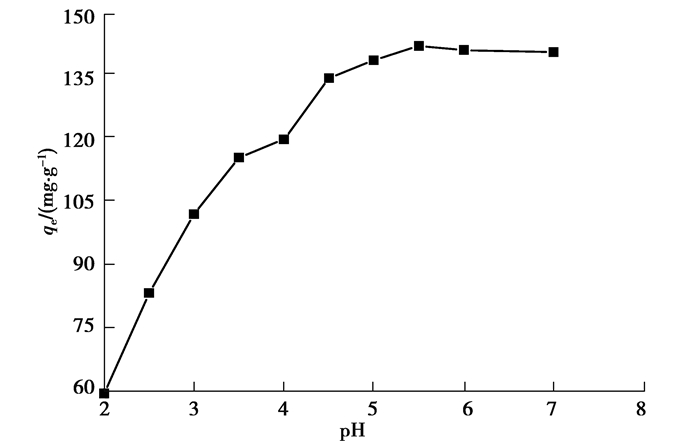
溶液的pH值是影响吸附剂吸附的重要因素[20]。在Pb(Ⅱ)吸附行为中,pH是一个重要的参数,因为质子浓度的变化可以强烈地改变吸附剂的化学形态以及吸附剂的表面电荷。图 8为不同初始pH下,PM对Pb(Ⅱ)吸附能力的影响。在本研究条件下,当pH大于7时,Pb(Ⅱ)以与OH-反应形成沉淀,因此,溶液pH值的影响在2~7范围内进行。pH从2.0增大到7.0,PM对Pb(Ⅱ)吸附量由59.4 mg/g增加到140.5 mg/g。在pH为5.5时,吸附量达到最大。吸附能力随pH值的变化可以从吸附剂的表面电荷和结合位点的质子竞争来合理解释。在低pH值下,可能由于铅离子与质子之间的竞争而抑制了PM对Pb(Ⅱ)的吸附[20]。此外,PM的-OH基团在低pH值下吸附更多的正电荷,吸附剂与Pb(Ⅱ)之间的静电斥力抑制吸附过程。随着溶液pH的增加,质子间的竞争和静电斥力减弱,金属离子的吸附增加[20-21]。
|
图 8 溶液pH值对PM吸附Pb(Ⅱ)的影响 Fig. 8 Effect of solution pH value on Pb(Ⅱ) adsorption by PM |
1) 由钠基蒙脱土和碳酸钙制备了PM,通过SEM分析表明,碳酸钙对钠基蒙脱土形成了“致孔”作用。
2) 吸附动力学研究表明,准二级动力学方程能较好地描述PM对Pb(Ⅱ)的吸附行为,其吸附过程主要为近单分子层的化学吸附。Langmuir模型能更好地描述其吸附行为,25 ℃时PM对Pb(Ⅱ)最大吸附量为143.5 mg/g,MMT对Pb(Ⅱ)的最大吸附量为88.8 mg/g,吸附量提高了1.6倍。
3) 溶液pH对PM吸附Pb(Ⅱ)的影响较大。在低pH值下,吸附收到抑制,pH为5.5时PM对Pb(Ⅱ)的吸附量达到最大。
| [1] |
Bouazza D, Miloudi H, Adjdir M, et al. Competitive adsorption of Cu (Ⅱ) and Zn (Ⅱ) on impregnate raw algerian bentonite and efficiency of extraction[J]. Applied Clay Science, 2018, 151: 118-123. DOI:10.1016/j.clay.2017.10.026 |
| [2] |
Liu W, Zhao C, Wang S, et al. Adsorption of cadmium ions from aqueous solutions using nano-montmorillonite:kinetics, isotherm and mechanism evaluations[J]. Research on Chemical Intermediates, 2018, 44: 1441-1458. DOI:10.1007/s11164-017-3178-y |
| [3] |
Park C W, Kim B H, Yang H M, et al. Enhanced desorption of Cs from clays by a polymeric cation-exchange agent[J]. Journal of Hazardous Materials, 2017, 327: 127-134. DOI:10.1016/j.jhazmat.2016.12.037 |
| [4] |
边凌涛, 张连科, 李海鹏, 等. 壳聚糖/羟基镧复合改性膨润土对Pb(Ⅱ)的吸附特性[J]. 重庆大学学报, 2018, 41(5): 76-84. BIAN Lingtao, ZHANG Lianke, LI Haipeng, et al. Adsorption property on Pb(Ⅱ) of bentonite modified by chitosan/hydroxy-lanthanum[J]. Journal of Chongqing University, 2018, 41(5): 76-84. (in Chinese) |
| [5] |
Marques M, Fernandes B. Cation exchange and surface complexation of lead on montmorillonite and illite including competitive adsorption effects[J]. Applied Geochemistry, 2019, 100: 190-202. DOI:10.1016/j.apgeochem.2018.11.005 |
| [6] |
Ma Y L, LV L, Guo Y R, et al. Porous lignin based poly (acrylic acid)-organo-montmorillonitenanocomposites-swelling behaviors and rapid removal of Pb(Ⅱ)ions[J]. Polymer, 2017, 128: 12-23. DOI:10.1016/j.polymer.2017.09.009 |
| [7] |
Tsai W C, Luna M D G D, Bermillo-Arriesgado H L P, et al. Competitive fixed-bed adsorption of Pb(Ⅱ), Cu(Ⅱ), and Ni(Ⅱ)from aqueous solution using chitosan-coated bentonite[J]. International Journal of Polymer Science, 2016, 6: 1-11. |
| [8] |
Hua C, Zhu P F, Cai M, et al. Comparative adsorption of Pb(Ⅱ), Cu(Ⅱ) and Cd(Ⅱ) on chitosan saturated montmorillonite-Kinetic, thermodynamic and equilibrium studies[J]. Applied Clay Science, 2017, 143: 320-326. DOI:10.1016/j.clay.2017.04.005 |
| [9] |
张帆, 李菁, 谭建华, 等. 吸附法处理重金属废水的研究进展[J]. 化工进展, 2013, 32: 2749-2756. ZHANG Fan, LI Jing, TAN Jianhua, et al. Advance of the treatment of heavy metal wastewater by adsorption[J]. Chemical Industry and Engineering Progress, 2013, 32: 2749-2756. (in Chinese) |
| [10] |
王秀莉, 尚玉俊, 宋丹丹. 新型吸附剂处理重金属废水的研究进展[J]. 工业水处理, 2014, 7: 5-12. WANG Xiuli, SHANG Yujun, SONG Dandan. Research progress in a new type of adsorbents for removing heavy metals from wastewater[J]. Industrial Water Treatment, 2014, 7: 5-12. (in Chinese) |
| [11] |
Vijay B Y, Ranu G, Sippy K. Clay based nanocomposites for removal of heavy metals from water-A review[J]. Journal of Environmental Management, 2019, 232: 803-817. DOI:10.1016/j.jenvman.2018.11.120 |
| [12] |
Ma L, Chen Q, Zhu J, et al. Adsorption ofphenol and Cu (Ⅱ) onto cationic and zwitterionic surfactant modified montmorillonite in single and binary systems[J]. Chemical Engineering Journal, 2016, 283: 880-888. DOI:10.1016/j.cej.2015.08.009 |
| [13] |
Taha A, Shreadah M A, Ahmed A, et al. Cd (Ⅱ), and Ni (Ⅱ) onto Egyptian Na-activated bentonite; equilibrium, kinetics, thermodynamics, and application for seawater desalination[J]. Journal of Environmental Chemical Engineering, 2016, 4: 1166-1180. DOI:10.1016/j.jece.2016.01.025 |
| [14] |
Ninago M D, López O V, Passaretti M G. Mild microwave-assisted synthesis of aluminum-pillared bentonites[J]. Journal of Thermal Analysis & Calorimetry, 2017, 129(3): 1517-1531. |
| [15] |
梁亚琴, 张淑萍, 李慧, 等. 改性蒙脱土去除水中重金属离子研究新进展[J]. 化工进展, 2018, 37(8): 3179-3187. LIANG Yaqin, ZHANG Shuping, LI Hui, et al. Progress in development of modified montmorillonite for adsorption of heavy metal ions[J]. Chemical Industry and Engineering Progress, 2018, 37(8): 3179-3187. (in Chinese) |
| [16] |
Yang J, Yu K, Liu C. Chromium immobilization in soil using quaternary ammonium cations modified montmorillonite-Characterization and mechanism[J]. Journal of Hazardous Materials, 2017, 321: 73-80. DOI:10.1016/j.jhazmat.2016.09.003 |
| [17] |
Wang S, Dong Y, He M, et al. Characterization of GMZ bentonite andits application in the adsorption of Pb (Ⅱ) from aqueous solutions[J]. Applied Clay Science, 2009, 43: 164-171. DOI:10.1016/j.clay.2008.07.028 |
| [18] |
郭堃梅, 马毅杰, 韩和平. 膨润土对Pb2+的吸附性能及影响吸附的主要因素[J]. 环境科学学报, 2000, 20(5): 654-656. GUO Kunmei, MA Yijie, HAN Heping. Adsorption of Pb2+ on Bentonite and major effecting factors[J]. Acta Scientiae Circumstantiae, 2000, 20(5): 654-656. (in Chinese) DOI:10.3321/j.issn:0253-2468.2000.05.032 |
| [19] |
Zhu S D, Xia M Z, Chu Y T, et al. Adsorption and desorption of Pb(Ⅱ) on l-Lysine modified montmorillonite and the simulation of interlayer structure[J]. Applied Clay Science, 2019, 169: 40-47. DOI:10.1016/j.clay.2018.12.017 |
| [20] |
Katayoon K, Mansor B A, Hamid R F M, et al. Rapid and high capacity adsorption of heavy metals by Fe3O4/montmorillonitenanocomposite using response surface methodology:preparation, characterization, optimization, equilibrium isotherms, and adsorption kinetics study[J]. Journal of the Taiwan Institute of Chemical Engineers, 2015, 49: 192-198. DOI:10.1016/j.jtice.2014.10.025 |
| [21] |
Ana-Maria G, Françoise N, ValentinZ, et al. Adsorption of lead(Ⅱ) ions from aqueous solutions onto Cr-pillared clays[J]. Applied Clay Science, 2018, 152: 44-50. DOI:10.1016/j.clay.2017.10.031 |
| [22] |
Liang W D, Liu Y, Sun H X, et al. Robust and all-inorganic absorbent based on natural clay nanocrystals with tunable surface wettability for separation and selective absorption[J]. The Royal Society of Chemistry, 2014, 4: 12590-12595. |
| [23] |
Hannatu A S, Mansor B A, Mohd Z H, et al. Nanocomposite of ZnO with montmorillonite for removal of lead and copper ions from aqueous solutions[J]. Process Safety and Environmental Protection, 2017, 109: 97-105. DOI:10.1016/j.psep.2017.03.024 |
 2019, Vol. 42
2019, Vol. 42


