1b. 重庆大学 钒钛冶金及新材料重庆市重点实验室, 重庆 400044;
1c. 重庆大学 动力工程学院, 重庆 400044;
2. 山东省化工研究院, 济南 250014
1b. Chongqing Key Laboratory of Vanadium-Titanium Metallurgy and Advanced Materials, Chongqing 400044, P. R. China;
1c. School of Power Engineering, Chongqing University, Chongqing 400044, P. R. China;
2. Chemical Technology Academy of Shandong Province, Jinan 250014, P. R. China
二氧化钛加碳沸腾氯化制备四氯化钛技术被视为最具前景的方法,受到国内外广泛关注并开展了加碳促进TiO2氯化反应进程的研究[1-6]。有研究发现,加碳氯化体系中存在大量的CO[7],其在氯化过程中所起的作用不可忽视。Gamboa等[8]曾提出CO可能是促进TiO2氯化的因素之一,Dunn[9]通过实验研究发现CO对TiO2氯化的促进作用不如碳高效。然而,通过传统的热力学计算和动力学实验的分析和推测[6, 8-10],并未揭示钛氧化物加碳催化氯化反应的本征过程。近年来,基于密度泛函理论的第一性原理在揭示物质化学性质、相互作用、化学反应本质等方面有着很好的应用[11-18],其中Perron等[13]利用密度泛函理论计算了不同晶型的二氧化钛,对比得出金红石型TiO2是最稳定的晶相,此外还对比了金红石型TiO2不同表面的稳定性,得出TiO2(110)面是最稳定的表面。Vogtenhuber等[15]探究了Cl原子在有O缺陷存在的TiO2(110)面的吸附反应,并通过吸附能的计算得出Cl原子最稳定的吸附位为桥氧空位,对于完整的TiO2(110)面,Cl原子更倾向于吸附到5配位Ti原子上。Inderwildi等[18]研究了Cl在TiO2(110)面上的吸附、扩散以及解离等行为,得出5配位Ti对Cl2分子的捕获率较低。Sorescu[19]和Yang[20]等探究了CO在TiO2(110)表面上的吸附,认为5配位Ti原子上Ti-CO吸附结构更为稳定,且以物理吸附为主。对TiO2(110)表面上发生的各种单独吸附行为已有很多报道,但很少有研究涉及CO和Cl2同时作用于TiO2(110)表面的吸附行为或CO促进氯化反应机制。
在本研究中拟基于密度泛函理论,利用CASTEP(Cambridge Sequential Total Energy Package)软件包构造金红石TiO2(110)表面,并对CO和Cl2作用于该表面时所发生的吸附反应进行计算分析,揭示CO和Cl2同时作用于TiO2(110)表面的吸附行为,为进一步探究钛氧化物的加碳氯化催化反应机理过程奠定基础。
1 计算方法和模型本研究中所有的计算均采用基于赝势平面波基组的DFT方法来完成[21]。计算过程中所有原子均选用超软赝势(ultrasoft pseudopotentials)[22]来模拟自由电子体系中的电子势,所采用的交换关联泛函为GGA-PBE型交换关联泛函[23]。计算中所有模型的单个原子能量、最大力、最大应变以及最大位移的收敛精度分别设置为1.0×10-5eV、0.3 eV/nm、0.05 GPa以及0.1 pm,计算体系的截断能设置为400 eV,布里渊区的波基组的选取采用Monkhorst-Pack (MP)方法,TiO2(110)超胞的K点设置为2×1×1。体系截断能以及K点的设置均由收敛性测试最终确定。
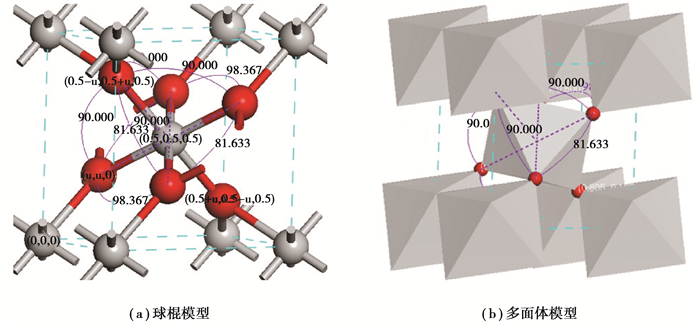
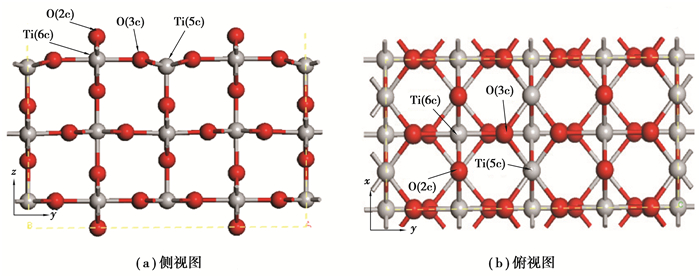
金红石型TiO2晶胞属于P42/mnm (No. 136)空间群,晶格常数分别为a=b=0.458 7 nm, c=0.295 4 nm, u=0.305, c/a=0.644[24]。一个Ti原子分别与6个O原子键合形成一个微变形八面体,Ti原子位于八面体中心,6个O原子分别位于八面体的6个顶角处[25],如图 1所示。TiO2(110)面是金红石最稳定的一个面[13, 26],主要由2种类型的Ti原子(6配位的Ti(6c)和5配位的Ti(5c))以及2种类型的O原子(3配位的O(3c)和2配位的O(2c))构成[13],如图 2所示。由于表面的驰豫作用,表层的Ti(5c)原子和O(2c)原子向下凹陷了一定距离,而Ti(6c)和O(3c)原子则向上移动了一定距离[17]。本研究中建立了2×2×1(包含有24个Ti原子和48个O原子)的TiO2(110)超晶胞模型,晶胞厚度为9个原子层[27-28],即3个O-Ti-O周期层,其中底部的2个O-Ti-O层完全固定、顶层的O-Ti-O层完全驰豫。为了避免相邻晶胞之间的相互作用,设置了厚度为2 nm的真空层[29]。
|
图 1 金红石型TiO2的晶体结构。图中红色球为O原子,灰色球为Ti原子 Fig. 1 Crystal structure of rutile TiO2, in which the grey and red balls represent the Ti and O atoms respectively |
|
图 2 优化后的金红石型TiO2(110)面 Fig. 2 The optimized TiO2(110) surface |
用吸附能Ea表示吸附体系的稳定性,并将其定义为[30]:
| $ {E_{\rm{a}}} = {E_{{\rm{system}}}} - ({E_{{\rm{surface}}}} + {E_{{\rm{C}}{{\rm{l}}_{\rm{2}}}}} + {E_{{\rm{CO}}}})。$ | (1) |
式中:Ea、Esystem、Esurface、ECl2、ECO分别表示体系的吸附能、吸附体系的总能、自由面的总能、纯Cl2分子的总能以及CO分子的总能;Ea越低,体系越稳定。
用差分电荷密度表示吸附成键时的电荷密度变化情况如下[31]:
| $ \Delta \rho = {\rho _{\left( {{\rm{C}}{{\rm{l}}_{\rm{2}}} + {\rm{CO}}} \right)@{\rm{Ti}}{{\rm{O}}_{\rm{2}}}(110)}} - ({\rho _{{\rm{C}}{{\rm{l}}_{\rm{2}}}}} + {\rho _{{\rm{CO}}}} + {\rho _{{\rm{Ti}}{{\rm{O}}_{\rm{2}}}(110)}})。$ | (2) |
式中:
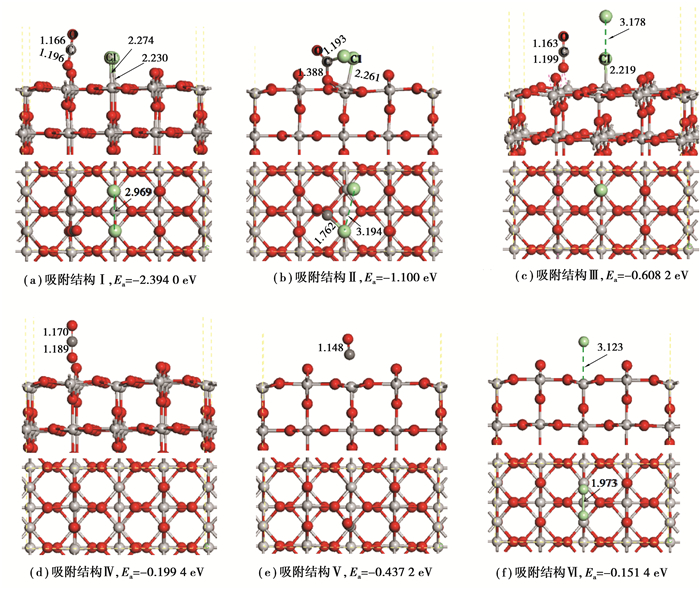
图 3为CO和Cl2在TiO2(110)面上的6种典型吸附结构,分别用Ⅰ、Ⅱ、Ⅲ、Ⅳ、Ⅴ、Ⅵ表示。CO无论是单独吸附还是与Cl2共同作用,均能与表面O(2c)原子形成平均键长0.119 5 nm的C-O(2c)键并将其从表面夺走,形成CO2分子,如图 3(a)(c)和(d)所示。当CO和Cl2共同作用于TiO2(110)表面时,CO被(110)面捕获并与O(3c)原子形成键长0.138 8 nm的C-O(3c)键,且该O(3c)原子明显突出所在表面,O(3c)-Ti(6c)键发生断裂,如图 3(b)所示;而CO单独作用于TiO2(110)表面时与O(3c)原子无明显作用,如图 3(e);吸附过程中,Cl2分子发生解离,2个Cl原子距离平均延长至0.302 0 nm,几乎无相互作用,生成的Cl原子分别与附近的C原子和Ti(5c)原子形成键长为0.119 3 nm的C-Cl键(图 3(b))和平均0.224 6 nm的Ti-Cl键(图 3(a)(b)和(c)),新成键的Ti(5c)原子在Cl原子的作用下突出所在表面,甚至与内部的1个3配位O原子发生了断键(图 3c),而Cl2单独作用TiO2(110)表面时与Ti(5c)原子无明显作用,如图 3(f)所示。结合各体系的吸附能发现,共同作用吸附体系的吸附能总体低于单独作用体系,说明CO和Cl2共同作用于TiO2(110)面时体系更稳定。比较图 3(a)(b)和(c)体系的吸附能发现:存在游离Cl原子的体系较不稳定;游离Cl原子结合表面Ti(5c)原子的体系比结合C原子的体系更稳定。由此可见,体系(b)和(c)还有着进一步稳定的可能,而各体系的成键与断键反应似乎还预示着TiO2(110)结构在CO和Cl2的共同作用下有可能被瓦解。
|
图 3 CO和Cl2分子在TiO2(110)面上不同位置的吸附结构。每个图的上方为正视图,下方为俯视图,C、O和Cl原子分别为灰色、红色和绿色,红色虚线表示范德华力作用,绿色虚线标记距离,无实际意义 Fig. 3 Schematic diagram of adsorption structure of CO and Cl2 onto TiO2(110) surface. The upper part is the positive view and the bottom is the top view. The C, O and Cl atoms are in grey, red and green respectively. The red dashed lines represent van der Waals forces while the green dotted lines is used to mark distance without any practical significance |
CO单独作用于TiO2(110)面时能夺走O(2c)原子却不能结合O(3c)原子,如图 3中(d)和(e)所示,说明O(2c)原子更具活性,正常TiO2晶胞中的O原子配位数为3,而O(2c)原子为2配位,说明其所具有的活性是其配位数降低的表现。此外,Cl2单独跟TiO2(110)表面几乎没有作用,说明CO与(110)面上O原子的结合强于Cl2与该面上的Ti原子的结合。
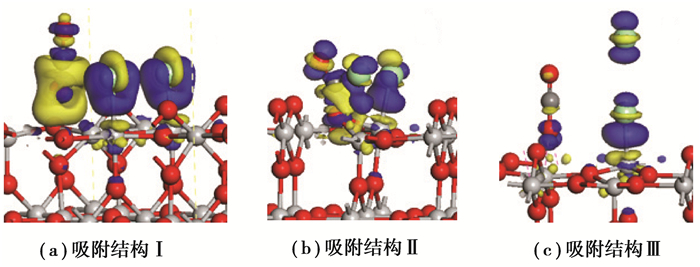
2.2 电荷密度分析差分电荷密度非常形象地显示了化学反应期间分子或团簇等键合到表面时电荷密度的变化情况,如图 4所示。CO和Cl2吸附到TiO2(110)上,与表面Ti原子成键的Cl原子周围区域总体呈现蓝色,而其下的钛原子附近区域呈现黄色,说明在形成Ti-Cl键的过程中,Cl原子得电子而Ti原子失电子。同样,CO分子在与表面O原子成键后,C原子附近区域呈现黄色,说明其在成键过程中失去电子,而对于从表面解离出来的O(2c)原子,其下部靠近Ti(6c)原子的附近呈现黄色区域,而上部分靠近C原子的附近区域呈现蓝色,说明该O原子在断键(Ti-O)后原本从Ti(6c)原子那里得来的部分电子被重新归还,同时又从C原子那里得到新电子。图中Cl原子以及CO分子上部存在一定的黄色区域,实际上是在靠近并接触TiO2(110)面时发生了极化所致。
|
图 4 CO和Cl2吸附在TiO2(110)面上的差分电荷密度图。等值面的值取0.000 05 e/nm3, 蓝色区域和黄色区域分别代表电荷的聚集和损失 Fig. 4 Differential charge density for adsorption of Cl2 and CO on TiO2(110) surface. The isosurface level is 0.000 05e/nm3. The blue and yellow colors indicate the electron accumulation and depletion, respectively. |
穆林肯电荷分析能较好地量化Cl2和CO吸附在TiO2(110)面上的电荷转移情况[32]。表 1所示为CO、Cl2分子以及吸附结构Ⅰ, Ⅱ和Ⅲ中CO和Cl原子的价电子轨道上的电荷分布和转移量。不难看出,各个吸附体系中所有标记的Cl原子均得电子(其中吸附结构Ⅰ得0.26e、Ⅱ得0.23e、Ⅲ得0.19e),所有标记的CO分子均失电子(其中Ⅰ失0.54e、Ⅱ失0.10e、Ⅲ失0.58e),由此可以推断与C原子对应成键的O(2c)原子必然得电子,从而形成C-O键;而与Cl原子对应成键的Ti(5c)原子必然失电子,从而形成Ti-Cl键,该结果与差分电荷密度的分析相吻合。吸附发生时体系的电子流向应为CO→TiO2(110)→Cl。
| 表 1 Cl2和CO吸附在TiO2(110)面上的穆林肯电荷分析* Table 1 Mulliken charge analysis for adsorption of Cl2 and CO on TiO2(110) surface* |
各个轨道上的得失电子现象可以用杂化轨道理论来解释。Cl的电子排布为1s22s22p63s23p5,Ti的电子排布为1s22s22p63s23p64s23d2,Ti原子的4s轨道和3p轨道首先发生sd3杂化,形成的sd3轨道再和Cl原子的3p轨道作用形成Ti-Cl键;C原子的轨道电子排布为1s22s22p2,O原子的电子排布为1s22s22p4,C原子的2s轨道和2p轨道首先发生sp杂化,形成的sp轨道再和O原子的2p轨道作用形成C-O键。这就是成键过程中C原子s轨道失电子而p轨道得电子、Cl原子s轨道上电子数几乎不变而p轨道得电子的原因。
2.3 态密度分析对TiO2(110)面上Ti(5c)原子与O(3c)原子的分波态密度(PDOS)进行了分析,结果如图 5所示。对于TiO2(110)自由面,总DOS曲线的价带顶端主要由O原子的定域轨道2p贡献,形成成键轨道,而导带底端主要由Ti原子的非定域轨道3d贡献,形成反键轨道[33]。吸附发生后,对比自由面上Ti(5c)原子与O(3c)原子的态密度,其反键轨道对应的态密度往低能级方向迁移甚至跨过了费米能级(图 5(b)和(d)),导致反键轨道所处的能级能量降低,即电子分布在反键轨道上所需的能量降低,使得电子更易跃迁到反键轨道上,从而增强了反键作用;图 5(c)中成键轨道态密度跨度的增加是由于O(3c)原子与CO结合所致,并非说明Ti(5c)-O(3c)成键轨道作用增强,在O(3c)结合CO之后,Ti(5c)-O(3c)成键轨道态密度强度仍然有所降低,更能说明其成键作用的减弱。由此可以断定CO和Cl2的吸附削弱了表面O(3c)-Ti(5c)键的强度,而O(3c)-Ti(5c)键的强度是TiO2(110)表面稳定性的保证。
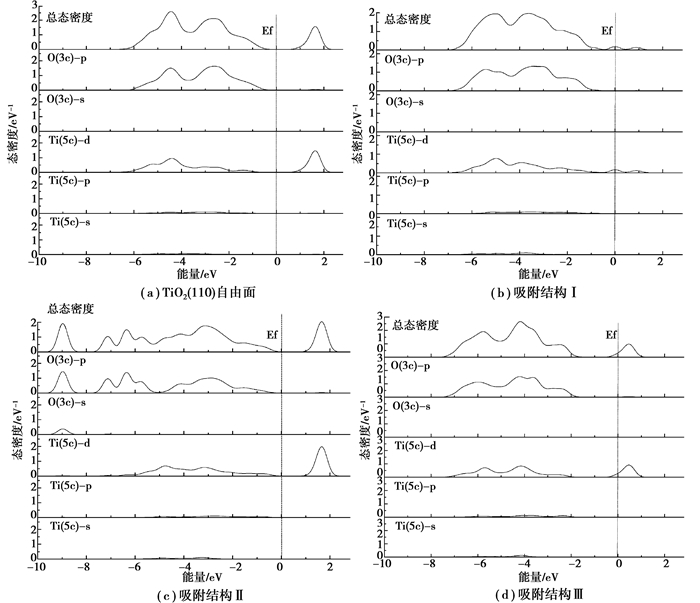
|
图 5 Ti(5c)原子与O(3c)原子的分波态密度, 图中Energy=0处的竖直虚线表示费米能级(Ef) Fig. 5 Partial density of states (PDOS) for O(3c) and Ti(5c) atoms of TiO2(110) surface. The dashed vertical line at energy = 0 eV indicates the Fermi level (Ef). |
Ti(5c)-O(3c)键强度减弱反映在吸附后的晶体结构上是对应键长增加,Ti(5c)原子或O(3c)原子向真空层凸起(图 3),断键趋势较大。进而可说明CO和Cl2的共同吸附发生后很有可能破坏TiO2(110)的原有晶体结构,在接下来继续通入Cl2的过程中,TiO2晶体结构被逐步瓦解。Hoffmann[34]也曾提到吸附分子与固体表面成键之后,在表面和吸附分子的内部,成键作用将会被减弱。而在本研究中发生吸附形成C-O键以及Ti-Cl键的过程中,电子从一个组分的成键轨道转移到了另一个组分的反键轨道,例如在被吸附的Cl2分子与表面之间形成Ti-Cl键时,TiO2和Cl2内部的成键作用被减弱了,因而导致以上吸附结构中Cl-Cl键和TiO2(110)表面及内部的一些Ti-O键断裂。
2.4 能量反应路径基于线性同步变换和二次同步变换(completed LST/QST)[35-38]方法对Ⅱ和Ⅲ吸附体系进行了能量反应路径的探索,反应依据式为:TiO2+2Cl2+2CO=TiCl4+2CO2。Cl2和CO吸附在TiO2(110)面上的吸附能分别为-0.100 1 eV(图 6(a))和0.608 2 eV(图 6(b))(IS),CO2穿过13.637 5 eV的能垒从表面解离形成过渡态(TS),然后释放14.688 2 eV的能量从而形成CO2(FS),整个反应过程释放能量1.050 7 eV,如图 6(a)所示。游离的Cl原子被吸附表面上的另一个Ti(5c)原子捕获需要首先跨越0.459 1 eV能垒(TS)然后释放2.245 5 eV能量(FS),整个捕获过程释放1.786 4 eV能量,如图 6(b)所示。
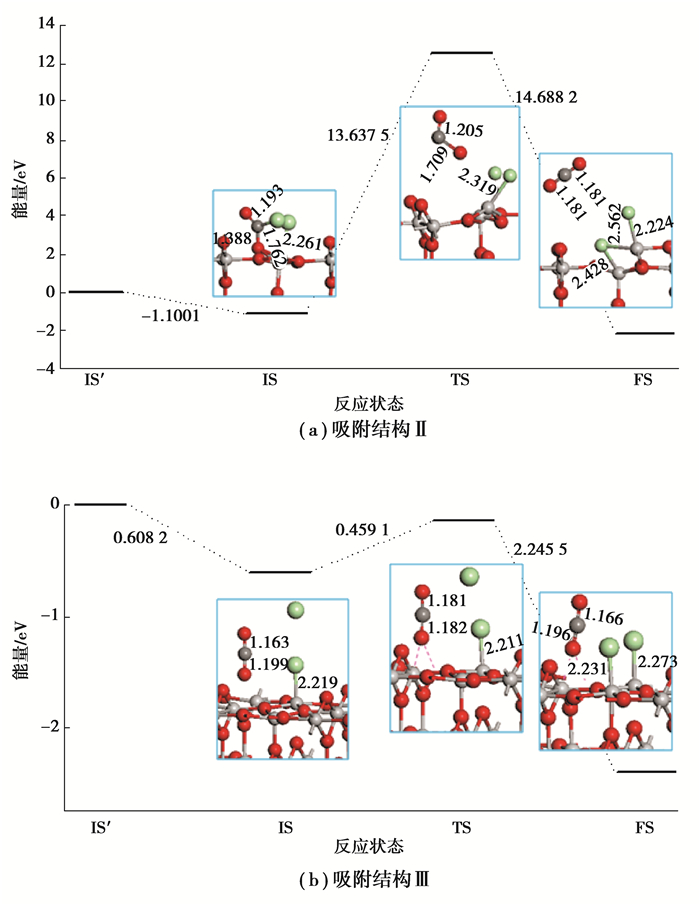
|
图 6 CO2解吸附过程的能量演化路径,IS′对应TiO2(110)面、CO和Cl2分子的自由状态;IS对应反应初态;TS对应反应过渡态;FS对应终态 Fig. 6 The energy profiles for reaction pathway of desorption of CO2 from TiO2(110). IS′ refers to a state of free TiO2(110)surface, free CO and Cl2 molecules, IS to a state of adsorption of Cl2 and CO on TiO2(110) surface, TS to a state of transformation of CO2 species into transition state on surface, and FS to a state of formation of CO2 |
通过密度泛函理论方法对CO和Cl2在TiO2(110)表面的吸附机理进行研究,得出如下结论。
1) CO和Cl2在TiO2(110)表面的吸附存在相互促进的作用关系,即CO与表面O原子的结合促进Cl2与表面Ti原子的结合,Cl2与表面Ti原子的结合同时也促进CO与表面O原子的结合。CO与TiO2(110)面的O原子的作用强于Cl2与该面上的Ti原子的作用,TiO2氯化的激发点在于CO是否与表面O原子结合成键。
2) Ti和C原子分别发生sd3杂化和sp杂化形成Ti-Cl和C-O键,成键的瞬间在TiO2(110)表面构成短距离的电子转移通道,电子转移流动的方向为CO→TiO2(110)→Cl。
3) C-O以及Ti-Cl键的形成削弱了TiO2(110)表面以及内部Ti-O键的强度,激活了表面的Ti、O原子,促使部分Ti-O键断裂,为下一个Cl-Ti以及C-O键的形成做准备。
4) CO2从TiO2(110)表面的解离反应为放热反应,氯化过程中若提供一定的反应能量,则很有可能发生该解离反应,在表面生成O空位缺陷,为下一个Cl2分子提供新的吸附位点。
| [1] |
王玉明, 刘瑞丰, 周荣会, 等. 制备四氯化钛过程中加碳氯化反应热力学[J]. 计算机与应用化学, 2006, 23(3): 263-266. WANG Yuming, LIU Ruifeng, ZHOU Ronghui, et al. Thermodynamics on the reaction of carbochlorination of titania for getting titanium tetrachloride[J]. Computers and Applied Chemistry, 2006, 23(3): 263-266. (in Chinese) DOI:10.3969/j.issn.1001-4160.2006.03.009 |
| [2] |
Adipuri A, Zhang G Q, Ostrovski O. Chlorination of titanium oxycarbide produced by carbothermal reduction of rutile[J]. Metallurgical and Materials Transactions B, 2008, 39(1): 23-34. DOI:10.1007/s11663-007-9117-3 |
| [3] |
Youn I J, Park K Y. Modeling of fluidized bed chlorination of rutile[J]. Metallurgical and Materials Transactions B, 1989, 20(6): 959-966. DOI:10.1007/BF02670201 |
| [4] |
Zhou L, Sohn H Y. Mathematical modeling of fluidized-bed chlorination of rutile[J]. AIChE Journal, 1996, 42(11): 3102-3112. DOI:10.1002/aic.690421110 |
| [5] |
Morris A J, Jensen R F. Fluidized-bed chlorination rates of australian rutile[J]. Metallurgical Transactions B, 1976, 7(1): 89-93. DOI:10.1007/BF02652823 |
| [6] |
Barin I, Schuler W. On the kinetics of the chlorination of titanium dioxide in the presence of solid carbon[J]. Metallurgical Transactions B, 1980, 11(2): 199-207. DOI:10.1007/BF02668402 |
| [7] |
邓国珠. 钛冶金[M]. 北京: 冶金工业出版社, 2010: 109-146. DENG Guozhu. Metallurgy on titanium[M]. Beijing: Metallurgical Industry Press, 2010: 109-146. (in Chinese) |
| [8] |
Gamboa J A, Bohé A E, Pasquevich D M. Carbochlorination of TiO2[J]. Thermochimica Acta, 1999, 334(1/2): 131-139. |
| [9] |
Dunn W E. High temperature chlorination of titanium bearing minerals:part Ⅳ[J]. Metallurgical Transactions B, 1979, 10(2): 271-277. DOI:10.1007/BF02652471 |
| [10] |
Gamboa J A, Pasquevich D M. A model for the role of carbon on carbochlorination of TiO2[J]. Metallurgical and Materials Transactions B, 2000, 31(6): 1439-1446. DOI:10.1007/s11663-000-0028-9 |
| [11] |
王锦涛, 韩校宇, 刘守平, 等. Si、V对Fe-Al-Cr合金抗高温氧化性的影响[J]. 重庆大学学报, 2019, 42(2): 82-93. WANG Jintao, HAN Xiaoyu, LIU Shouping, et al. Effect of Si and V on high-temperature oxidation resistance of Fe-Al-Cr alloys[J]. Journal of Chongqing University, 2019, 42(2): 82-93. (in Chinese) |
| [12] |
谢奉妤, 高家诚, 王宁, 等. Zn掺杂锐钛矿TiO2的电子结构及光学性质的研究[J]. 重庆大学学报, 2017, 40(10): 79-86. XIE Fengyu, GAO Jiacheng, WANG Ning, et al. Electronic structure and optical properties of Zn-doped anatase TiO2[J]. Journal of Chongqing University, 2017, 40(10): 79-86. (in Chinese) DOI:10.11835/j.issn.1000-582X.2017.10.009 |
| [13] |
Perron H, Domain C, Roques J, et al. Optimisation of accurate rutile TiO2 (110), (100), (101) and (001) surface models from periodic DFT calculations[J]. Theoretical Chemistry Accounts, 2007, 117(4): 565-574. DOI:10.1007/s00214-006-0189-y |
| [14] |
Lu J B, Yang K S, Jin H, et al. First-principles study of the electronic and magnetic properties of oxygen-deficient rutile TiO2(110) surface[J]. Journal of Solid State Chemistry, 2011, 184(5): 1148-1152. DOI:10.1016/j.jssc.2011.03.037 |
| [15] |
Vogtenhuber D, Podloucky R, Redinger J. Ab initio study of atomic Cl adsorption on stoichiometric and reduced rutile TiO2 (110) surfaces[J]. Surface Science, 2000, 454/455/456: 369-373. |
| [16] |
Hebenstreit E L D, Hebenstreit W, Geisler H, et al. The adsorption of chlorine on TiO2(110) studied with scanning tunneling microscopy and photoemission spectroscopy[J]. Surface Science, 2002, 505: 336-348. DOI:10.1016/S0039-6028(02)01385-7 |
| [17] |
Vogtenhuber D, Podloucky R, Redinger J, et al. Ab initio and experimental studies of chlorine adsorption on the rutile TiO2(110) surface[J]. Physical Review B, 2002, 65(12): 125411. DOI:10.1103/PhysRevB.65.125411 |
| [18] |
Inderwildi O R, Kraft M. Adsorption, diffusion and desorption of chlorine on and from rutile TiO2{110}:a theoretical investigation[J]. ChemPhysChem, 2007, 8(3): 444-451. DOI:10.1002/cphc.200600653 |
| [19] |
Sorescu D C, Yates J T. Adsorption of CO on the TiO2(110) surface:a theoretical study[J]. The Journal of Physical Chemistry B, 1998, 102(23): 4556-4565. DOI:10.1021/jp9801626 |
| [20] |
Yang Z X, Wu R Q, Zhang Q M, et al. First-principles study of the adsorption of CO on TiO2(110)[J]. Physical Review B, 2001, 63(4): 045419. DOI:10.1103/PhysRevB.63.045419 |
| [21] |
Segall M D, Lindan P J D, Probert M J, et al. First-principles simulation:ideas, illustrations and the CASTEP code[J]. Journal of Physics:Condensed Matter, 2002, 14(11): 2717-2744. DOI:10.1088/0953-8984/14/11/301 |
| [22] |
Kresse G, Hafner J. Norm-conserving and ultrasoft pseudopotentials for first-row and transition elements[J]. Journal of Physics:Condensed Matter, 1994, 6(40): 8245-8257. DOI:10.1088/0953-8984/6/40/015 |
| [23] |
Perdew J P, Burke K, Ernzerhof M. Generalized gradient approximation made simple[J]. Physical Review Letters, 1996, 77(18): 3865. DOI:10.1103/PhysRevLett.77.3865 |
| [24] |
Muscat J, Swamy V, Harrison N M. First-principles calculations of the phase stability of TiO2[J]. Physical Review B, 2002, 65(22): 224112. DOI:10.1103/PhysRevB.65.224112 |
| [25] |
Grant F A. Properties of rutile (titanium dioxide)[J]. Reviews of Modern Physics, 1959, 31(3): 646. DOI:10.1103/RevModPhys.31.646 |
| [26] |
Ramamoorthy M, Vanderbilt D, King-Smith R D. First-principles calculations of the energetics of stoichiometric TiO2 surfaces[J]. Physical Review B, 1994, 49(23): 16721. DOI:10.1103/PhysRevB.49.16721 |
| [27] |
Zhu J, Jin H, Chen W J, et al. Structural and electronic properties of a W3O9 cluster supported on the TiO2(110) surface[J]. The Journal of Physical Chemistry C, 2009, 113(40): 17509-17517. DOI:10.1021/jp906194t |
| [28] |
Martsinovich N, Jones D R, Troisi A. Electronic structure of TiO2 surfaces and effect of molecular adsorbates using different DFT implementations[J]. The Journal of Physical Chemistry C, 2010, 114(51): 22659-22670. DOI:10.1021/jp109756g |
| [29] |
Bates S P, Kresse G, Gillan M J. A systematic study of the surface energetics and structure of TiO2(110) by first-principles calculations[J]. Surface Science, 1997, 385(2/3): 386-394. |
| [30] |
Zhong H, Wen L Y, Zou C, et al. A mechanistic study of the interaction among C, N and Ti3O5(100) surface based on density functional theory[C]//TMS2015 Supplemental Proceedings. Hoboken, NJ, USA: John Wiley & Sons, Inc., 2015: 799-810.
|
| [31] |
Song E H, Zhu Y F, Jiang Q. Density functional theory calculations of adsorption of hydrogen fluoride on titanium embedded graphene[J]. Thin Solid Films, 2013, 546: 124-127. DOI:10.1016/j.tsf.2013.02.047 |
| [32] |
杨亚丽, 陈文凯, 陆春海, 等. H2S在立方ZrO2(110)面的吸附与解离[J]. 无机化学学报, 2009, 25(8): 1457-1463. YANG Yali, CHEN Wenkai, LU Chunhai, et al. Density functional theory study of H2S adsorption and decomposition on cubic ZrO2(110) surface[J]. Chinese Journal of Inorganic Chemistry, 2009, 25(8): 1457-1463. (in Chinese) DOI:10.3321/j.issn:1001-4861.2009.08.024 |
| [33] |
Wang Y, Hwang G S. Adsorption of Au atoms on stoichiometric and reduced TiO2(110) rutile surfaces:a first principles study[J]. Surface Science, 2003, 542(1/2): 72-80. |
| [34] |
Miller G J. Book review:solids and surfaces:a chemist's view of bonding in extended structures by R. Hoffmann[J]. Angewandte Chemie International Edition in English, 1989, 28(8): 1070. |
| [35] |
Zhang R G, Liu H Y, Li J R, et al. A mechanistic study of H2S adsorption and dissociation on Cu2O(111) surfaces:thermochemistry, reaction barrier[J]. Applied Surface Science, 2012, 258(24): 9932-9943. DOI:10.1016/j.apsusc.2012.06.053 |
| [36] |
Liu H Y, Wang B J, Fan M H, et al. Study on carbon deposition associated with catalytic CH4 reforming by using density functional theory[J]. Fuel, 2013, 113: 712-718. DOI:10.1016/j.fuel.2013.06.022 |
| [37] |
Zhang R G, Wang B J, Ling L X, et al. Adsorption and dissociation of H2 on the Cu2O(111) surface:a density functional theory study[J]. Applied Surface Science, 2010, 257(4): 1175-1180. DOI:10.1016/j.apsusc.2010.07.095 |
| [38] |
Zhang Y L, Zhao H B, Guo L, et al. Decomposition mechanisms of Cu-based oxygen carriers for chemical looping with oxygen uncoupling based on density functional theory calculations[J]. Combustion and Flame, 2015, 162(4): 1265-1274. DOI:10.1016/j.combustflame.2014.10.018 |
 2019, Vol. 42
2019, Vol. 42


